Статтю опубліковано на с. 15-17
У жінок із багаторазовими невдачами імплантації в ЕКЗ-циклах деякі автори відмічали різні імунні порушення: підвищений рівень та підвищену активність натуральних кілерів (НК) [1–5], значне підсилення імунної відповіді Th1-типу, збільшену експресію активаційних маркерів у субпопуляціях Т-лімфоцитів [6], порушення балансу в експресії KIR-рецепторів на НК-клітинах [7–9], підвищений рівень NKT-клітин [10]. Була спроба встановити критичні рівні НК та НК-цитотоксичності, вище від яких частіше спостерігали невдачі в ЕКЗ-циклах [11].
Нами були опрацьовані 11 параметрів імунної акцентуації (ІА), за допомогою яких були встановлені умовні границі ЕКЗ-фертильності, або «успішний коридор», з використанням імунологічних показників [9]. Поодинокі ІА не є критичними для ЕКЗ. Лише 3 та більше ІА асоціюються з ЕКЗ-невдачами [12]. Застосування внутрішньовенного імуноглобуліну (ВІГ) у пацієнток із багаторазовими невдачами імплантації в ЕКЗ-циклах вже має 20-річну історію. Перші спостереження на невеликій кількості пацієнток були дуже оптимістичні, але в подальшому результати використання ВІГ характеризувались у широкому діапазоні — від успішних до сумнівних [13–15]. Були різні підходи до оцінки імунних показників при терапії з використанням ВІГ [16, 17]. У цій роботі ми провели аналіз ефективності ВІГ у пацієнток із багаторазовими невдачами імплантації в ЕКЗ-циклах із застосуванням імунологічних показників, що характеризують умови для ЕКЗ як сприятливі або несприятливі, які були нами описані раніше [12].
Матеріали і методи
Обстежено було 238 жінок віком 23–35 років із багаторазовими невдачами імплантації в ЕКЗ-циклах (3 та понад) із доброю якістю ембріонів та їх кількістю (2 ембріони високої якості для кожного переносу), які підлягали черговому ЕКЗ-циклу. 123 жінки віком 32,9 ± 0,5 року не отримували додаткового лікування й не отримували імуноглобулін (група А); 115 жінок віком 33,0 ± 0,5 року отримували внутрішньовенну інфузію 200–400 мг/кг нормального внутрішньовенного імуноглобуліну людини (Біовен Моно, «Біофарма», Україна) безпосередньо перед проведенням ЕКЗ-процедури (група В). Тривалість непліддя в групі А була 7,1 ± 1,9 року, у групі Б — 7,0 ± 1,8 року. Трубний фактор непліддя в цих групах був зареєстрований у 52 та 53 % відповідно. Автоімунні захворювання, хромосомні, ендокринні, інфекційні фактори при обстеженні й в анамнезі не були відмічені. Пацієнтки заперечували наявність дітей і спонтанних абортів. У дослідження не включали жінок із чоловічим фактором непліддя.
Використовували довгий лютеїновий протокол з a-GnRH (Diferelin, Ipsen Pharma, Франція) з контролем гіперстимуляції яєчника за допомогою рекомбінантного ФСГ (Gonal-F, Merk-Serono S.A., Швейцарія).
Зразки периферичної крові пацієнток отримували на 17-ту — 23-тю добу менструального циклу перед стимуляцією гонадотропіном в ЕКЗ-процедурі й перед введенням ВІГ.
Субпопуляції лімфоцитів, експресію на них активаційних та інших маркерів, а також цитотоксичність натуральних кілерів вимірювали за допомогою проточної цитометрії з використанням приладу та моноклональних антитіл фірми BD Biosciences (CША).
У цій роботі використовували імунні акцентуації, розроблені нами раніше [12]: СD56+CD3+ > 18 %; CD158+CD3+ > 5 %; CD4+CD3+ < 40 %; HLA DR+ CD8+CD3+ > 30 %; СD56+CD3– > 21 %; HLA DR+CD56+ CD3– > 25 %; CD8+CD56+CD3– > 64 %; CD8+CD56+CD3– < 40 %; CD158a+CD56+CD3– > 65 %; CD158a+CD56+CD3– < 17 %; цитотоксичність натуральних кілерів: лізис 1 : 10 > 30 %; цитотоксичність натуральних кілерів: лізис 1 : 20 > 40 %.
Статистичну обробку проводили з використанням програми In Stat для Windows (версія 3.0, Graph Pad Software Inc., Сан-Дієго, США). Вірогідність різниці встановлювали за тестом Манна — Уїтні (непарний, непараметричний, двохвостий). Відмінності вважали вірогідними при p < 0,05.
Результати і їх обговорення
Сімдесят п’ять пацієнток групи А (підгрупа 1а) мали ЕКЗ-невдачу в актуальному ЕКЗ-циклі, але у 48 настала вагітність після ЕКЗ-процедури: у підгрупі 2а (18 пацієнток) вагітність закінчилася викиднем, у підгрупі 3а (30 пацієнток) вагітність закінчилася успішно, народженням живої дитини. У групі В ЕКЗ-невдача зареєстрована в 64 пацієнток (підгрупа 1в), у 14 пацієнток вагітність закінчилася викиднем (підгрупа 2в), у 37 пацієнток вагітність була успішною (підгрупа 3в).
Для вивчення значення множинних ІА пацієнтки груп А та В були розділені ще на три інші підгрупи: у пацієнток підгруп А1 та В1 не було ІА або була лише одна ІА, у підгрупах А2 та В2 відмічено дві ІА, у підгрупах А3 та В3 зареєстровано 3 та понад ІА.
Серед 123 жінок, яким не призначали ВІГ (група А), вагітність настала у 48 пацієнток (39 %) після ЕКЗ. У групі В зі 115 жінок, які отримували ВІГ, вагітність розвинулась у 51 пацієнтки (44 %), але різниця не була вірогідною. Народження живої дитини в групі А було в 24,4 % (30/115), а в групі В — у 32,2 % (37/115), різниця невірогідна.
Пацієнтки групи В після застосування ВІГ у першому триместрі вагітності мали менше число спонтанних абортів (27,4 % (14/51)) порівняно з пацієнтками групи А, які не отримували ВІГ (18/48), але різниця була невірогідною. Показник ЕКЗ-втрат у групі В після ВІГ-корекції був 27 % (64/115), а без ВІГ-терапії в групі А — 32 % (75/123), різниця невірогідна.
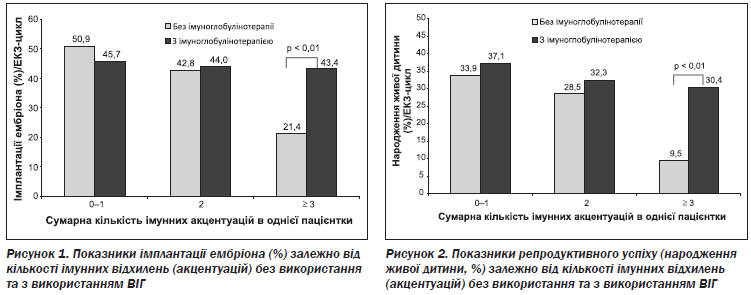
Показники імплантації в підгрупах В1 (без ІА або з однією ІА) та В2 (дві ІА) (34,7 та 44,1 % відповідно), у яких проводилась ВІГ-терапія, не відрізнялись вірогідно від показників у підгрупах А1 та А2 (50,9 і 42,8 % відповідно), де така терапія не призначалася.
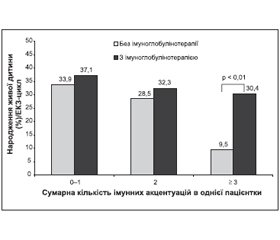
У підгрупі В3 із трьома та понад ІА, у якій проводили ВІГ-терапію, показник імплантації був вірогідно вищий, ніж у підгрупі А3, у якій ВІГ не використовували (43,4 та 21,4 % відповідно; p < 0,01) (рис. 1).
Показники репродуктивного успіху (народження живої дитини) у підгрупах В1 та В2 (37,1 та 32,3 % відповідно), у яких використовували ВІГ, були дещо вищі, ніж у підгрупах А1 та А2 (33,9 та 28,5 % відповідно), але різниця не була вірогідною. У підгрупі В3, у якій використовували ВІГ, показник репродуктивного успіху був значно вищий, ніж у підгрупі А3, у якій ВІГ не застосовували (30,4 та 9,5 % відповідно; p < 0,01) (рис. 2). У підгрупі В3 під впливом ВІГ показники імплантації та репродуктивного успіху (народження живої дитини) стали такими ж, як у пацієнток без множинних ІА. Тобто ВІГ-терапія в програмі ЕКЗ є ефективною лише в жінок із множинними імунними відхиленнями, або множинними імунними акцентуаціями.
П’ять підгруп (А1, А2, В1, В2, В3) жінок, які ми проаналізували, мали практично схожі результати щодо показників імплантації та народження живої дитини. І тільки в підгрупі А3, для якої притаманні множинні імунні відхилення (акцентуації) і в якій ВІГ не застосовувався, показники імплантації ембріона та народження живої дитини були значно нижчими. Тобто реальний ефект від призначення ВІГ підтвердився лише в жінок, які мали множинні імунні відхилення (акцентуації). Ми розуміємо, що окремі імунні відхилення можуть мати неоднакове значення для невдачі ЕКЗ, але на сучасному етапі значення саме множинних імунних відхилень (акцентуацій) було підтверджене в нашій роботі.
Результати нашої роботи пояснюють відсутність значимого успіху від ВІГ-терапії при ЕКЗ-невдачах, коли ця терапія призначалась на базі загальних клінічних та анамнестичних даних. Тільки в жінок із множинними імунними відхиленнями (акцентуаціями) використання ВІГ призводить до значного (вірогідного) покращання показників імплантації та репродуктивного успіху (народження живої доношеної дитини).
Список литературы
1. Kwak J.Y., Beaman K.D., Gilman-Sachs A., Ruitz J.E., Schevitz D., Beer A.E. Up-regulated expression of CD56+, CD56+/CD16+, and CD19+ cells in peripheral blood lymphocytes in pregnant women with recurrent pregnancy losses // Am. J. Reprod. Immunol. — 1995. — 34. — 93-99.
2. Emmer P.M., Nelen W.I., Steegers E.A., Hendriks J.C., Veerhoek M., Joosten I. Peripheral natural killer cytotoxicity and CD56(pos) CD16(pos) cells increase during early pregnancy in women with a history of recurrent spontaneous abortion // Hum. Reprod. — 2000. — 15. — 1163-69.
3. Matsubayashi H., Hosaka T., Sugiyama Y., Suzuki T., Arai T., Kondo A. et al. Increased natural killer-cell activity is associated with infertile women // Am. J. Reprod. Immunol. — 2001. — 46. — 318-322.
4. Ntrivalas E.I., Kwak-Kim J.Y.H., Gilman-Sachs A., Chung-Bang H., Ng S.C., Beaman K.D. et al. Status of peripheral blood natural killer cells in women with recurrent spontaneous abortions and infertility of unknown etio-logy // Hum. Reprod. — 2001. — 16. — 855-61.
5. Karami N., Boroujerdnia M.G., Nikbakht R., Khodadadi A. Enhancement of peripheral blood CD56(dim) cell and NK cell cytotoxicity in women with recurrent spontaneous abortion or in vitro fertilization failure // J. Reprod. Immunol. — 2012. — 95. — 87-92.
6. Kwak-Kim J.Y.H., Chung-Bang H.S., Ng S.C., Ntrivals E.I., Mangubat C.P., Beaman K.D. et al. Increased T helper 1 cytokines responses by circulated T cells are present in women with recurrent pregnancy losses and in infertile women with implantation failures after IVF // Hum. Reprod. — 2003. — 18. — 767-73.
7. Coulam C.B., Roussev R.G. Correlation of NK cell activation and inhibition markers with NK cytotoxicity among women experiencing immunologic implantation failure after in vitro fertilization and embrio transfer // J. Assist. Reprod. Genet. — 2003. — 20. — 58-62.
8. Ntrivals E.I., Bowser C.R., Kwak-Kim J., Beaman K.D., Gilman-Sachs A. Expression of killer immunoglobulin-like receptors on peripheral blood NK cell subsets of women with recurrent spontaneous abortions or implantation failures // Am. J. Reprod. Immunol. — 2005. — 53. — 215-221.
9. Chernyshov V.P., Sudoma I.O., Dons’koi B.V., Kostyuchik A.A., Masliy Y.V. Elevated NK cell cytotoxi-city, CD158a expression in NK cells and activated T lymphocytes in peripheral blood of women with IVF failures // Am. J. Reprod. Immunol. — 2010. — 64. — 58-67.
10. Heilmann L., Schorsch M., Hahn T. CD3-CD56+CD16+ natural killer cells and improvement of pregnancy outcome in IVF/ICSI failure after additional IVIG-treatment // Am. J. Reprod. Immunol. — 2010. — 63 (3). — 263-5.
11. Beer A.E., Kwak J.Y., Ruiz J.E. Immunophenotypic profiles of peripheral blood lymphocytes in women with recurrent pregnancy losses and in infertile women with multiple failed in vitro fertilization cycles // Am. J. Reprod. Immunol. — 1996. — 35. — 376-82.
12. Chernyshov V.P., Dons’koi B.V., Sudoma I.O., Goncharova Y.O. Favorable immune phenotype predicts successful implantation and pregnancy // Immunology Letters. — 2014. — 162. — 217-221.
13. Coulam C.B., Krysa L.W., Bustillo M. Intravenous immunoglobulin for in-vitro fertilization failure // Hum. Reprod. — 1994. — 9 (12). — 2265-69.
14. Stephenson M.D., Fluker M.R. Treatment of repea-ted unexplained failure with intravenous immunoglobulin: a randomized, placebo-controlled Canadian trial // Fertil. Steril. — 2000. — 74 (6). — 1108-13.
15. Li J., Chen Y., Liu C., Hu Y., Li L. Intravenous immunoglobulin treatment for repeated IVF/ICSI failure and unexplained infertility: a systematic review and meta-analysis // Am. J. Reprod. Immunol. — 2013. — 70 (6). — 434-47.
16. Van den Heuvel M.J., Peratta C.G., Hatta K., Han V.K., Clark D.A. Decline in number of elevated blood CD3+CD56+NKT cells in response to intravenous immunoglobulin treatment outcome // Am. J. Reprod. Immunol. — 2007. — 58 (5). — 447-59.
17. Winger E.E., Reed J.L., Ashoush S., El-Toukhy, Ahuja S., Taranissi M. Elevated preconception CD56+16+ and/or Th1:Th2 levels predict benefit from IVIG therapy in subfertile women undergoing IVF // Am. J. Reprod. Immunol. — 2011. — 66 (5). — 394-403.