Введение
Комплекс немоторных симптомов (НМС) широко представлен при болезни Паркинсона (БП), но недостаточно диагностируется в клинической практике из-за отсутствия активных жалоб со стороны пациента, а также ввиду недостаточно целенаправленного опроса врачами-неврологами во время визита. Это приводит к тому, что немоторные проявления БП зачастую остаются нераспознанными, а в случаях отсутствия адекватного лечения создают негативное влияние на качество жизни пациента [1, 3].
Впервые НМС при БП были систематизированы и подробно описаны в 2006 году К.R. Chaudhuri и соавторами [2]. В клинический симптомокомплекс НМС принято включать: нервно-психические расстройства (эмоционально-тревожные, когнитивные, психические, поведенческие), нарушения сна и бодрствования (синдром «беспокойных ног», расстройства поведения во время фазы быстрого сна, чрезмерная дневная сонливость, инсомния), дисфункцию вегетативной системы (дисфункция мочевого пузыря, потливость, ортостатическая гипотензия), сенсорные расстройства (боль, гипосмия, нарушение зрения), усталость и др. [1, 16–19].
Выявление и коррекция НМС при БП признаны важной и недостаточно решенной проблемой по данным Национального института охраны здоровья и клинического мастерства Великобритании (National Institute for Health and Clinical Excellence — NICE) [1, 2, 5]. При этом считают,что улучшение диагностики НМС позволит усовершенствовать стратегию лечения и тем самым улучшить качество жизни пациентов. Для выявления НМС в клинических условиях используются специально разработанные шкалы и анкеты. Так, коллективом экспертов разработаны анкета немоторных симптомов (Non-Motor Symptoms Quest), шкала оценки немоторных симптомов БП (Non-Motor Symptoms Scale — PD) [1–3], унифицированная рейтинговая шкала оценки БП (Unified Parkinson’s Disease Rating Scale — UPDRS) и набор шкал оценки исходов при БП (Scales for Outcomes in Parkinson’s disease — SCOPA).
Целью настоящего исследования явилось выявление и определение частоты встречаемости немоторных симптомов при болезни Паркинсона с помощью NMSS-PD, а также оценка частоты распределения по степени выраженности, выявление корреляционных связей НМС с показателями когнитивного статуса, эмоциональной сферы и тяжестью моторного дефицита на разных этапах патогенетического лечения у пациентов среднего и пожилого возраста.
Материалы и методы
В комплексном клинико-нейрофизиологическом обследовании, проведенном на базе отдела клинической физиологии и патологии экстрапирамидной нервной системы ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины», участвовало 122 пациента с болезнью Паркинсона, которым была проведена оценка немоторных симптомов. Диагноз болезни Паркинсона выставлялся согласно критериям UK Brain Bank Criteria [20]. Пациенты были распределены на две возрастные группы: средний (n = 62) и пожилой (n = 60) возраст. В каждой возрастной группе пациенты были рандомизированы по полу, возрасту дебюта заболевания, длительности заболевания и лечения, стадийности процесса по шкале Hoehn — Yahr, выраженности симптомов заболевания по унифицированной шкале UPDRS [15]. Учитывались этапы патогенетического лечения (долеводопный (n = 26) и леводопный (n = 96)), а также суточная доза леводопасодержащих препаратов у каждого пациента.
Оценка немоторных симптомов проводилась с помощью шкалы немоторных симптомов при болезни Паркинсона — Non-Motor Symptoms Scale-Parkinson’s Disease (NMSS-PD), которая состоит из 30 пунктов и дает возможность оценить сердечно-сосудистую систему, сон/усталость, настроение/апатию, проблемы восприятия/галлюцинации, внимание/память, желудочно-кишечный тракт, расстройства мочевыделения, сексуальную функцию и другие немоторные симптомы. В каждом пункте оценивались частота и степень тяжести проявления симптома. Максимальная оценка составляет 360 баллов [4]. Более высокий балл отражает выраженность степени тяжести НМС в клинической картине заболевания (табл. 1).
Для исследования когнитивной сферы использованы нейропсихологические тесты: краткая шкала психического статуса (Mini-Mental State Examination — MMSE) [7], батарея тестов на лобную дисфункцию (Frontal Assessment Battery — FAB) [9], Монреальская когнитивная шкала (Montreal Cognitive Assessment — MoCA) [8].
Психоэмоциональный статус оценивали по шкале депрессии Бека [12], шкале тревожности Спилбергера — Ханина [10, 11], которая позволяет оценить личностную и ситуационную тревожность.
Оценку вегетативной нервной системы проводили с помощью опросника для выявления признаков вегетативной дисфункции Вейна [13], показателя дневной сонливости — по шкале сонливости Эпворта [14].
Статистическая обработка полученных данных проведена с использованием Microsoft Excel v.12, пакета статистических программ StatSoft Statistica v.10.0. Статистическую оценку отличий между независимыми выборками проводили при помощи критерия Манна — Уитни, для корреляционного анализа использовали коэффициент Спирмена. В качестве значимых рассматривали отличия, для которых p < 0,05.
Результаты и обсуждение
Средние значения длительности заболевания и лечения в обеих группах не имели статистических различий и составляли в среднем возрасте 6,4 ± 4,4; 4,3 ± 4,3 года, в пожилом — 6,1 ± 4,2; 4,3 ± 4,0 года.
Обе группы не отличались по стадиям заболевания, которые оценивались по шкале Hoehn — Yahr, и имели в группе среднего и пожилого возраста схожие значения — 2,7 ± 0,3; 2,8 ± 0,3 соответственно.
Тяжесть заболевания БП оценивалась по унифицированной шкале UPDRS: I раздел (нарушение мышления, настроение), II раздел (дневная активность), III раздел (двигательная активность) вычисляли на основании четырехбалльной градации каждого из симптомов, при этом меньшее количество баллов соответствовало менее выраженным симптомам заболевания. Показатели средних значений по UPDRS составляли в группе среднего и пожилого возраста 48,3 ± 13,5; 49,7 ± 14,5 балла соответственно.
Суммарный балл по шкале NMSS-PD преобладал в группе пожилого возраста (67,0 ± 4,3) по сравнению с показателями группы среднего возраста (54,2 ± 4,3), что свидетельствует о более выраженном влиянии НМС на клиническую картину БП у пациентов пожилого возраста. Учитывая полученные данные, необходимо констатировать, что НМС при БП одинаково распространены как у женщин, так и мужчин, но возраст начала заболевания в обеих группах был различен. Это, в свою очередь, дает основания предполагать наличие связи возраста с началом проявлений БП и влияние НМС на тяжесть и течение заболевания.
Усредненные значения указанных показателей и общая характеристика обследованных пациентов представлены в табл. 2.
/60-1.jpg)
Одной из задач данного исследования было определить возрастные особенности частоты встречаемости НМС и возможность их взаимосвязи со степенью тяжести этих проявлений в клинической картине БП. Установлено, что НМС были широко представлены в обеих возрастных группах. Так, в группе среднего возраста частота НМС легкой степени преобладала над показателями в группе пожилого возраста и составляла 22,5 и 8 % соответственно. Показатели частоты умеренной (27 %), тяжелой (25 %) и очень тяжелой (37 %) степеней выраженности НМС преобладали в группе пожилого возраста, в то время как в группе среднего возраста эти показатели составляли 22,5, 18 и 35 % соответственно, что свидетельствует о более высокой степени тяжести НМС в клинической картине заболевания у пациентов пожилого возраста. Только 2 % (n = 1) в среднем и 3 % (n = 2) пациентов в пожилом возрасте отметили отсутствие влияния НМС (рис. 1).
/60-2.jpg)
При корреляционном анализе были установлены достоверные положительные связи между суммарным баллом NMSS-PD и показателями психоэмоционального статуса пациента, вегетативной дисфункции и дневной сонливости.
Суммарный балл шкалы UPDRS также имеет корреляционную связь с показателями NMSS-PD, в большей степени за счет I и II разделов (коэффициент корреляции (КК) = 0,38).
Отмечена слабая положительная связь балла NMSS-PD с клиническими показателями, характеризующими стадийность, длительность заболевания и возраст пациента на момент обследования.
В результате проведенного исследования не выявлено достоверной зависимости между показателями этой шкалы и возрастом начала заболевания. Величина показателя NMSS-PD имела достоверную отрицательную связь с показателями когнитивного профиля (MMSE, FAB, MoCA) (рис. 2).
Общий балл НМС (шкала NMSS-PD) достоверно коррелировал с результатами других специализированных шкал и с клиническими показателями у больных БП, однако степень этих связей значительно варьировала (рис. 2). Так, общие клинические данные обследованных пациентов с БП незначительно влияли на степень тяжести НМС. Показано, что коэффициент корреляции НМС с возрастом начала заболевания составил 0,22 (p < 0,05), для длительности лечения КК = 0,33 (p < 0,05) и для стадии заболевания по Hoehn — Yahr — 0,23 (p < 0,05). В то же время не было зависимости между возрастом начала заболевания и выраженностью НМС (КК = 0,08; p > 0,05).
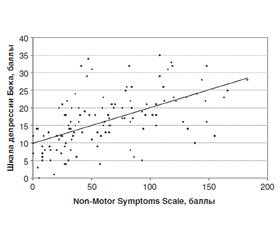
Высокая корреляционная связь была выявлена между шкалами депрессии Бека и NMSS-PD (КК = 0,62; p < 0,05), уровнем тревожности по Спилбергеру — Ханину (КК = 0,51 для личностной тревожности и 0,57 — для ситуативной тревожности), что дает основание предполагать значительное влияние НМС на возможность развития эмоциональных расстройств и депрессии при БП (рис. 3).
/61-2.jpg)
Была выявлена достаточно существенная положительная связь НМС с вегетативными нарушениями, измеряемыми по шкале Вейна (КК = 0,50; p < 0,05) и субшкалами UPDRS I и II (КК = 0,55 и 0,46 соответственно; p < 0,05) (рис. 2). В то же время результаты тестов MMSE, MоCA и FAB, характеризующие состояние когнитивных функций, были очень слабо связаны с суммарным баллом NMSS-PD, хотя и были достоверными, а значения коэффициентов корреляции колебались в диапазоне 0,28–0,3 (p < 0,05). Последнее дает основание полагать, что шкала NMSS-PD достаточно слабо отражает нарушения познавательных процессов при БП, что свидетельствует о необходимости комбинированного применения специализированных методик для оценки когнитивных функций и их сопоставления с более общими подходами оценки влияния НМС на качество жизни больных БП.
Выводы
Немоторные симптомы широко распространены у пациентов с болезнью Паркинсона и возникают независимо от возраста, начала дебюта заболевания, пола, длительности болезни и лечения, стадии и степени тяжести заболевания. Установлено более выраженное влияние НМС на клиническую картину БП у пациентов пожилого возраста по сравнению с пациентами среднего возраста, при этом частота встречаемости более тяжелой степени НМС характерна для пациентов пожилого возраста. Возраст начала заболевания не влияет на появление и степень выраженности НМС при БП.
Отмечена положительная корреляционная связь показателей психоэмоционального статуса, вегетативной дисфункции, наличия чрезмерной дневной сонливости с тяжестью клинических проявлений НМС по данным NMSS-PD.
Non-Motor Symptoms Scale-Parkinson’s Disease (NMSS-PD) является информативным инструментом общей оценки НМС у пациентов с БП, однако эта шкала имеет относительно низкую чувствительность при оценке когнитивного статуса, в связи с чем есть основания полагать, что комбинированное применение специализированных шкал, таких как MMSE, МoСА и FAB, наряду с NMSS-PD будет многофункциональным методом диагностики когнитивных функций у больных БП на разных стадиях течения заболевания.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Nonmotor Symptoms in Parkinson’s Disease in 2012: Relevant clinical aspects / A.M. Bonnet, M.F. Jutras, V. Czernecki, J. Christophe Corvol, Marie Vidailhet. Hindawi Publishing Corporation // Parkinson’s Disease. — Vol. 2012. — Article ID 198316. — 15 p. — doi: 10.1155/2012/198316.
2. Chaudhuri K.R., Healy D., Shapira A.H. The non motor symptoms of Parkinson’s disease NMS Quest. Diagnosis and management // The Lancet Neurology. — 2006. — Vol. 5. — Р. 235-245.
3. Martinez-Martin P., Rodriguez-Blazquez C., Abe K. et al. International study on the psychometric attributes of the Non-Motor Symptoms Scale in Parkinson disease // Neurology. — 2009. — Vol. 73, № 19. — Р. 1584-1591.
4. Chaudhuri K.R., Martinez-Martin P., Brown R.G. et al. The metric properties of a novel non-motor systems scale for Parkinson’s disease: results from an international pilot study // Movement Disorder. — 2007. — Vol. 22, № 13. — Р. 1901-1911.
5. Chaudhuri K.R., Shcapira A.H.V. Non-motor symptoms of Parkinson’s disease: dopaminergic pathphysiology and treatment // Lancet Neurol. — 2009. — № 8. — Р. 464-74.
6. Chaudhuri K.R., Rojo J.M., Schapira A.H. et al. A proposal for a comprehensive groding of Parkinson’s disease severity combining motor and non-motor assessments: Meeting an unmet need // Plos. One. — 2013. — № 8(2). — Р. e57221. — doi: 10.1371) journal.pone. 0057221.
7. Folstein M.F., Folstein S.E., McHugh P.R. «Mini-mental state». A practical method for grading the cognitive state of patients for the clinician // J. Psychiatr Res. — 1975. — № 12. — Р. 189-98.
8. Ziad S., Natalie A. et al. The Montreal Cognitive Assessment, MoCA: A Brief Screening Tool For Mild Cognitive Impairment // Journal of the American Geriatrics Society. — 2005. — № 53(4). — Р. 695-699.
9. Dubois B., Litvan I. The FAB: A frontal assessment battery at bedside // Neurology. — 2000. — № 55(11). — Р. 1621-1626.
10. Spielberger C.D., Gorsuch R.L., Lushene R.E. STAI Manual for the State-Trait. Anxiety Inventory. — Palo Alto, USA: Consuling Psychologist Press, 1970.
11. Ханин Ю.Л. Краткое руководство к применению шкалы реактивной и личностной тревожности Ч.Д. Спилбергера. — Л.: ЛНИИТЕК, 1976.
12. Beck A.T., Ward C.H., Mendelson M., Mock J., Erbaugh J. An inventory for measuring depression // Archives of General Psychiatry. — 1961. — № 4. — P. 561-571.
13. Вегетативные расстройства: клиника, лечение, диагностика: руководство для врачей / Под ред А.М. Вейна. — М.: Медицинское информационное агентство, 2003. — 752 с.
14. Johns M.W. // Sleep. — 1991. — Vol. 14, № 6. — Р. 540-545.
15. Fahn S., Elton R. Members of the updrs Development Committee / Fahn S., Marsden C.D., Calne D.B., Goldstein M. // Recent Developments in Parkinson’s Disease. — 1987. — Vol. 2. — Florham Park, N.J. Macmillan Health Care Information, 1987. — Р. 153-163, 293-304.
16. Mitra T., Naidu Y., Martinez-Martin P. et al. The non de–claration of non motor symptoms of Parkinson’s disease to healthcare professionals. An international survey using the NMSQuest. 6th International Congress on Mental Dysfunctional and other Non-motor Features in Parkinson’s disease and Related Disorders. — Dresden, October 2008. — Park. Related Disorders P0II: 161.
17. Martinez-Martin Р., Shapira A.H.V., Stocchi F. Prevalence of non motor symptoms in Parkinson’s disease in an international setting; study using non-motor symptoms questionnaire in 545 patients // Movement Disorders. — 2007. — Vol. 22. — Р. 1623-1629.
18. Chaudhuri K.R., Odin P., Antonini A., Martinez-Martin Р. // Parkinson’s disease: the non-motor issues. — 2011. — Vol. 17, № 10. — Р. 717-723.
19. Левин О.С. Недвигательные (немоторные) проявления болезни Паркинсона: диагноз и лечение: по материалам II Нац. конгресса по болезни Паркинсона и расстройствам движений / Под ред. проф. С.Н. Иллариошкина, проф. О.С. Левина // Аннотированные доклады. — М., 2008. — С. 94-96.
20. Hughes A.J., Daniel S.E., Kilford L., Lees A.J. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases // J. Neurol. Neurosurg. Psychiatry. — 1992. — № 55. — Р. 181-184. — doi: 10.1136/jnnp.55.3.181.

/59-1.jpg)
/60-1.jpg)
/60-2.jpg)
/61-1.jpg)
/61-2.jpg)