Вступ
Одним з актуальних напрямків сучасної ангіоневрології є вивчення стану когнітивних функцій та можливостей корекції їх порушень при серцево-судинних захворюваннях [15, 16]. Зростання поширеності когнітивних розладів (КР) пов’язане зі збільшенням частки людей літнього та старечого віку в популяції, зростання вимог до когнітивної сфери людини в міру розвитку сучасного суспільства диктує необхідність пошуку нових методів терапії. За прогнозами ООН, у 2025 році чисельність людей понад 60 років перевищить 600 мільйонів, що становитиме більше 15 % від усього населення планети [5, 21].
Ефективність лікування когнітивної дисфункції судинного генезу вища в предементний період на стадії легких та помірних КР [6, 14]. Тому саме хворі з додементними КР є об’єктом перспективного терапевтичного втручання.
Суттєву роль у розвитку когнітивного дефіциту відіграють порушення серцевого ритму. Особлива увага в літературі приділяється ролі фібриляції передсердь (ФП). ФП діагностують в 1 % дорослого населення [19]. Більше 6 мільйонів європейців страждають від цієї аритмії. Поширеність ФП, за попередніми оцінками, зросте у 2 рази упродовж наступних 50 років. За своєю медико-соціальною значимістю ФП суттєво випере–джає інші види кардіальних аритмій, що пов’язано не лише з її поширеністю, але й з тяжкістю обумовлених нею органних ускладнень, асоційованих зі значними моральними та матеріальними витратами. Розвиток хронічної серцевої недостатності (ХСН), збільшення ризику раптової серцевої смерті, емболічні церебральні ускладнення, погіршення перебігу постінсультного періоду, стійка інвалідизація, низька виживаність — усе це є наслідком втрати синусового ритму [11]. ФП збільшує в п’ять раз ризик інсульту, і один із кожних п’яти інсультів пов’язаний із цією аритмією. Ішемічні інсульти при ФП часто закінчуються смертю, а пацієнти, які вижили, мають вищий відсоток інвалідизації та частіше страждають від рецидивів, ніж пацієнти з інсультом від інших причин. Разом із тим сама специфіка хвороби (клінічні прояви, наслідки, характер лікування) визначає її істотний вплив на актуальну життєву ситуацію, інтелект та систему особистісних стосунків хворого [1]. ФП вважається чинником, як пов’язаним із КР, що розвиваються в результаті перенесеного інсульту, так і не пов’язаним із гострими порушеннями мозкового кровообігу [20, 22].
У хворих із короткочасними безсимптомними рецидивами пароксизмальної ФП можна уникнути застосування антиаритмічних препаратів (ААП), проте тривалі напади зазвичай є показанням до їх використання. Стійкий пароксизм ФП, що розвинувся в стаціонарі на тлі синусового ритму, потребує невідкладного усунення з урахуванням негативного впливу на центральну та церебральну гемодинаміку. Особливістю є те, що при гострих порушеннях мозкового кровообігу терапія, спрямована на підтримання синусового ритму, не повинна істотно впливати на функцію синусового вузла, частоту серцевих скорочень і артеріальний тиск [12].
Для усунення пароксизму ФП найбільш оптимальним засобом є внутрішньовенне краплинне введення 300–450 мг аміодарону, що за основними електрофізіо–логічними властивостями належить до ААП ІІІ класу. Загальною властивістю препаратів цієї групи є здатність інактивувати калієві канали в мембрані кардіоміоцитів і таким чином подовжувати трансмембранний потенціал дії. Діапазон електрофізіологічних ефектів аміодарону набагато ширший, ніж у «чистих» або селективних ААП ІІІ класу. При внутрішньовенному введенні аміодарон відновлює синусовий ритм приблизно в 60–70 % хворих із ФП. За потреби довгострокової профілактичної терапії допустимо призначати ААП підкласу IC (пропафенон) і III класу (аміодарон, соталол) з урахуванням стану центральної гемодинаміки (рівень артеріального тиску та частоти серцевих скорочень).
У хворих із відсутністю органічних захворювань серця або їх мінімальними проявами для початкової антиаритмічної терапії можна рекомендувати пропафенон, аміодарон і соталол у зв’язку з тим, що ці препарати добре переносяться і характеризуються мінімальними позасерцевими побічними ефектами. При неефективності будь-якого з цих препаратів або розвитку побічних явищ можна призначити препарати другої лінії (дизопірамід, прокаїнамід і хінідин), у яких ймовірність побічних ефектів вища.
У хворих із ХСН для підтримання синусового ритму найбільш безпечні препарати II і III класів. Хворим з ІХС в умовах симпатичної активації показані бета-адреноблокатори (БАБ) (бісопролол, метопролол) і соталол, що поєднує бета-адреноблокуючі властивості та первинну антиаритмічну дію.
Постійна форма ФП наявна приблизно у 25 % пацієнтів з ішемічним інсультом. Найбільш часто в гострому періоді вона супроводжується тахікардичною реакцією, несприятливо впливає на гемодинамічні параметри насосної функції серця. Тому невідкладним завданням є нормалізація частоти шлуночкових скорочень. Оптимальними препаратами для цього є серцеві глікозиди, верапаміл та неселективні короткодіючі бета-адреноблокатори (пропранолол). Перевага цих засобів полягає в їх незначному впливі на системний артеріальний тиск, що дозволяє уникнути небажаних ятрогенних гіпотонічних реакцій. Дигіталізація здійснюється швидко за допомогою внутрішньовенної інфузії дигоксину з паралельним пероральним насиченням. Також використовуються короткодіючі форми верапамілу з динамічною оцінкою частоти шлуночкових скорочень; можливе застосування ретардованих форм верапамілу. Після стабілізації показників центральної гемодинаміки можна зробити одну спробу відновлення синусового ритму [12].
При безуспішності зусиль продовжувати активні заходи не варто, оскільки не можна виключити того, що в пацієнта ще до інсульту була постійна ФП, яка не зареєстрована документально і навіть не проявлялася суб’єктивно. Виражене ремоделювання серця, особливо розширення порожнини передсердь, є запорукою невдач при спробах здійснення кардіоверсії. Тільки в разі медикаментозного або спонтанного відновлення синусового ритму на фоні терапії, що уповільнює пульс, слід призначати антиаритмічне лікування, спрямоване на утримання синусового ритму [12].
У зв’язку з цим великий інтерес викликає вплив ААП на когнітивну сферу. При цьому не завжди спостерігаються сприятливі терапевтичні кореляції. Так, неадекватна антиаритмічна терапія нерідко є причиною розвитку гіпоперфузії головного мозку та сприяє прогресуванню когнітивної дисфункції. Особливо виражені вказані розлади у хворих із порушеною авторегуляцією мозкового кровотоку, стенозуючими атеросклеротичними ураженнями екстра- й інтракраніальних судин [13].
Блокатори бета-адренорецепторів використовуються практично в усіх галузях сучасної кардіології: при лікуванні ІХС, артеріальної гіпертензії, надшлуночкових і шлуночкових тахіаритмій, ХСН та функціональних порушень серцево-судинної системи [4, 7]. Упродовж багатьох років БАБ займають одне з провідних місць у терапії порушень серцевого ритму, будучи однією з основних груп ААП [18], що знижують ризик розвитку церебрального інсульту на 30–50 % [10]. Результати досліджень, спрямованих на оцінку впливу БАБ на когнітивні функції пацієнтів, суперечливі. Так, деякі дослідники стверджують, що терапія БАБ негативно впливає на вищі інтеграційні функції мозку (інтелект, пам’ять, емоції), що знижує якість життя хворих та ефективність їх професійної діяльності [9]. Проте, за даними інших авторів, терапія бісопрололом у хворих на артеріальну гіпертензію віком 40–59 років у досить короткі терміни (4 місяці) призводить практично до повного відновлення уваги, слухової пам’яті та мислення [8]. У літературі є поодинокі повідомлення про церебропротективну активність метопрололу в пацієнтів з АГ молодого та середнього віку. На фоні терапії метопрололом відзначалося вірогідне поліпшення показників когнітивних функцій, що супроводжувалися поліпшенням мозкового кровотоку за даними перфузійної сцинтиграфії мозку [2, 18].
У науковій літературі практично не зустрічаються роботи, присвячені дослідженню динаміки когнітивних розладів у пацієнтів із ФП у результаті проведення фармакологічної кардіоверсії. Залишається до кінця не уточненим питання, яким чином прийом БАБ впливає на когнітивні процеси в пацієнтів із ФП. Це було підставою для проведення даного дослідження.
Мета дослідження — вивчення впливу тривалої (2 роки) терапії БАБ (бісопролол та метопролол) та антиаритмічного засобу ІІІ класу (аміодарон) на когнітивні функції пацієнтів із фібриляцією передсердь.
Матеріали та методи
Дослідження виконувалось за уніфікованою методикою з використанням стандартних інструментів у кардіологічній та неврологічній клініках Військово-медичного клінічного центру Західного регіону (м. Львів). У дослідження були включені 117 пацієнтів із персистуючою/пароксизмальною (n = 70) та постійною (n = 47) формами фібриляції передсердь. Порівняльні терапевтичні групи складались з когорти пацієнтів віком 40–75 років, які відповідали критеріям включення і виключення.
Критерії включення пацієнтів у дослідження:аналіз за короткою шкалою оцінки психічного статусу (MMSE) понад 25 балів; скарги на зниження пам’яті, що підтверджуються інформантом (зазвичай членом сім’ї), об’єктивно виявляються ознаки когнітивних дисфункцій (принаймні в тестах на дослідження пам’яті); збереження повсякденної активності пацієнтів; отримання письмової інформованої згоди від пацієнта на участь у дослідженні.
Критерії виключення: неврологічні захворювання (вроджені та/або набуті метаболічні енцефалопатії, токсичні та лікарські енцефалопатії, хвороба Паркінсона, мультиінфарктна деменція, інсульт, епілепсія, інфекційні захворювання, демієлінізуючі та спадково-дегенеративні захворювання центральної нервової системи); неопластичні та/або травматичні пошкодження головного мозку; системні захворювання, психічні хвороби; тяжка органна патологія; злоякісні екстрацеребральні пухлини; ВІЛ-інфекція; цукровий діабет у стадії декомпенсації або інші ендокринні захворювання; алкоголізм і/або лікарська залежність; медикаментозна або інша інтоксикація; рівень систолічного тиску > 180 мм рт.ст., діастолічного — > 95 мм рт.ст.
Відповідно до мети дослідження хворі були розподілені на 2 терапевтичні групи: 1-шу становив 61 пацієнт, які отримували протягом 2 років терапію БАБ (метопролол 25–50 мг або бісопролол 5–10 мг); 2-гу — 56 пацієнтів, які отримували протягом 2 років лікування аміодароном у добовій дозі 200–600 мг.
За результатами проведеного ДНК-дослідження генотип АроЕ4(+) установлений у 20 (32,8 %) пацієнтів 1-ї групи і у 18 (32,1 %) — 2-ї, АроЕ4(–) — в 41 (67,2 %) пацієнтів 1-ї групи і 38 (67,9 %) — 2-ї.
Порівнювані групи до початку дослідження статистично вірогідно не відрізнялися за середнім віком пацієнтів, статевим складом, а також за розподілом пацієнтів, які мають генотипи АроЕ4(+) і АроЕ4(–). Групи виявилися практично ідентичними з вихідної тяжкості КР. Хоча пацієнти 1-ї групи мали кращі оцінки за шкалою MMSE (із різницею в 0,2 бала), але за іншими тестами і шкалами вони не тільки не мали відмінностей порівняно з 2-ю групою, але й виявилися практично ідентичними за більшістю оцінюваних параметрів.
Для оцінки вірогідності відмінностей між середніми сумарними оцінками в 1-й і 2-й групах використовували методи непараметричної статистики — обчислення критеріїв Вілкоксона (для вибірок із будь-яким розподілом ознак).
Результати та обговорення
Повністю завершили 2-річний курс терапії 54 пацієнти 1-ї групи та 48 — 2-ї; відповідно 7 і 8 пацієнтів достроково вибули з дослідження з причин немедичного характеру.
Окрім аналізу динаміки тестових оцінок, у пацієнтів обох груп були проаналізовані показники переходу пацієнтів з однієї клінічної стадії когнітивної недостатності в іншу за весь період проведення дослідження (оцінка здійснювалася за шкалою MMSE). У нижчу діагностичну категорію за КР в 1-й групі до закінчення дослідження (тобто через 2 роки від його початку) перейшли лише 3 (4,9 %) пацієнти, у 2-й групі — 9 (16,1 %). Таким чином, частота погіршення когнітивних функцій протягом 2 років із початку дослідження в групі пацієнтів, пролікованих БАБ, була в 3,3 раза нижчою за відповідний показник у групі хворих, які отримували терапію аміодароном.
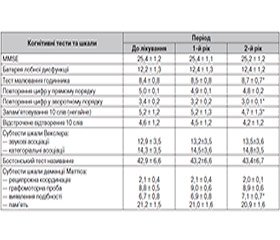
Аналіз динаміки середньогрупових сумарних тестових оцінок у хворих 1-ї групи (отримували БАБ) показав вірогідне поліпшення показників когнітивного функціонування до закінчення дослідження за такими тестами: звукові та категоріальні асоціації за шкалою Векслера, 2 субтести шкали деменції Маттіса — «подібність» і «пам’ять», показники Бостонського тесту називання. До закінчення дослідження також вірогідно покращилися показники тестів батареї лобної дисфункції і малювання годинника. Лише в тесті відстроченого відтворення 10 слів у пацієнтів 1-ї групи встановлено вірогідне погіршення вихідного показника. Вихідні показники решти когнітивних тестів не змінилися або невірогідно поліпшувалися до закінчення дослідження (табл. 1).
/90-1.jpg)
У 2-й групі пацієнтів до закінчення 2-го року дослідження вірогідна позитивна динаміка встановлена для тестів малювання годинника та субтесту подібності за шкалою деменції Маттіса. Вірогідне погіршення показників до закінчення дослідження було встановлено за 2 когнітивними тестами: запам’ятовування 10 слів і повторення цифр у зворотному порядку. Невірогідне погіршення оцінок до закінчення дослідження мало місце за 3 тестами: повторення цифр у прямому порядку, відстрочене відтворення 10 слів, субтест «пам’ять» за шкалою деменції Маттіса. У той же час поліпшення оцінок (невірогідне) до закінчення дослідження відзначено за 5 іншими когнітивними тестами (табл. 2).
/90-2.jpg)
При порівнянні величини терапевтичного ефекту, тобто різниці між вихідними та посттерапевтичними показниками когнітивного функціонування між групами, яким призначалися БАБ і аміодарон, установлено, що відповідні показники ефективності терапії в 1-й групі виявилися вірогідно кращими порівняно з 2-ю групою за 4 із 14 когнітивних тестів і шкал (повторення цифр у зворотному порядку, запам’ятовування 10 слів, Бостонський тест називання, субтест «пам’ять» за шкалою деменції Маттіса).
Слід зазначити, що в пацієнтів, які отримували БАБ, динаміка когнітивних показників свідчила про позитивний ефект терапії, про що говорить поліпшення цих показників порівняно з початковими оцінками, а ще за 3 тестами — про відсутність негативної динаміки. У пацієнтів 2-ї групи (пролікованих аміодароном) за той же період установлено прогресуюче погіршення когнітивного функціонування за 7 із 14 оцінюваних параметрів. Поліпшення фінальних оцінок за 7 іншими тестами виявилося меншим порівняно з терапевтичним ефектом у пацієнтів 1-ї групи.
У пацієнтів із генотипом АроЕ4(+), яким призначався БАБ, показник переходу когнітивного дефіциту в нижчу діагностичну категорію виявився в 2,2 раза меншим порівняно з таким же показником у хворих з аналогічним генотипом, які отримували аміодарон. З пацієнтів, що мали генотип АроЕ4(–), тільки особи, які лікувалися аміодароном, перейшли в нижчу діагностичну категорію (табл. 3).
За результатами тестової оцінки когнітивних функцій, серед пацієнтів із генотипом АроЕ4(+) виявлені вірогідні розбіжності між групами в терапевтичному ефекті на користь БАБ за 2 тестами — запам’ятовування 10 слів і Бостонський тест називання, а загалом позитивний ефект у вигляді поліпшення показників порівняно з початковими, що не досягав рівня вірогідних міжгрупових відмінностей, виявлений ще за 9 когнітивними тестами.
Пацієнти з генотипом АроЕ4(+), які лікувалися аміо–дароном, вірогідних позитивних відмінностей в ефекті терапії (за тестовими оцінками) порівняно з БАБ не мали, хоча за 4 когнітивними тестами в них до закінчення лікування відзначалася позитивна динаміка.
Таким чином, у пацієнтів із КР, які мають генотип АроЕ4(+), не відмічається істотно більш виражена терапевтична відповідь на терапію БАБ порівняно з аміо–дароном, причому останній у цієї категорії пацієнтів не дає позитивного ефекту за більшістю когнітивних показників.
У пацієнтів 1-ї групи з генотипом АроЕ4(–) виявлені вірогідні розбіжності в ефекті терапії на користь БАБ порівняно з 2-ю групою тільки за динамікою середнього показника за тестом повторення цифр у прямому порядку і, навпаки, вірогідну різницю на користь аміодарону за тестом відстроченого відтворення 10 слів. Загалом у пацієнтів із генотипом АроЕ4(–) позитивний ефект на лікування БАБ відзначався за 11, а на аміодарон — лише за 7 когнітивними тестами.
Таким чином, міжгрупові відмінності в тестових оцінках когнітивного функціонування у хворих із генотипом АроЕ4(–) виявилися менш вираженими, ніж у пацієнтів із генотипом АроЕ4(+). Взагалі позитивна динаміка показників когнітивного функціонування в пацієнтів із генотипом АроЕ4(–) відзначалася частіше порівняно з хворими з генотипом АроЕ4(+) на лікування як БАБ, так і аміодароном. Однак для отримання більш вірогідних даних про залежність терапевтичного ефекту від генотипу АроЕ4 потрібне збільшення числа спостережень над пацієнтами, пролікованими БАБ і аміодароном. Високий показник переходу КР у нижчу діагностичну категорію за когнітивним дефіцитом у пацієнтів із генотипом АроЕ4(+), пролікованих аміодароном, і у 2,2 раза менший показник негативної трансформації цих розладів у пацієнтів з аналогічним генотипом, які лікувалися БАБ, свідчать про можливості БАБ уповільнювати (або, можливо, зупиняти) прогресування когнітивного дефіциту та розвиток деменції.
Висновки
Результати порівняльного дослідження ефективності дворічної терапії БАБ і аміодароном у групах пацієнтів із когнітивними розладами на фоні фібриляції передсердь, які початково не відрізнялися за чисельністю, статтю, віком та розподілом хворих залежно від AроE4(+)- або AроE4(–)-генотипу, свідчать про безсумнівні переваги терапії БАБ порівняно з аміодароном в уповільненні прогресування когнітивного дефіциту та відстроченні або запобіганні його переходу в діагностичну категорію деменції.
Особливістю дії БАБ є їх більш висока ефективність порівняно з аміодароном у пацієнтів із когнітивними розладами, які мають генетичний фактор ризику розвитку деменції — генотип AроE4(+).
Отримані результати дослідження, що свідчать про здатність БАБ уповільнювати або, можливо, зупиняти прогресування когнітивного дефіциту та перехід когнітивних розладів у деменцію, дозволяють рекомендувати тривалу терапію БАБ як засіб превентивної терапії щодо когнітивних розладів у пацієнтів із фібриляцією передсердь.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Алехин А.Н. Психологические проблемы в аритмологии (на модели фибрилляции предсердий) / А.Н. Алехин, Е.А. Трифонова, Д.С. Лебедев // Вестник аритмологии. — 2011. — № 63. — С. 45-54.
2. Афанасьева Н.Л. Гипотензивная эффективность и церебропротективное влияние бета-блокатора метопролола / Н.Л. Афанасьева, В.Ф. Мордовин, Н.Ю. Ефимова // Рос. кардиол. журн. — 2005. — № 1. — С. 60-64.
3. Бета-адреноблокаторы: рациональный выбор для эффективного лечения / Фарм-индекс; приложение для практикующего врача. — СПб.: Фарос, 2000. — 24 c.
4. Глезер М.Г. Справочник по фармакотерапии сердечно-сосудистых заболеваний / М.Г. Глезер, Г.А. Глезер. — М.: Авиценна, 1996. — 564 с.
5. Захаров В.В. Медикаментозная терапия деменций / В.В. Захаров // Клин. фармакол. и терапия. — 1994. — Т. 3, № 4. — С.69-75.
6. Захаров В.В. Нарушение памяти / В.В. Захаров, Н.Н. Яхно. — М.: ГЭОТАР-Медиа, 2003. — 150 с.
7. Карпов Ю.А. Бета-блокаторы в лечении и профилактике ишемической болезни сердца / Ю.А. Карпов // Сердце. — 2005. — № 1(19). — 32 с.
8. Мычка В.Б. Влияние терапии бисопрололом на перфузию головного мозга у больных с метаболическим синдромом / В.Б. Мычка, В.Б. Сергиенко, В.В. Горностаев // Артериальная гипертензия. — 2003. — № 9(5). — С. 160-164.
9. Петров В.И. Новые подходы к коррекции поведенческих и мнестических расстройств при фармакотерапии артериальной гипертензии пропранололом / В.И. Петров, М.Ю. Соломин // Южно-Российский медицинский журнал. — 1998. — № 2. — С. 43-46.
10. Преображенский Д.В. Клиническая фармакология основних классов антигипертензивных препаратов / Д.В. Преображенский, Б.А. Сидоренко, Н.Е. Романова, И.М. Шатунова // Consilium medicum. — 2000. — № 2(3). — С. 99-127.
11. Cуслина З. А. Практическая кардионеврология / З.А. Cуслина, А.В. Фонякин, Л.А. Гераскина, В.Вл. Машин, Е.С. Трунова, В.В. Машин, М.В. Глебов. — М.: ИМА-пресс, 2010. — С. 205-207.
12. Суслина З.А. Кардионеврология: Справочное руководство с обзором клинических исследований / Под ред. З.А. Суслиной, А.В. Фонякина. — М.: ИМА-пресс, 2011. — 264 с.
13. Шляхто Е.В. Артериальная гипертония и деменция // www. expo.rusmedserv.com/report93.html
14. Яхно Н.Н. Легкие когнитивные нарушения в пожилом возрасте / Н.Н. Яхно, В.В. Захаров // Неврол. журн. — 2004. — № 1. — С. 4-8.
15. Яхно Н.Н. Сосудистые когнитивные расстройства / Н.Н. Яхно, В.В. Захаров // РМЖ. — 2005. — № 13(12). — С. 789-793.
16. Di Carlo A. Cognitive impairment without dementia in older people: prevalence, vascular risk factors, impact on disability. The Italian Longitudinal Study on Aging / А. Di Carlo // J. Am. Geriatr. Soc. — 2000. — Vol. 48. — P. 775-782.
17. Expert consensus documenton β-adrenergic receptor blockers. The task force on beta-blockers of the European society of cardiology / Eur. Heart. J. — 2004. — Vol. 25. — Р. 1341-62.
18. Grau-Olivares M. Mild cognitive impairment after lacunar infarcrion: voxel-based morphometry and neuropsychological assessment / М. Grau-Olivares, D. Bartres-Faz, А. Arboix // Cerebrovasc. Dis. — 2007. — Vol. 23(5–6). — Р. 331-353.
19. Kannel W.B. Prevalence, incidence, prognosis and predisposing conditions for atrial fibrillation: population-based estimates / W.B. Kannel, Р.А. Wolf, Е.J. Benjamin // Am. J. Cardiol. — 1998. — Vol. 82(8A). — P. 2-9.
20. Ott A. Atrial fibrillation and dementiain a population-based study. The Rotterdam Study / А. Ott, М.М. Breteler, М.С. deBruyne, F. van Harskamp, D.E. Grobbee, А. Hofman // Stroke. — 1997. — Vol. 28(2). — Р. 316-321.
21. Petersen R.S. Aging, memory and mild cognitive impairment / R.S. Petersen // Int. Psychogeritry. — 1997. — Vol. 9. — P. 37-43.
22. Sabatini T. Regarding atrial fibrillation and cognitive function in older people / Т. Sabatini, G.B. Frisoni, P. Barbisoni, G. Bellelli, R. Rozzini, M. Trabucchi // J. Am. Geriatr. Soc. — 2000. — Vol. 48. — P. 387-390.

/90-1.jpg)
/90-2.jpg)
/91-1.jpg)