Вступ
Серед усіх сарком довгих трубчастих кісток частка остеогенної саркоми (ОС) становить до 55 %. ОС уражає людей у середньому віком 16 років, удвічі частіше чоловіків. Упродовж перших 2 років від початку лікування у результаті швидкого прогресування з гематогенним метастазуванням в легені помирає близько 50 % хворих. До впровадження хіміотерапії п’ятирічна виживаність хворих на ОС після хірургічного лікування становила лише 20 %. При цьому більше ніж половині хворих виконували ампутації на початку лікування або при розвитку рецидиву, що значно погіршувало якість їх життя [1, 3, 5, 9].
У традиційних схемах комбінованої терапії ОС використовують по 3–4 курси доксорубіцину (70–
90 мг/м2), цисплатину (120 мг/м2), метотрексату у високій дозі (12 г/м2), що обумовлює можливість досягнення ремісії захворювання майже у 75 % хворих протягом 5 років і у більшості — проведення органозберігаючої операції [5, 7]. Після гістологічного дослідження видаленої пухлини виділяють хворих з незадовільними прогностичними факторами, яким проводять другу лінію хіміотерапії з іфосфамідом у високій дозі (8–
12 г/м2). На жаль, подальше підвищення доз хіміопрепаратів призвело до збільшення кількості ускладнень, погіршення якості життя хворих без подовження його тривалості [7].
K. Tomita, H. Tsuchiya та інші виявили ефект посилення кофеїном протипухлинної дії цисплатину на лініях клітин остеосаркоми [2]. Також у літературі повідомляють про підвищення ступеня лікувального патоморфозу, віддалених результатів лікування в невеликих групах хворих на ОС [3, 11], підсилення кофеїном цитотоксичної дії хіміопрепаратів при концентрації 50–80 мкг/мл у плазмі крові хворих на неметастатичну остеосаркому [4] і, як наслідок, збільшення ефективності лікування метастатичної остеосаркоми [12].
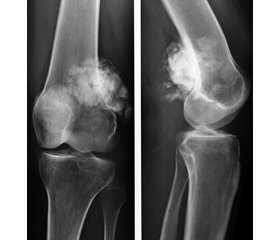
Для прогнозування ефективності передопераційної хіміотерапії при остеосаркомі використовують променеву діагностику (рентгенограми, комп’ютерну томографію (КТ), магнітно-резонансну томографію, ультразвукове дослідження (УЗД), остеосцинтиграфію) і гістологічну оцінку лікувального патоморфозу. При зменшенні об’єму остеосаркоми менше 30 % можна очікувати виражений некроз клітин пухлини і поліпшення прогнозу захворювання [5, 8, 9]. Складність динамічної оцінки великої кількості клінічних і рентгенологічних ознак, їх різноманітність, дотримання стандартних умов дослідження утруднює оцінку ефективності лікування, підвищує похибку дослідження та потребує подальшого вивчення.
Мета: удосконалення оцінки ефективності та ускладнень неоад’ювантної поліхіміотерапії (НПХТ) у схемі цисплатин + доксорубіцин з додаванням кофеїну та без нього у хворих на остеогенну саркому довгих трубчастих кісток.
Матеріали та методи
У роботі проведено аналіз лікування 62 хворих на ОС II стадії (G3-4T1-2N0M0) віком 14–25 років (осіб жіночої статі — 25, чоловічої — 37), які перебували на стаціонарному лікуванні у Національному інституті раку МОЗ України (2001–2009 рр.) та на базі ДУ «Інститут травматології та ортопедії НАМН України» (2010–2011 рр.), за темою науково-дослідної роботи. У всіх вибраних хворих за номенклатурою морфології новоутворень Міжнародної класифікації хвороб 10-го перегляду діагностовано ОС 9180/3 (класична остеосаркома високого ступеня злоякісності, без метастазів, з ІІ стадією захворювання).
Хворим проводили комбіноване лікування — поліхіміотерапію (ПХТ) і хірургічне втручання залежно від поширеності пухлини — резекцію кістки із заміщенням її дефекту ендопротезом суглоба або ампутацію.
Основна група налічувала 32 хворих, які отримали неоад’ювантну ПХТ за схемою РАС з кофеїном: цисплатин — 60 мг/м2 2 дні, доксорубіцин — 35 мг/м2 2 дні; кофеїн — 1 г/добу. Контрольна група налічувала 30 хворих, які отримали НПХТ за схемою РА: цисплатин — 60 мг/м2 2 дні, доксорубіцин — 35 мг/м2 2 дні. Хірургічне втручання всім хворим проводили після 3 курсів НПХТ. Ад’ювантну ПХТ усі хворі отримували за стандартом за схемою РАМ у режимі монохіміотерапії: цисплатин — 75мг/м2 2 дні, доксорубіцин —
45 мг/м2 2 дні, метотрексат — 12 г/м2 + кальцію
фолінат у дозі 15 мг/м2. Визначали концентрацію метотрексату в сироватці крові на аналізаторі TDx (Німеччина). Інтервали між курсами лікування становили 2–3 тижні.
Обсяг залишкової життєздатної пухлинної паренхіми (ОЗЖПП), що свідчить про ефективність НПХТ, вивчали в післяопераційному матеріалі при збільшенні мікроскопа × 280 на 7–10 зрізах препарату в 100 полях зору за допомогою окулярної тест-сітки Автандилова [8]. Розраховували відсоток життєздатних клітин серед усіх пухлинних клітин. Отриманий результат оцінювали за чотирма ступенями лікувального патоморфозу, запропонованими A. Huvos [9]. Показники якості життя вивчали за анкетою EORTC-QLQ-C30 [10]. Ефективність протипухлинної терапії та відповідь пухлин оцінювали за шкалою RECIST (Response Evaluation Criteria In Solid Tumors) [6].
Результати
Для аналізу об’єктивного ефекту проведеної НПХТ використовували дані динамічного клінічного та рентгенологічного досліджень. Загальну ефективність хіміотерапії у хворих після НПХТ визначали за сумою випадків повного та часткового регресування ознак захворювання. При ефективній терапії у пацієнтів повністю чи частково зникав біль, відновлювалась функція ураженої кінцівки, зменшувались розміри пухлини.
Через 2–4 дні після хіміотерапії у хворих на ОС нормалізувалась температура тіла, у 92,0 ± 2,8 % знизилась інтенсивність болю в ділянці пухлини, у 35,0 ± ± 5,0 % починала зменшуватись пухлина та відновлюватись функція ураженого суглоба. При контрольних обстеженнях у всіх випадках при рентгенографічному обстеженні було встановлено зменшення розмірів м’якотканинного компонента пухлини. Подібні зміни відмічались і при допплер-УЗД. Результати КТ-обстеження після проведення НПХТ свідчать про зменшення об’єму пухлини у 67,3 ± 4,9 % пролікованих та стабілізацію росту пухлин у 17,4 ± 3,9 %.
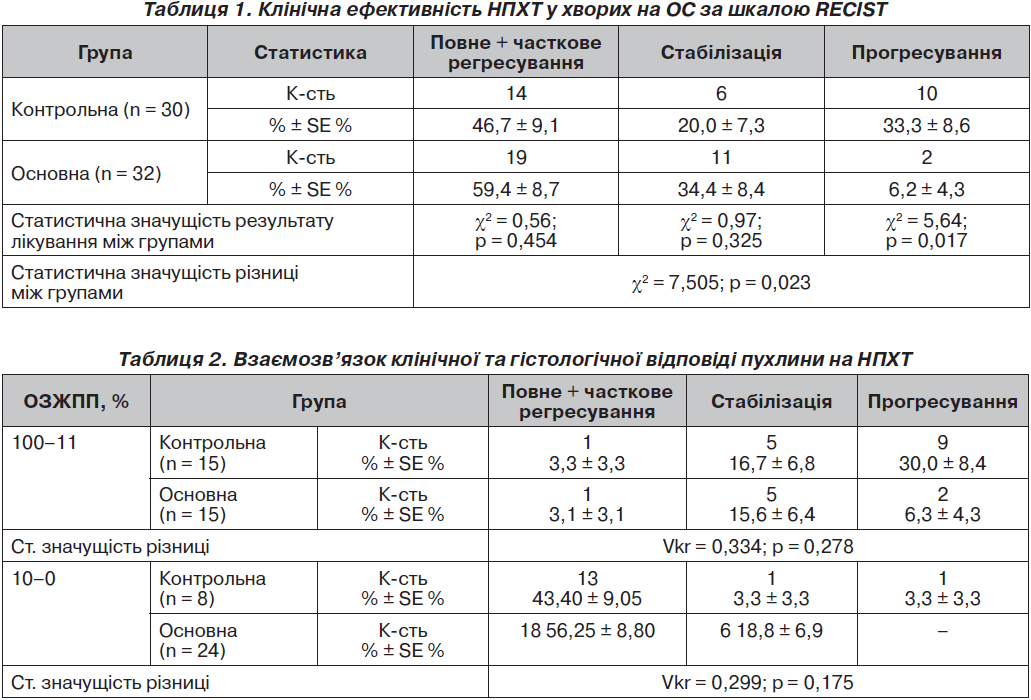
Результати аналізу клінічної відповіді у хворих на ОС відображені в табл. 1.
Хіміотерапія була ефективною у 19 (59,4 ± 8,7 %) хворих основної та 14 (46,7 ± 9,1 %) хворих контрольної групи, стабілізація стану спостерігалася в 11 (34,4 ± 8,4 %) хворих основної групи та 6 (20,0 ± 7,3 %) — контрольної. Статистично цей результат між групами був не значущім (χ2 = 0,56; р = 0,454 та χ2 = 0,97; р = 0,325), але в основній групі ми спостерігали прогресування у 2 (6,2 ± 4,3 %), а у контрольній — у 10 (33,3 ± 8,6 %) хворих, що становить статистично значущу різницю (χ2 = 5,64; р = 0,017). Таким чином, результат лікування хворих основної групи був статистично значущо (χ2 = 7,505; р = 0,023) кращим, ніж у контрольній групі. Новий метод лікування знизив кількість випадків прогресування пухлини на 18,6 %.
Результати співставлення клінічної та гістологічної відповіді на НПХТ у хворих досліджуваних груп наведено в табл. 2.
Виходячи з початкового рівня ОЗЖПП після неоад’ювантної ПХТ при ОЗЖПП 100–11 % повне регресування та стабілізація пухлини відмічалися в однакової кількості хворих — від 15 до 17 %, а прогресування пухлини в основній групі діагностувалося значно менше — на 23,7 %; при ОЗЖПП 10–0 % в основній групі майже у 18 (56,25 ± 8,80 %) спостерігали повне регресування пухлини, у контрольній — у 13 (43,40 ± 9,05 %) хворих, прогресування пухлини в основній групі не спостерігали, а в контрольній зареєстровано 1 (3,3 ± 3,3 %) випадок. Отже, результати протипухлинної терапії виявилися кращими в основній групі, але результати не досягли статистично значущої різниці.
Між регресуванням пухлини та рівнем ОЗЖПП спостерігалась зворотна високозначуща (r = –0,754; p = 0,001) залежність — слабку гістологічну відповідь пухлини на НПХТ (ОЗЖПП > 10 %) відзначали при прогресуванні процесу та рідше — при його стабілізації, а виражену гістологічну відповідь (ОЗЖПП ≤ 10 %) спостерігали при повному і частковому регресуванні пухлинного осередку — частіше у хворих основної групи (на 12,8 ± 4,5 %). Повний некроз клітин пухлини (ІV ступінь лікувального патоморфозу за Huvos A.). був вищим у хворих основної групи (на 7,3 ± 1,2 %).
Оскільки токсична дія цитостатиків може обме–жувати дозу та кількість курсів лікування, порушувати репаративні процеси, то у випадку ІІІ–ІV ступеня токсичності необхідне проведення інтенсивного симптоматичного лікування. Останнім часом з’явилися ефективні можливості запобігання і лікування таких найпоширеніших побічних ефектів, як диспептичні реакції і мієлосупресія.
Визначення ступеня токсичності проводили відповідно до рекомендацій Всесвітньої організації охорони здоров’я (ВООЗ) і Міжнародного протиракового союзу, в яких детально відображені види побічної дії протипухлинних препаратів. Токсичність НПХТ загалом залежала від застосованої схеми (цисплатин + доксорубіцин або цисплатин + доксорубіцин + кофеїн) та кількості проведених курсів.
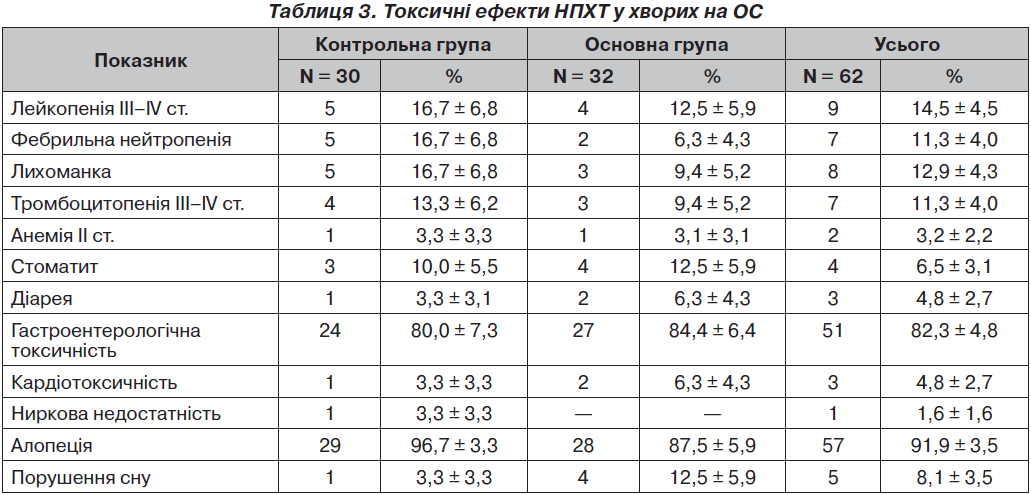
Результати дослідження токсичності ПХТ у хворих на ОС наведені у табл. 3.
Одним із перших і частих проявів токсичності були гастроентерологічні порушення.
Токсична дія цитостатиків ІІІ–ІV ступеня, при якій проводилось інтенсивне супровідне лікування, спостерігалась у 5 (16,7 ± 6,8 %) хворих контрольної і 4 (12,5 ± ± 5,9 %) основної групи.
Лікування і профілактика токсичних проявів дії хіміопрепаратів проводились відповідно до інструкції щодо застосування препарату. З цією метою ми використовували антагоністи рецепторів серотоніну, допаміну, антихолінергетики, антигістамінні препарати, кортикостероїди (дексаметазон, метилпреднізолон та ін.), інфузію сольових розчинів, сечогінні препарати. Нудота і блювання I–
III ст. відзначені в середньому у 90,0 ± 0,2 % хворих. Найбільший ефект для усунення нудоти і блювання мали блокатори 5-НТ3 рецепторів серотоніну (осетрон — 8 мг 3–6 р/день в/в), інфузія сольових розчинів (1000–2000 мл/день), фуросемід 20–40 мг/день. При затримці виведення метотрексату (6,2 %), після введення його високих доз, продовжували введення кальцію фолінату в дозі 15 мг/м2.
Частота лейкопенії III–IV ступенів за групами становила 14,45 ± 4,50 %, фебрильна нейтропенія та тромбоцитопенія III–IV ступенів зустрічались у 11,3 ± 4,0 %. Лікування лейкопенії проводили до нормалізації рівня лейкоцитів преднізолоном у дозі 15–30 мг/день, при фебрильній нейтропенії додавали антибіотики широкого спектра дії на 5–7 днів, при збереженні глибокої нейтропенії призначали ін’єкції колонієстимулюючих факторів 1 раз/день. Лікування тромбоцитопенії ІІ–III ступеня проводили у стаціонарі преднізолоном у дозі 15–30 мг/день, переливанням плазми крові, гемостатиками, при IV ступені проводили переливання тромбоконцентрату.
Анемію ІІ ступеня та гепатотоксичність режимів у вигляді транзиторної білірубінемії і підвищення рівня трансаміназ відзначено у поодиноких випадках — 2 (3,2 ± 2,2 %). У 3 (4,8 ± 2,7 %) хворих виникла діарея. Явища кумулятивної кардіотоксичності у вигляді погіршення електрокардіографічної картини з появою скарг спостерігались у 3 (4,8 ± 2,7 %) хворих. Порушення функції нирок відзначено в 1 (1,6 ± ± 1,6 %) хворого. Повна оборотна алопеція — у 57 (91,9 ± 3,5 %).
Під час введення кофеїну спостерігались порушення I–II ст. токсичності у вигляді короткочасного порушення сну у 4 (12,5 ± 5,9 %), підвищення частоти серцебиття — у 2 (6,3 ± 4,3 %), випадки нудоти та блювання збільшилися на 4,4 %. Одночасно виявилась тенденція до зниження частоти гематологічної токсичності III–IV ст. (лейкопенії — на 4,1 %, тромбоцитопенії — на 3,9 %). Ускладнень або реакцій, що зумовили б призупинення ПХТ, не спостерігалось.
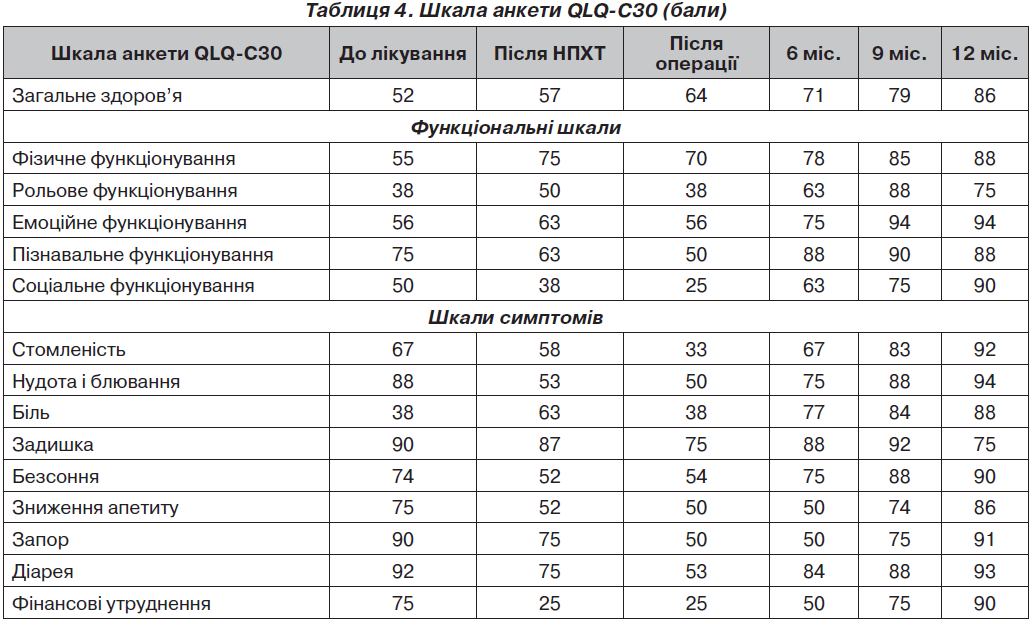
Неоад’ювантна хіміотерапія поліпшила якість життя пацієнтів за рахунок підвищення показників функціональних шкал і симптомів: фізичне функціонування — на 20 балів, рольове — на 12 балів, емоційний стан — на 7 балів, загальний статус здоров’я — на 7 балів, біль зменшився на 25 балів порівняно з показниками до лікування. Показники анкети EORTC-QLQ-C30 наведені у табл. 4.
Інші показники тимчасово понизились (зниження апетиту, блювання (на 35 балів), соціальне функціонування, фінансові утруднення) на фоні подальшої ПХТ з 2-го по 9-й місяць з об’єктивних причин.
Після проведеного хірургічного втручання порівняно зі станом до лікування якість життя хворих змінилась наступним чином: загальний стан здоров’я збільшився на 14 балів, фізичне функціонування — на 15 балів. Порівняння якості життя хворих після різних видів заміщення резектованих дефектів кісток виявило покращення показників після ендопротезування суглобів порівняно з автопластикою. Більшою мірою поліпшувались показники фізичного, рольового, емоційного функціонування внаслідок меншого післяопераційного періоду та кращого відновлення функції ураженого суглоба.
Після закінчення протоколу лікування (через 9–12 місяців) тенденція зростання показників якості життя виявилась остаточною. Загальний стан здоров’я збільшився на 36 балів, фізичне, рольове, емоційне, пізнавальне, соціальне функціонування — на 35–40 балів. У хворих відновилась робота шлунково-кишкового тракту, з’явився апетит, майже зникли біль та безсоння, поліпшилась функція кінцівки. При подальшому спостереженні (з 15-го по 21-й місяць) показники якості життя у хворих, які одужали, змінювались незначно, а у хворих з метастазами або рецидивом погіршувався у першу чергу загальний рівень здоров’я, емоційного, соціального, фінансового та інших видів функціонування.
Обговорення
Методи лікування, що проводяться хворим на ОС, повинні бути обґрунтовані і проведені з урахуванням гістологічної форми пухлини, її локалізації та поширеності. Основні практично значущі критерії ефективності передопераційної хіміотерапії та прогнозу хворих на ОС: клінічна, рентгенологічна позитивна динаміка у вигляді повного або часткового регресування за шкалою RECIST або ВООЗ; обсяг залишкової життєздатної пухлинної паренхіми після НПХТ менше 3,6 % у післяопераційному матеріалі; показники якості життя за анкетою EORTC QLQ-30 та виживаність хворих [1, 9]. Відмова від післяопераційної ПХТ навіть при вираженому патоморфозі негативно впливає на лікування. Також має місце залежність виживаності хворих від кількості курсів ПХТ. Слід зазначити, що ефективна НПХТ є запорукою подальшого успішного лікування, можливості проведення органозберігаючої операції і сприяє поліпшенню якості життя та підвищенню показників виживаності хворих.
У комплексі лікувальної тактики щодо хворих на ОС пропонується проведення 2–4 курсів неоад’ювантної ПХТ, після отримання позитивного ефекту хіміотерапевтичного лікування пропонується проведення резекції ураженої кістки з пухлиною та заміщення дефекту онкологічним ендопротезом суглоба. При рецидивах ОС пропонується проведення операції з видалення рецидиву з призначенням в післяопераційному періоді курсу ПХТ. При неоперабельних ОС, а також у разі відмови хворого від ампутації пропонується проведення курсів ПХТ та променевої терапії. Введення хворим із низьким лікувальним патоморфозом метотрексату у високій дозі, іфосфаміду та препаратів другої лінії дозволяє підвищити виживаність хворих [5, 11].
Парентеральне введення кофеїну після цитостатика дозволить підвищити відсоток некрозів клітин остеосаркоми, органозберігаючих хірургічних втручань і виживаність хворих без розвитку серйозних ускладнень [2–4, 12]. Тенденції до порушення сну, підвищення частоти серцебиття, нудоти та блювання, зниження частоти вираженої лейкопенії та тромбоцитопенії обумовлені збуджуючим впливом кофеїну на нервову і серцево-судинну системи. На фоні вказаного лікування в усіх випадках токсичність вдавалось контролювати, не зупиняючи лікування.
Висновки
Включення кофеїну (1 г на добу) до схеми НПХТ із застосуванням цисплатину (120 мг/м2) і доксорубіцину (70 мг/м2) призводить до незначного збільшення побічних ефектів І–ІІ ст. токсичності, що не вплинуло на виконання схеми хіміотерапії.
Дана схема НПХТ сприяє підвищенню показника лікувального патоморфозу пухлин III–IV ступенів у 59,3 ± 3,6 % хворих порівняно з контролем — 46,2 ± ± 4,0 % (p < 0,05) і забезпечує можливість проведення органозберігаючих операцій у 90,6 % хворих, що на 27,6 % більше, ніж у контрольній групі.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.