Резюме
Мета дослідження — вивчити частоту й особливості перебігу субклінічного синдрому Кушинга в жінок із синдромом полікістозних яєчників (СПКЯ). Матеріали та методи. Під спостереженням перебували 120 пацієнток фертильного віку із СПКЯ. Середній вік хворих становив 25,5 ± 4,3 року. 20 здорових жінок відповідного віку становили групу контролю. Усім хворим виконувався комплекс досліджень, що містив загальноклінічні, біохімічні і гормональні методи, ультразвукову діагностику матки і яєчників із фолікулометрією, а також магнітно-резонансну томографію турецького сідла й анкетування пацієнтів. Результати. Пацієнтки були розподілені на три групи: із первинним СПКЯ (19 %), із вторинним СПКЯ при ожирінні (74 %), із вторинним СПКЯ і субклінічним синдромом Кушинга (7 %). У групі пацієнток із первинним СПКЯ відзначалося вірогідне зниження як гіпофізарних, так і оваріальних гормонів на тлі гіперандрогенемії. У групі пацієнток із вторинним СПКЯ і субклінічним синдромом Кушинга було виявлено вірогідне зниження вмісту гіпофізарних гормонів на тлі гіперандрогенемії, однак оваріальна функція була в межах норми. При цьому відзначалася гіперінсулінемія. Висновки. Найбільш виражені порушення гіпофізарно-оваріальної функції були виявлені в групі пацієнток із СПКЯ і субклінічним синдромом Кушинга, у яких відзначалося вірогідне зниження функціонального стану системи «гіпофіз — гонади», а саме зниження рівня лютеїнізуючого, фолікулостимулюючого гормона, естрадіолу і прогестерону плазми крові на 14-й день менструального циклу на тлі гіперандрогенемії і гіперкортизолемії. Частота субклінічного синдрому Кушинга серед жінок із СПКЯ становить 6,6 %.
Цель исследования — изучить частоту и особенности течения субклинического синдрома Кушинга у женщин с синдромом поликистозных яичников (СПКЯ). Материалы и методы. Под наблюдением находились 120 пациенток фертильного возраста с СПКЯ. Средний возраст больных составил 25,5 ± 4,3 года. 20 здоровых женщин соответствующего возраста составили группу контроля. Всем больным выполнялся комплекс исследований, включавший общеклинические, биохимические и гормональные, ультразвуковое исследование матки и яичников с фолликулометрией, а также магнитно-резонансную томографию турецкого седла и анкетирование пациентов. Результаты. Пациентки были разделены на три группы: с первичным СПКЯ (19 %), со вторичным СПКЯ при ожирении (74 %), со вторичным СПКЯ и субклиническим синдромом Кушинга (7 %). В группе пациенток с первичным СПКЯ отмечалось достоверное снижение как гипофизарных, так и овариальных гормонов на фоне гиперандрогенемии. В группе пациенток со вторичным СПКЯ и субклиническим синдромом Кушинга было выявлено достоверное снижение гипофизарных гормонов на фоне гиперандрогенемии, однако овариальная функция была в пределах нормы. При этом отмечалась гиперинсулинемия. Выводы. Наиболее выраженные нарушения системы гипофизарно-овариальной функции были обнаружены в группе пациенток с СПКЯ и субклиническим синдромом Кушинга, у которых отмечалось достоверное снижение функционального состояния системы «гипофиз — гонады», а именно снижение уровня лютеинизирующего, фолликулостимулирующего гормона, эстрадиола и прогестерона плазмы крови на 14-й день менструального цикла на фоне гиперандрогенемии и гиперкортизолемии. Частота субклинического синдрома Кушинга среди женщин с СПКЯ составляет 6,6 %.
Background. The purpose of investigation is to study the incidence of subclinical Cushing’s syndrome in women with polycystic ovary syndrome (PCOS). Materials and methods. Under our supervision, there were 120 patients of fertile age with PCOS. The average age of patients was 25.5 ± 4.3 years. Twenty healthy women of corresponding age made a control group. The complex of researches, including clinical, biochemical, hormonal (luteinizing hormone (LH), follicle-stimulating hormone (FSH), prolactin, estradiol, progesterone, dehydroepiandrostendion, 17-hydroxyprogesterone, anti-Mullerian hormone, insulin on day 14 of cycle), was performed in all patients, as well as ultrasonography of the uterus and ovaries with folliculometry in dynamics, and also magnetic resonance imaging and survey of patients. Results. Patients were divided into three groups: with primary PCOS (19 %), with secondary PCOS and obesity (74 %), with secondary PCOS and subclinical Cushing’s syndrome (7 %).
In the first group of patients, a significant decrease of pituitary and ovarian hormones has been registered on the background of hyperandrogenemia. In the third group of patients, a significant decrease of pituitary hormones was also detected on the background of hyperandrogenemia. Conclusions. The most significant violations in the system of pituitary-ovarian function were found in the third group of patients with subclinical Cushing’s syndrome, at that, a significant decrease in the functional state of pituitary-gonadal system was marked, namely decline of LH, FSH, estradiol and progesterone on the background of hyperandrogenemia and hypercortisolemia. The incidence of subclinical Cushing’s syndrome among women with PCOS is 6.6 %. In future, it is necessary to monitor in dynamics the probability of recovery of fertility in all groups of patients with PCOS
Введение
Прошло более 70 лет с момента первой публикации о патологии, которая впоследствии получила название «синдром Штейна — Левенталя». Спустя некоторое время обозначение синдрома изменилось на клинико-патогенетическое — «синдром поликистозных яичников» (СПКЯ), а представление медиков об этом эндокринном заболевании (Е28.2 по МКБ-10) трансформировалось из разряда редкой патологии в категорию распространенной и поэтому социально значимой [2].
СПКЯ является частой формой эндокринопатии, наблюдается у 5–10 % женщин репродуктивного возраста и составляет 80 %, а по некоторым данным — даже 90 % от всех форм гиперандрогенемии [1–3].
СПКЯ — частая причина ановуляторного бесплодия, олигоменореи и гирсутизма. В целом ряде исследований показано, что для женщин характерна более частая, чем в общей популяции, инсулинорезистентность (ИР), причем независимо от индекса массы тела [4, 5]. Развивающаяся вследствие ИР гиперинсулинемия увеличивает синтез андрогенов в яичниках женщин с СПКЯ и снижает синтез белка, связывающего половые гормоны [6, 7], что приводит к повышению уровня андрогенов в крови и гирсутизму.
Ряд исследователей выражает мнение о том, что СПКЯ является фактором риска в отношении развития субклинического синдрома Кушинга [8, 9].
Клиническая картина классического гиперкортицизма включает диспластическое ожирение, трофические изменения кожных покровов, артериальную гипертензию, системный остеопороз, миопатию, стероидный сахарный диабет, гипогонадизм, вторичный иммунодефицит, стероидную энцефалопатию и эмоционально-психические расстройства. Большинство исследователей отмечают относительную редкость наличия всех симптомов как в развернутой стадии, так и при рецидиве заболевания [4, 10, 11].
В целом в литературе мало работ, посвященных этой теме, что и послужило причиной выполнения нашего исследования.
Цель исследования: изучить частоту и особенности субклинического синдрома Кушинга у женщин с СПКЯ.
Материалы и методы
В отделе нейроэндокринологии Республиканского специализированного научно-практического медицинского центра эндокринологии МЗ РУз амбулаторно было обследовано 120 пациенток фертильного возраста с СПКЯ по поводу первичного или вторичного бесплодия в период с сентября 2015 по июль 2016 года. Средний возраст больных составил 25,5 ± 4,3 года. Длительность заболевания колебалась в пределах от 7 месяцев до 9 лет. 20 здоровых женщин соответствующего возраста составили группу контроля.
У всех больных проводился комплекс исследований, включавший общеклинические (общий анализ крови и мочи), биохимические, гормональные (лютеинизирующий (ЛГ), фолликулостимулирующий гормон (ФСГ), пролактин, эстрадиол, прогестерон, свободный тестостерон, дегидроэпиандростендион (ДГЭА), 17-оксипрогестерон (17-ОКС), антимюллеров гормон (АМГ), инсулин на 14-й день цикла), ультразвуковое исследование матки и яичников (трансабдоминально и трансвагинально) на 14-й день цикла с фолликулометрией в динамике, а также магнитно-резонансную томографию (МРТ) турецкого седла (клиника «Диер Медикал Центр», г. Ташкент) и анкетирование пациентов. При необходимости выполняли глюкозотолерантный тест, определение кортизола в крови и свободного кортизола в суточной моче.
Антропометрическое исследование проводилось при первичном осмотре, в динамике и включало определение роста, массы тела (МТ), индекса массы тела (ИМТ), рассчитываемого по формуле: ИМТ (кг/м2) = (МТ, кг)/(рост, м)2. В соответствии со значениями ИМТ, рекомендованными ВОЗ (1997), определялась степень ожирения.
Полученные данные обрабатывали с помощью компьютерных программ Microsoft Excel и Statistica 6.0. Достоверность различий количественных показателей (n > 12) определялась по методу Вилкоксона для несвязанных диапазонов, для определения достоверности малых выборок (n < 12) использовался непараметрический критерий рандомизации компонент Фишера для независимых выборок, для качественных значений — точный критерий Фишера — Ирвина. Различия между группами считали статистически значимыми при р < 0,05. Вычислялись средние значения (М), стандартные отклонения средних (m).
Результаты
Пациентки были разделены на три группы: с первичным СПКЯ — 23 чел. (19 %), со вторичным СПКЯ на фоне ожирения — 89 (74 %), со вторичным СПКЯ и субклиническим синдромом Кушинга — 8 (7 %). В табл. 1 приведено распределение больных по возрасту.
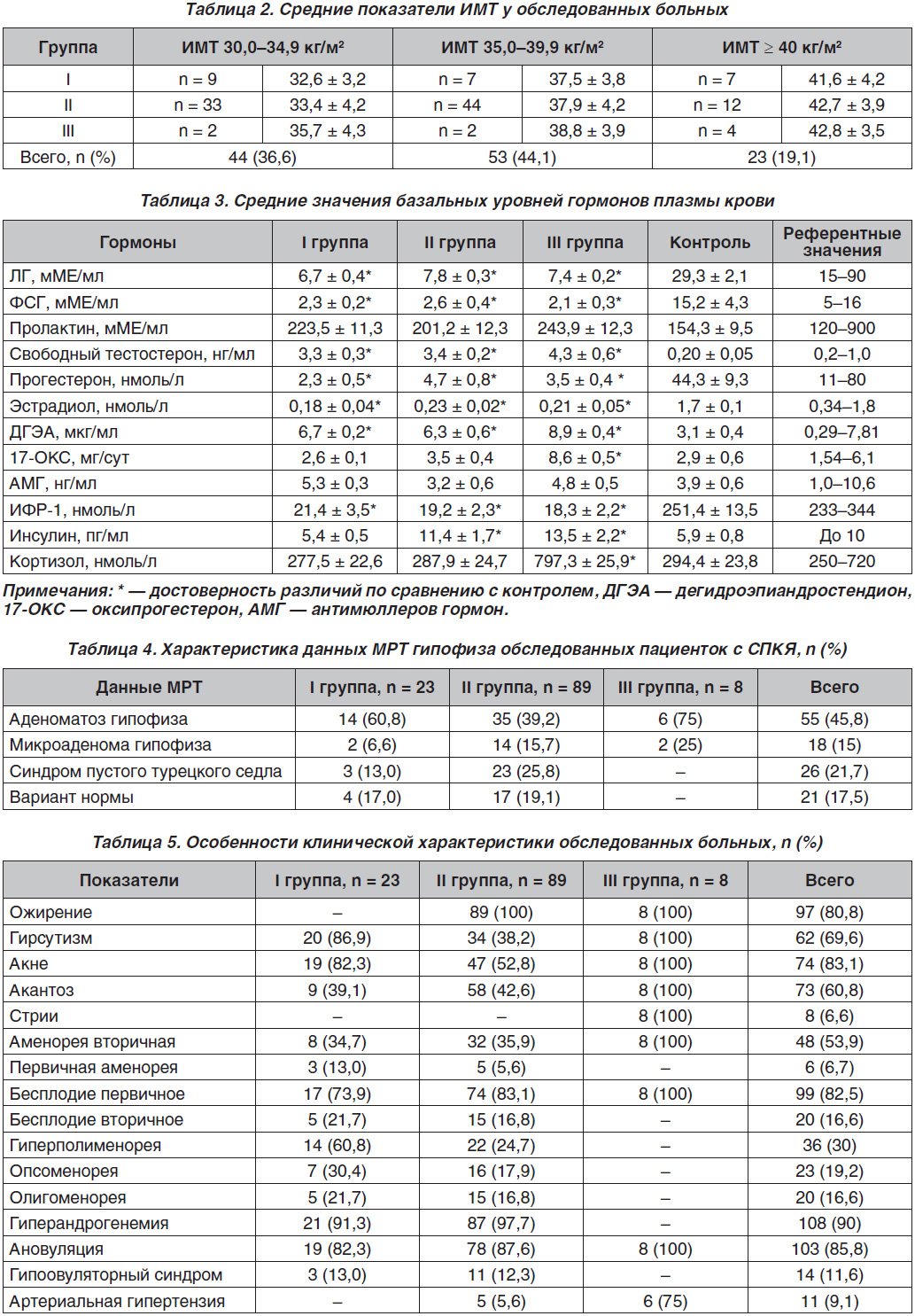
В табл. 2 приведены средние показатели ИМТ по группам больных. У большинства больных преобладало ожирение II степени — 53 случая из 120 (44,1 %).
Для более углубленного анализа нами были выполнены статистические исследования средних значений базальных уровней гормонов плазмы крови (на 14-й день цикла), что представлено в табл. 3.
В I группе пациенток отмечалось достоверное снижение как гипофизарных, так и овариальных гормонов на фоне гиперандрогенемии. Так, по сравнению с группой контроля на 14-й день цикла были достоверно снижены уровни ЛГ, ФСГ, инсулиноподобного фактора роста (ИФР)-1, а также эстрадиол, прогестерон, в то время как уровни свободного тестостерона, ДГЭА были повышены по сравнению с контрольными данными.
Во II группе пациенток также было выявлено достоверное снижение уровня гипофизарных гормонов на фоне гиперандрогенемии, однако овариальная функция находилась в пределах нормы. По сравнению с группой контроля на 14-й день цикла были достоверно снижены уровни ЛГ, ФСГ, ИФР-1, при этом уровни свободного тестостерона, ДГЭА были повышены по сравнению с контрольными данными.
В III группе пациенток наблюдалось достоверное снижение уровня гипофизарных гормонов на фоне гиперандрогенемии, при этом овариальная функция была в пределах нормы. По сравнению с группой контроля отмечалось достоверное снижение уровней ЛГ, ФСГ, ИФР-1. Уровни свободного тестостерона, ДГЭА, 17-ОКС, инсулина, кортизола плазмы были достоверно повышены по сравнению с контрольными данными.
Таким образом, во всех группах на 14-й день цикла отмечалось достоверное снижение базальных значений ЛГ, ФСГ, ИФР-1, прогестерона, эстрадиола на фоне гиперандрогенемии (повышенный уровень свободного тестостерона.). При этом во II и III группах отмечалась гиперинсулинемия. Только у пациенток III группы наблюдались достоверно повышенные значения ДГЭА, 17-ОКС и кортизола крови. Средние значения пролактина, АМГ не превышали референтные значения и были в норме.
В табл. 4 приведена характеристика данных МРТ гипофиза обследованных больных.
Нейровизуализация гипофиза у пациенток с СПКЯ выявила во многих случаях гиперплазию (аденоматоз) гипофиза — 55 случаев из 120 (45,8 %). Частота синдрома пустого турецкого седла составляла 26 случаев (21,7 %), микроаденомы гипофиза — 18 (15 %).
Далее нами были изучены особенности клинической характеристики больных (табл. 5).
Наиболее выраженные нейроэндокринные нарушения наблюдались в III группе больных: ожирение, гирсутизм, акне, акантоз, вторичная аменорея, первичное бесплодие, стрии, артериальная гипертензия, ановуляция.
Обсуждение результатов
У женщин, страдающих СПКЯ первичного, вторичного генеза и СПКЯ с синдромом Кушинга, обнаружены серьезные репродуктивные отклонения (от дисменореи до бесплодия) и выявлены нарушения гонадотропной функции гипофиза в виде недостаточной секреции ЛГ и ФСГ в середине цикла. Почти у 50 % пациенток III группы был ИМТ выше 40 кг/м2.
Наиболее выраженные нарушения системы гипофизарно-овариальной функции были обнаружены именно в группе пациенток с СПКЯ на фоне субклинического синдрома Кушинга. При этом отмечалось достоверное снижение функционального состояния системы «гипофиз — гонады» в виде снижения уровней ЛГ, ФСГ, эстрадиола и прогестерона плазмы крови на фоне гиперандрогенемии и гиперкортизолемии, ановуляции.
Выводы
1. Частота субклинического синдрома Кушинга среди женщин с СПКЯ достигает 6,6 %.
2. У всех обследованных больных на 14-й день цикла отмечалось достоверное снижение базальных значений ЛГ, ФСГ, ИФР-1, прогестерона, эстрадиола на фоне гиперандрогенемии. У больных II и III групп отмечалась гиперинсулинемия. Только у пациенток III группы установлено достоверное повышение уровней ДГЭА, 17-ОКС и кортизола крови.
3. Необходимо дальнейшее наблюдение в динамике за вероятностью восстановления фертильной функции у пациенток с СПКЯ во всех группах.
Конфликт интересов. Авторы констатируют отсутствие конфликта интересов при подготовке статьи.
Список литературы
1. Findling J.W. Screening and diagnosis of Cushing’s syndrome / J.W. Findling, H. Raff // Endocrinol. Metab. Clin. North Am. — 2005. — Vol. 34, № 2. — P. 385-402.
2. Nieman L. Cushing’s syndrome: update on signs, symptoms and biochemical screening / L. Nieman // Eur. J. Endocrinol. — Vol. 173. — P. 33-38. doi: 10.1530/EJE-15-0464.
3. Chanson P. Metabolic syndrome in Cushing’s syndrome / P. Chanson, S. Salenave // Neuroendocrinology. — 2010. — Vol. 92(Suppl. 1). — Р. 96-101.
4. Cardiovascular risk factors and common carotid artery caliber and stiffness in patients with Cushing’s disease during active disease and 1 year after disease remission / A. Faggiano et al. // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88. — Р. 2527-2533.
5. Metabolic and cardiovascular outcomes in patients with Cushing’s syndrome of different aetiologies during active disease and 1 year after remission / R. Giordano et al. // Clin. Endocrinol. (Oxf). — 2011. — Vol. 75. — Р. 354-360.
6. Association of subclinical hypercortisolism with type 2 diabetes mellitus: a case-control study in hospitalized patients / I. Chiodini et al. // Eur. J. Endocrinol. — 2005. — Vol. 153, № 6. — P. 837-844.
7. Screening for Cushing’s syndrome in obese patients / О. Tiryakioglu et al. // Clinics (Sao Paulo). — 2010. — Vol. 65, № 1. — P. 9-13.
8. Subclinical hypercortisolism among outpatients referred for osteoporosis / I. Chiodini et al. // Ann. Intern. Med. — 2007. — Vol. 147, № 8. — P. 541-548.
9. Zografos G.N. Subclinical Cushing’s syndrome: current concepts and trends / G.N. Zografos, I. Perysinakis, E. Vassilatou // Hormones (Athens). — 2014. — Vol. 13(3). — Р. 323-337.
10. The Diagnosis of Cushing’s syndrome: аn endocrine society clinical practice guideline / L.K. Nieman et al. // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93, № 5. — Р. 1526-1540.
11. Terzolo M. Subclinical Cushing’s syndrome: definition and management / M. Terzolo, A. Pia, G. Reimondo // Clinical Endocrinology. — 2012. — № 76. — Р. 12-18.