Резюме
Ендогенний гіперкортицизм є наслідком надмірної секреції синтезованих корою наднирників гормонів. Мета дослідження: вивчити характеристику клінічних, біохімічних, гормональних та інструментальних показників у хворих з АКТГ-залежним синдромом Кушинга до лікування і через 6 місяців після нього. Матеріали та методи. Під спостереженням перебувало 60 хворих з АКТГ-залежним синдромом Кушинга. Результати. У доопераційному періоді в пацієнтів з АКТГ-залежним синдромом Кушинга виявлено значні відхилення як показників антропометрії (індекс маси тіла, окружність талії, окружність стегон), так і ліпідного спектра крові. У доопераційному періоді в пацієнтів з АКТГ-залежним синдромом Кушинга виявлено вірогідно низькі базальні рівні лютеїнізуючого, фолікулостимулюючого, соматотропного гормона на тлі гіперкортизолемії та гіперінсулінемії. Висновки. Через 6 місяців після трансназальної селективної аденомектомії гіпофіза спостерігалися вірогідно низькі значення середніх величин лютеїнізуючого, фолікулостимулюючого, соматотропного, адренокортикотропного гормона на тлі нормальних показників кортизолу та імунореактивного інсуліну, що вказує на післяопераційний гіпопітуїтаризм. У післяопераційному періоді пацієнти з АКТГ-залежним синдромом Кушинга потребують замісної гормональної терапії.
Эндогенный гиперкортицизм является следствием избыточной секреции синтезируемых корой надпочечников гормонов. Цель исследования: изучить характеристику клинических, биохимических, гормональных и инструментальных показателей у больных с АКТГ-зависимым синдромом Кушинга до лечения и через 6 месяцев после него. Материалы и методы. Под наблюдением находились 60 больных с АКТГ-зависимым синдромом Кушинга. Результаты. В дооперационном периоде у пациентов с АКТГ-зависимым синдромом Кушинга выявлены значительные отклонения как показателей антропометрии (индекс массы тела, окружность талии, окружность бедер), так и липидного спектра крови. В дооперационном периоде у пациентов с АКТГ-зависимым синдромом Кушинга выявлены достоверно низкие базальные уровни лютеинизирующего, фолликулостимулирующего, соматотропного гормона на фоне гиперкортизолемии и гиперинсулинемии. Выводы. Через 6 месяцев после трансназальной селективной аденомэктомии гипофиза наблюдались достоверно низкие значения средних величин лютеинизирующего, фолликулостимулирующего, соматотропного, адренокортикотропного гормона на фоне нормальных показателей кортизола и иммунореактивного инсулина, указывающие на послеоперационный гипопитуитаризм. В послеоперационном периоде пациенты с АКТГ-зависимым синдромом Кушинга нуждаются в заместительной гормональной терапии.
Background. Endogenous hypercorticoidism is characterized by a higher secretion of parathyroid hormone against the background of hypercalcemia. The purpose of the investigation was to study the characteristics of anthropometric, biochemical, hormonal, clinical and instrumental parameters in patients with adrenocorticotropic hormone (ACTH) dependent Cushing’s syndrome before and 6 months after the treatment. Materials and methods. There were 60 patients with ACTH-dependent Cushing’s syndrome under supervision during 2015–2016. Results. In the preoperative period in patients with ACTH-dependent Cushing’s syndrome, we have revealed significant deviations of both indicators of anthropometry and lipid metabolism (dyslipidemia). In the preoperative period in patients with ACTH-dependent Cushing’s syndrome, we have also detected significantly lower basal levels of luteinizing hormone (LH), follicle-stimulating hormone (FSH), growth hormone (GH) on the background of hypercortisolemia and hyperinsulinemia. Conclusions. Six months after selective transsphenoidal pituitary adenomectomy, group 1 patients were found to have significantly low values of mean levels of LH, FSH, GH, ACTH on the background of normal levels of cortisol and immunoreactive insulin, indicating postoperative hypopituitarism. In the postoperative period, patients with ACTH-dependent Cushing’s syndrome require hormone replacement therapy.
Введение
Эндогенный гиперкортицизм является следствием избыточной секреции синтезируемых корой надпочечников гормонов [1]. При этом существует ряд заболеваний, имеющих одинаковую клиническую картину, но различающихся по патогенезу. Различают две основные формы эндогенного гиперкортицизма: АКТГ(адренокортикотропный гормон)-зависимую и АКТГ-независимую [2]. К АКТГ-зависимой форме относят болезнь Иценко — Кушинга и АКТГ-эктопированный синдром Кушинга. Если при болезни Иценко — Кушинга патология развивается вследствие повышения кортикотропной активности гипофиза с последующей гиперфункцией коры надпочечников и морфологическими изменениями в них, то при АКТГ-эктопированном синдроме Кушинга — из-за гиперпродукции АКТГ или кортикотропин-рилизинг-гормоноподобных веществ, вырабатываемых опухолями эндокринной и неэндокринной системы [3, 4].
При этом в области изучения АКТГ-зависимых форм эндогенного гиперкортицизма уже накоплен определенный практический опыт и выполнено довольно много научных исследований, однако пока еще остается много нерешенных вопросов. Все использующиеся методы лечения имеют свои как достоинства, так и недостатки, стойких положительных результатов не дает ни один из них, и частота рецидивов остается на довольно высоком уровне [5]. Программы массового обследования на предмет выявления эндогенного гиперкортицизма в целевых группах населения показывают превалирующее число недиагностированных и субклинических случаев [6].
Цель исследования: изучить характеристику клинических, биохимических, гормональных и инструментальных показателей у больных с АКТГ-зави–симым синдромом Кушинга до лечения и через 6 месяцев после него.
Материалы и методы
Под наблюдением находились 60 больных с АКТГ-зависимым синдромом Кушинга, обратившихся в Республиканский специализированный научно-практический центр эндокринологии с 2015 по 2016 г. Средний возраст больных составил 33,9 ± 12,5 года, длительность заболевания — в среднем от трех месяцев до пяти лет. Группа контроля состояла из 20 здоровых больных соответствующего возраста. Первую подгруппу составили 35 больных с осложнениями и вторую (25 больных) — без осложнений.
У всех пациентов применялись общеклинические, биохимические (липидограмма, электролиты крови), гормональные методы исследования крови (определение АКТГ, пролактина, кортизола, эстрадиола, прогестерона, свободного тестостерона, ритма секреции кортизола), а также большая проба с дексаметазоном, ЭКГ, ультразвуковая денситометрия. Всем пациентам была выполнена магнитно-резонансная томография гипофиза и компьютерная томография надпочечников. При необходимости осуществлялся пероральный глюкозотолерантный тест.
Антропометрическое исследование проводилось при первичном осмотре и в динамике и включало определение роста, массы тела, индекса массы тела (ИМТ). В соответствии со значениями ИМТ, рекомендованными ВОЗ (1997), определялась степень ожирения.
Полученные данные обрабатывали с помощью компьютерных программ Microsoft Excel и Statistica 6.
Вычислялись средние значения (М), стандарт–ные отклонения средних (m). Достоверность различий в уровне между группами оценивалась по величине доверительного интервала и критерия Стьюдента (р). Различия считали статистически значимыми при р < 0,05.
Результаты
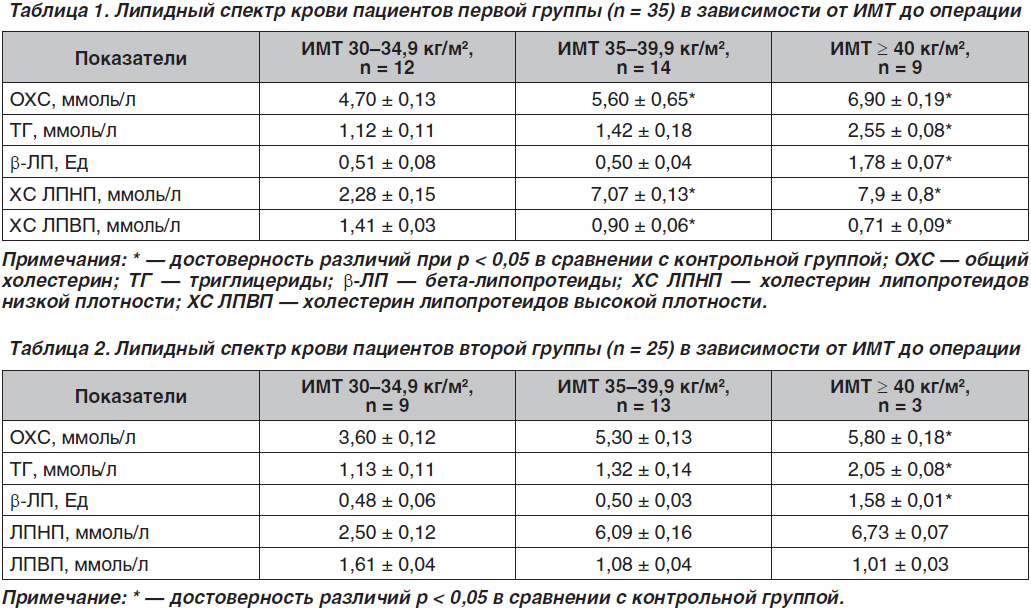
Большую часть обследованных (96,2 %) составили пациенты в возрасте от 18 до 44 лет. Наиболее часто отмечались пациенты с ожирением I степени. Нами изучены антропометрические данные по группам до лечения. При изучении биохимических показателей крови в первой группе больных было выявлено нарушение толерантности к глюкозе у 20 % обследованных. Показатели липидного профиля до лечения сравнивались в зависимости от ИМТ и представлены в табл. 1 и 2.
В первой и второй группах исследуемых содержание липидов в крови варьировало от нормальных значений при ожирении I степени до их значительных отклонений у больных со II и III степенью ожирения.
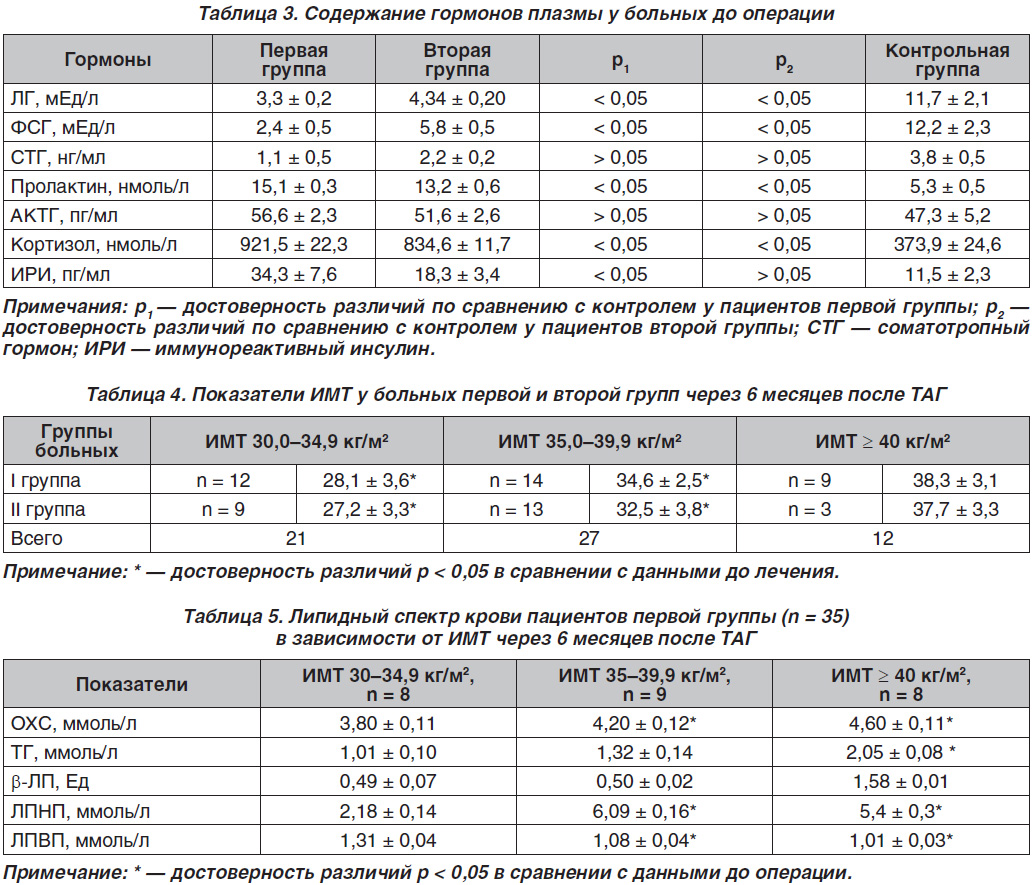
В табл. 3 приведены средние значения гормонов плазмы обследованных больных до операции.
Таким образом, в первой группе больных были выявлены достоверно низкие значения средних величин лютеинизирующего (ЛГ), фолликулостимулирующего гормона (ФСГ) на фоне гиперкортизолемии и гиперинсулинемии. Как видно из табл. 3, гормональные изменения у пациентов второй группы характеризовались гипогонадотропинемией на фоне гиперкортизолемии.
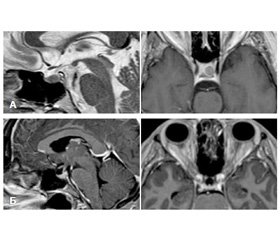
Проведение компьютерной и магнитно-резонансной томографии турецкого седла позволило выявить аденомы гипофиза небольших размеров (интраселлярные, до 10 мм) у 45 больных, макро–аденомы (с супраселлярным ростом) — у 15 больных.
Пациентам была проведена трансназальная селективная аденомэктомия гипофиза (ТАГ) в отделении нейрохирургии Республиканского специализированного научно-практического центра эндокринологии.
В табл. 4 представлены данные антропометрии по группам через 6 месяцев после ТАГ.
Как видно из табл. 4, в обеих группах пациентов отмечалось достоверное снижение ИМТ после лечения, в то время как у пациентов с ожирением III степени до лечения через 6 месяцев после лечения была достигнута значительная тенденция к снижению ИМТ до показателей ожирения II степени.
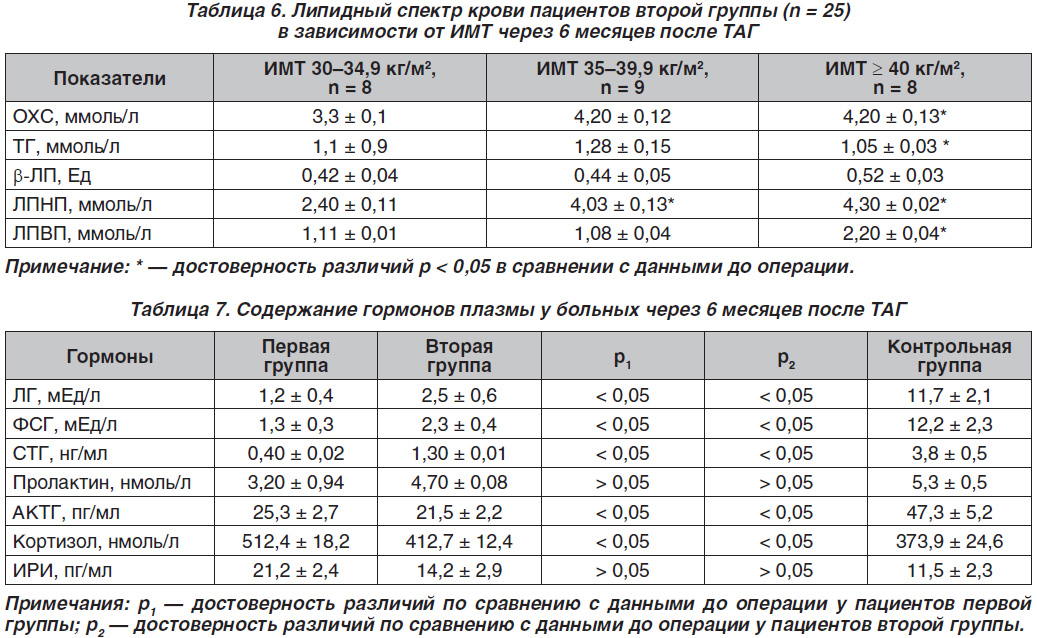
Через 6 месяцев после хирургического лечения нами были сопоставлены показатели липид–ного профиля в обеих группах с данными до лечения (табл. 5 и 6).
Таким образом, через 6 месяцев после ТАГ в первой и второй группах больных значения показателей липидограммы находились в пределах от нормальных значений при ожирении I степени до их значительных отклонений в зависимости от ИМТ. Уровни ОХС, ТГ, b-ЛП достоверно достигли нормальных значений у больных со II и III степенями ожирения.
В табл. 7 приведены средние значения гормонов плазмы обследованных больных через 6 месяцев после ТАГ.
Таким образом, через 6 месяцев после ТАГ в первой и второй группах больных были выявлены достоверно низкие значения средних величин ЛГ, ФСГ, СТГ, АКТГ на фоне нормальных показателей кортизола и ИРИ, указывающие на послеоперационный гипопитуитаризм.
Обсуждение
Клиническая картина АКТГ-зависимого синдрома Кушинга многообразна, его дифференциальная и топическая диагностика сложна, исследования дорогостоящие, консервативная терапия длительна и не всегда эффективна. Данный вариант синдрома Кушинга не является редким заболеванием, однако вызывает значительные проблемы в диагностическом, хирургическом и анестезиологическом аспекте, а также в реабилитационном периоде.
С внедрением в клиническую практику со–временных методов визуализации надпочечников улучшилась диагностика их заболеваний и, соответственно, возросла необходимость оперативного лечения.
Остаются актуальными вопросы предоперационной подготовки, ведения обезболивания, что связано с многочисленными осложнениями, возникающими как во время операции, так и в послеоперационном периоде. Высокая летальность (до 8 %) и частые рецидивы заболевания (от 3 до 5 %) свидетельствуют о том, что данная проблема далека от окончательного разрешения. Поэтому требуется длительное наблюдение за пациентами с данной патологией.
Выводы
В дооперационном периоде у пациентов с АКТГ-зависимым синдромом Кушинга выявлены значительные отклонения как показателей антропометрии (ИМТ, окружность талии, окружность бедер), так и липидного спектра крови.
В дооперационном периоде у пациентов с АКТГ-зависимым синдромом Кушинга выявлены достоверно низкие базальные уровни ЛГ, ФСГ, СТГ на фоне гиперкортизолемии и гиперинсулинемии.
Через 6 месяцев после ТАГ наблюдались достоверно низкие значения средних величин ЛГ, ФСГ, СТГ, АКТГ на фоне нормальных показателей кортизола и ИРИ, указывающие на послеоперационный гипопитуитаризм.
В послеоперационном периоде пациенты с АКТГ-зависимым синдромом Кушинга нуждаются в заместительной гормональной терапии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов при подготовке данной статьи.
Список литературы
1. Кирилюк М.Л. Диагностика и лечение гипофизарного синдрома Кушинга // Міжнародний ендокринологічний журнал. — 2014. — № 6. — С. 182-193.
2. Калинин А.П., Майстренко Н.А., Ветшев П.С. Хирургическая эндокринология: Руководство для врачей. — Санкт-Петербург: Питер, 2014. — 960 с.
3. Abraham S.B., Abel B.S., Rubino D. A direct comparison of quality of life in obese and Cushing’s syndrome patients // Eur. J. Endocrinol. — 2013. — Vol. 168(5). — P. 787-93.doi: 10.1530/EJE-12-1078.
4. Badia X., Valassi E., Roset M. Disease-specific quality of life evaluation and its determinants in Cushing’s syndrome: what have we learnt? // Pituitary. — 2014. — Vol. 17(2). — P. 187-195. doi: 10.1007/s11102-013-0484-2.
5. Keil M.F. Quality of life and other outcomes in children trea–ted for Cushing syndrome // J. Clin. Endocrinol. Metab. — 2013. — Vol. 98(7). — P. 2667-2678. doi: 10.1210/jc.2013-1123.
6. Nelson L.M., Forsythe A., McLeod L. Psychometric evaluation of the Cushing’s Quality-of-Life questionnaire // Patient. — 2013. — Vol. 6(2). — P. 113-124. doi: 10.1007/s40271-013-0012-5.
7. Neychev V., Steinberg S.M., Yang L. Long-Term Outcome of Bilateral Laparoscopic Adrenalectomy Measured by Disease-Specific Questionnaire in a Unique Group of Patients with Cu–shing’s Syndrome // Ann. Surg. Oncol. — 2015. — Vol. 22(3). — P. 699-706. doi: 10.1245/s10434-015-4605-1.
8. Crespo I., Valassi E., Santos A. Health-related qua–lity of life in pituitary diseases // Endocrinol. Metab. Clin. North Am. — 2015. — Vol. 44(1). — P. 161-170. doi: 10.1016/j.ecl.2014.10.013.
9. Santos A., Crespo I., Aulinas A. Quality of life in Cushing’s syndrome // Pituitary. — 2015. — Vol. 18(2). — P. 195-200. doi: 10.1007/s11102-015-0640-y.
10. Tiemensma J., Depaoli S., Felt J.M. Using subscales in the Cushing’s quality of life questionnaire // Eur. J. Endocrinol. — 2016. — Vol. 174(1). — P. 33-40. doi: 10.1530/EJE-15-0640.
11. Tritos N.A., Biller B.M., Swearingen B. Management of Cushing’s syndrome // Nat. Rev. Endocrinol. — 2011. — Vol. 7. — P. 279-289.
12. Papoian V., Biller B.M., Webb S.M. Patients perception on clinical outcome and quality of life after a diagnosis of Cushing Syndrome // Endocr. Pract. — 2016. — Vol. 22(1). — P. 51-67.
13. Roset M., Badia X., Forsythe A. Mapping CushingQoL scores onto SF-6D utility values in patients with Cushing’s syn–drome // Patient. — 2013. — Vol. 6(2). — P. 103-11. doi: 10.1007/s40271-013-0010-7.