Резюме
Досліджено морфофункціональний стан молочних залоз, матки та яєчників за даними ультразвукового дослідження та вмістом гонадотропних і статевих гормонів у крові в жінок після тиреоїдектомії та радіойодтерапії на супресивній терапії препаратами левотироксину, що дозволяє оцінити гормональну забезпеченість менструального циклу та стан репродуктивної сфери. Виявлено ознаки порушень менструального циклу й недостатності лютеїнової фази в процесі лікування, також унаслідок тривалої відносної гіперестрогенії у 82,6 % випадків визначено дисгормональні гіперплазії молочних залоз та у 80,4 % випадків діагностовано гіперпластичні захворювання матки та яєчників, у тому числі генітальний ендометріоз, гіперплазію ендометрію, міоми матки. Для даної категорії хворих необхідні тривалий моніторинг (раз на 3 місяці) рівня тиреотропного гормону, тиреоглобуліну, антитіл до тиреоглобуліну, фолікулостимулюючого, лютеїнізуючого гормонів, пролактину, прогестерону, тестостерону вільного, естрадіолу, а також корекція забезпеченості циклу за допомогою гормональних і негормональних методів.
Изучено морфофункциональное состояние молочных желез, матки и яичников по данным ультразвукового исследования и содержанию гонадотропных и половых гормонов в крови женщин после тиреоидэктомии и радиойодтерапии на супрессивной терапии препаратами левотироксина, что позволяет оценить гормональную обеспеченность менструального цикла и состояние репродуктивной сферы. Выявлены признаки нарушений менструального цикла и недостаточности лютеиновой фазы в процессе лечения, также вследствие длительной относительной гиперэстрогении в 82,6 % случаев диагностированы дисгормональные гиперплазии молочных желез и в 80,4 % случаев диагностированы гиперпластические заболевания матки и яичников, в том числе генитальный эндометриоз, гиперплазия эндометрия, миомы матки. Для данной категории больных необходимы длительный мониторинг уровня тиреотропного гормона, тиреоглобулина, антител к тиреоглобулину, фолликулостимулирующего, лютеинизирующего гормонов, пролактина, прогестерона, тестостерона, а также коррекция обеспеченности цикла с помощью гормональных и негормональных методов.
Using ultrasound data and content of gonadotropin and sex hormones in the blood, the morphological and functional state of the mammary glands, the uterus and the ovaries were studied in women after thyroidectomy and radioiodine therapy, who were taken suppressive therapy with levothyroxine drugs that allows to estimate the hormonal supply of the menstrual cycle and the state of reproductive system. The signs of menstrual cycle disorders and luteal phase deficiency were revealed during the treatment, and dyshormonal hyperplasia of mammary glands was also diagnosed in 82.6 % of cases due to prolonged relative hyperestrogenism and hyperplastic diseases of the uterus and the ovaries, including genital endometriosis, endometrial hyperplasia, uterine myomas, were identified in 80.4 % of cases. A long-term monitoring (every 3 months) of thyroid-stimulating hormone, thyroglobulin, thyroglobulin antibodies, follicle-stimulating hormone, luteinizing hormone, prolactin, progesterone, free testosterone, estradiol levels and also the correction of cycle supply using hormonal and non-hormonal methods are needed for this category of patients.

Вступ
За даними літератури, обговорюється багато чинників розвитку дифузного фіброаденоматозу молочних залоз (ДФАМ), але єдиної трактовки даних немає [1–3]. Більшість авторів стверджують, що мастопатія (ДФАМ) часто спостерігається при гіперестрогенії: дисфункційних маткових кровотечах, ановуляторній безплідності, міомі матки, ендометриозі, фолікулярних кістах. При цьому важ–ливу роль відіграє не тільки концентрація гормонів у плазмі крові, але й стан рецепторів статевих стероїдів у тканині молочної залози. Прямої кореляції між вмістом статевих стероїдів у сироватці крові, станом ендометрію та молочних залоз у жінок репродуктивного віку не виявлено. Тому залишається дискутабельним питання, чому в низці випадків диспластичні процеси поширюються не на всю молочну залозу, а тільки на певні ділянки. За даними дослідників [4, 5], це пов’язано з дефіцитом гестагенів і чутливістю рецепторів до естрадіолу та прогестерону. Гормональний дисбаланс сприяє морфофункціональній перебудові молочних залоз, і в частини жінок в умовах активації рецепторного апарата молочних залоз формуються патологічні зміни [6, 7].
Унаслідок тиреоїдектомії з приводу диференційованої карциноми щитоподібної залози (ЩЗ), подальшої радіойодтерапії (РЙТ) та призначення супресивних доз левотироксину в пацієнток репродуктивного віку в короткий проміжок часу відбуваються різкі коливання гомеостазу, зокрема перехід з еутиреозу в стан глибокого гіпотиреозу, а потім настає період тривалого гіпертиреозу (з метою супресії тиреотропного гормону (ТТГ)). За наявності залишкової тканини ЩЗ та метастазів карциноми пацієнтам проводиться декілька сеансів РЙТ, і такі коливання гормонального статусу спостерігаються частіше та, безперечно, впливають на стан гіпофізарно-яєчникової системи [8]. За даними наших попередніх досліджень [9, 10], це призводить до розвитку відносної недостатності прогестерону й сприяє виникненню гіперестрогенії протягом тривалого часу, унаслідок чого активуються проліферативні процеси в епітелії молочних залоз та репродуктивних органах малого таза. Отже, у даної категорії хворих виникає необхідність у постійному моніторуванні рівня ТТГ (адекватність дози супресивної терапії), тиреоглобуліну (як пухлинного післяопераційного маркера), антитіл до тиреоглобуліну (вірогідність показників тиреоглобуліну), а також фолікулостимулюючого (ФСГ), лютеїнізуючого (ЛГ) гормонів, тестостерону вільного, естрадіолу, прогестерону, пролактину (визначення впливу на репродуктивну систему та молочні залози).
За даними літератури [11, 12], патологічні зміни в молочних залозах поширені серед жінок з ендометріоїдними гетеропатіями (76 %). При ретроцервікальній формі вони виникають у 92,3 %, при ендометріомах — у 88,9 %, при аденоміозі — у 82,3 % жінок. У таких жінок розвиток вузлових фоpм ДФАМ спостерігається з частотою від 29,6 до 38,5 % випадків.
На нашу думку, гіперпластичні захворювання — це єдиний генералізований процес у репродуктивній сфері, що збігається з даними інших досліджень.
Згідно з даними [13, 14], показано, що нормальні тиреоцити, як і клітини високодиференційованих пухлин, містять рецептори до естрадіолу та прогестерону. Крім того, показано, що естрогени підвищують чутливість тиреотрофів до тиреоїдних гормонів.
Порушення фізіологічної секреції тиреоїдних гормонів, що є модулятором дії естрогенів на клітинному рівні, зумовлює дисгормональний стан із розвитком гіперпластичних процесів ендометрію. Згідно з дослідженням [15], гіперплазія ендометрію буває в 2,3 раза частіше в жінок із порушенням функції ЩЗ, а частота рецидивів гіперплазії може залежати від тривалості тиреоїдної дисфункції.
Унаслідок порушення співвідношення між естро–генами та прогестероном у 97,8 % жінок репродуктивного віку з нейроендокринною патологією виникають дисгормональні гіперпластичні процеси в молочних залозах. У випадку олігоменореї гіпер–плазія в молочних залозах виявляється вдвічі частіше, ніж в ендометрії. Основними чинниками дисгормональних гіперплазій є гіпотиреоз (підвищує ризик розвитку ДФАМ у 2,5–3,0 раза), гіпертиреоз (сприяє проліферації епітелію молочних залоз), цукровий діабет, гіпоталамічний синдром [16].
Серед вивчених механізмів впливу на процеси проліферації в частках молочних залоз провідна роль належить підвищеному вмісту пролактину та порушенню ритму його секреції. Пролактин має ростостимулюючий ефект, індукує утворення власних рецепторів у молочних залозах, що сприяє зростанню кількості епітеліальних клітин, а також підвищує активність естрогенних рецепторів.
Надлишок естрогенів сприяє мітотичному ефекту в епітелії молочної залози, стимулює розвиток строми, посилює кровопостачання молочної залози, стимулює розвиток ектазії проток і формування кіст. Проліферативні форми ДФАМ є чинниками ризику розвитку раку молочної залози, частота випадків якого зростає в 1,5–1,7 раза залежно від форми ДФАМ. У розвитку гіперпластичних процесів матки та яєчників значна роль відводиться стресовому чиннику, яким у випадку лікування раку ЩЗ (РЩЗ) є тиреоїдектомія, РЙТ, гіпотиреоз, а згодом гіпертиреоз на тлі супресивної терапії препаратами левотироксину.
У літературі останніх років нами не знайдено достатньої кількості даних про вплив наявних регіонарних або дистантних метастазів на частоту виникнення дисгормональних гіперплазій у матці та молочних залозах.
Метою даного дослідження була оцінка ультра–звукової структури молочних залоз у жінок з регіонарними метастазами РЩЗ, які отримали декілька курсів РЙТ, а також вивчення ехоструктури матки та яєчників у цих жінок.
Матеріали та методи
Обстежено 46 жінок віком 19–42 роки після тиреоїдектомії та РЙТ з приводу диференційованого РЩЗ. Групу порівняння становили 22 практично здорові жінки без патології ЩЗ.
Усі жінки були оглянуті ендокринологом, гінекологом-ендокринологом, радіологом. Усім пацієнткам було проведене ультразвукове дослідження (УЗД) ЩЗ (ложа ЩЗ) та лімфатичних вузлів шиї за допомогою лінійного ультразвукового сканера Siemens Sonoline G50 № GEE0773 із частотою датчика 10–5 МГц.
Усім жінкам проводилось УЗД молочних залоз на 7–11-й день менструального циклу лінійним датчиком з частотою 10–5 МГц для оцінки їх морфофункціонального стану, а також УЗД матки та яєчників ендовагінальним трансд’юсером із частотою датчика 9–4 МГц.
Усі жінки після тиреоїдектомії отримували супресивну терапію препаратами левотироксину в дозі 2,25 мкг/кг, рівень ТТГ наближався до 0,01–0,1 мОд/л. На період до 6 тижнів перед РЙТ відмінявся прийом препаратів левотироксину. Для контролю адекватності супресивної терапії та ранньої діагностики рецидиву захворювання контролювали вміст ТТГ, тиреоглобуліну та антитіл до тиреоглобуліну в крові раз на три місяці.
Для оцінки гормональної забезпеченості менструального циклу визначався вміст гонадотропних (ЛГ, ФСГ), пролактину та статевих (естрадіол, прогестерон, тестостерон) гормонів на 7, 14, 21 і 26-й день менструального циклу.
Результати
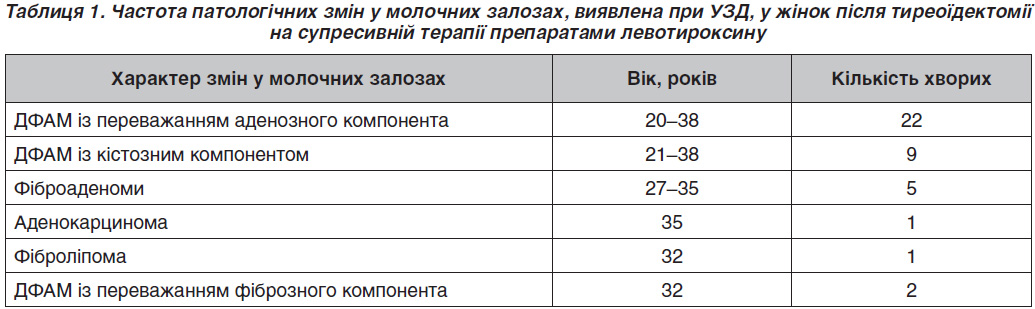
Серед жінок основної групи за даними УЗД у 15 (32,6 %) осіб патології молочних залоз нами не виявлено, в 31 випадку (67,4 %) діагностовано УЗД-ознаки патологічних змін (табл. 1). Серед хворих із виявленою патологією молочних залоз у 22 жінок (71 %) діагностовано ДФАМ з переважанням аденозного компонента, у 9 (29 %) — ознаки ДФАМ із кістозним компонентом, у 5 (16,1 %) — фіброаденоми, в 1 (3,2 %) — аденокарциному (верифіковано гістологічно), в 1 (3,2 %) — фіброліпому, у 2 (6,5 %) — ДФАМ з переважанням фіброзного компонента. У 9 (20 %) жінок спостерігалася поєднана патологія (ДФАМ + фіброаденоми, ДФАМ + кістозний компонент, фіброаденома + аденокарцинома). 3 (6,5 %) жінки оперовані: аденокарцинома, листоподібні фіброаденоми. 6 (13 %) жінок приймали гормонозамісну терапію, що включала прогестини, призначену гінекологом-ендокринологом, унаслідок чого в них спостерігали позитивну динаміку: зменшення проявів ДФАМ, заміщення кіст жировою тканиною, відсутність збільшення об’єму фіброаденом, покращення самопочуття. У випадку аденокарциноми після оперативного лікування жінці було призначено прийом антигонадотропінів і рентгенотерапію, тому цей випадок потім було вилучено з дослідження.
У жінок контрольної групи виявлено 5 випадків ДФАМ із переважанням аденозного компонента (22,7 %), 1 випадок ДФАМ із кістозним компонентом (4,5 %), зміни в молочних залозах виявлені в 6 жінок (27,2 %), що в 6,3 раза менше, ніж в основній групі. У жінок контрольної групи зміни в молочних залозах виявлено в 6 (27,2 %) випадках, що в 5,2 раза менше, ніж в основній групі.
Обговорення
При аналізі гормональних показників ознаки недостатності лютеїнової фази менструального циклу виявлені у 29 (63 %) обстежених.
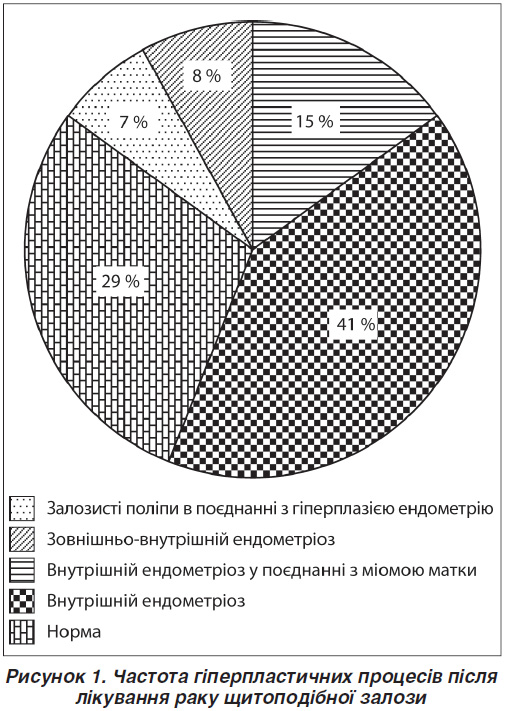
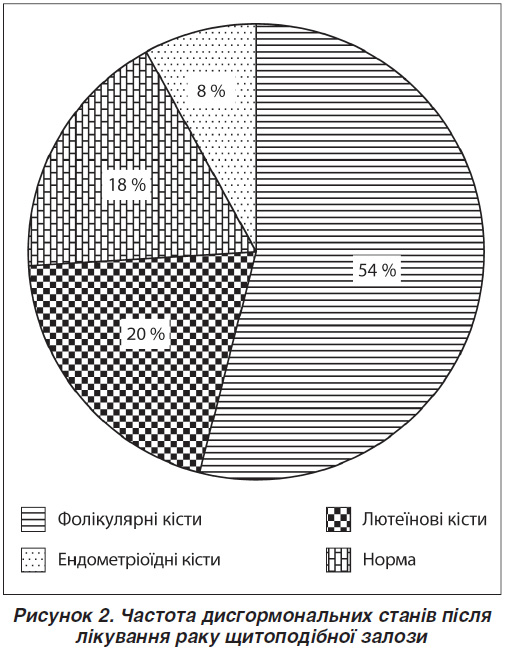
За даними УЗД репродуктивних органів малого таза ознаки проліферативних змін виявлено в 32 (69,6 %) жінок. Ознаки внутрішнього ендометріозу діагностовано у 22 (58,7 %) осіб, міоматозні вузли — у 10 (21,7 %), поліпи ендометрію — у 3 (6,5 %), гіперплазію ендометрію — у 3 (6,5 %), ознаки зовнішньо-внутрішнього ендометріозу — в 5 (10,8 %), фолікулярні кісти — у 25 (54,3 %) жінок. У 12 з них (26,1 %) відзначалася поєднана патологія (рис. 1, 2).
У контрольній групі ознаки внутрішнього ендометріозу виявлено в 5 (22,7 %) жінок, фолікулярні кісти — у 4 (18,1 %). Отже, проліферативні зміни в основній групі виявлялись в 4,1 раза частіше, ніж у контрольній.
Результати проведеного нами дослідження та дані літератури показують, що жінки після тиреоїдектомії, які отримують супресивну терапію препаратами левотироксину, входять у групу підвищеного ризику розвитку генітального ендометріозу та ДФАМ із вузловим компонентом.
Слід зазначити, що тривала супресивна терапія препаратами левотироксину може ускладнюватись медикаментозним тиреотоксикозом, що погіршує стан хворих із супутньою патологією, тому при її проведенні слід враховувати прогностичні чинники та вік пацієнтки. У жінок із групи низького й середнього ризику можливого рецидиву РЩЗ, які перебувають у стані стійкої ремісії в межах 12 років, можна обмежитись замісною гормонотерапією з цільовим значенням ТТГ 0,5–1,0 мОд/л за умови, що рівень тиреоглобуліну не перевищує 2, а АТТГ — у межах норми [16]. На нашу думку, така тактика прийнятна для корекції гормонального дисбалансу і в репродуктивній сфері.
Висновки
1. У жінок після тиреоїдектомії та РЙТ із приводу диференційованої карциноми ЩЗ у процесі лікування виявляються ознаки порушень менструального циклу й недостатності лютеїнової фази.
2. Унаслідок відносної гіперестрогенії в жінок репродуктивного віку після радикального лікування РЩЗ у 82,6 % випадків визначаються дисгормональні гіперплазії молочних залоз, а у 80,4 % випадків діагностовано гіперпластичні захворювання матки та яєчників.
3. Різкі коливання тиреоїдного статусу на фоні супресивної терапії левотироксином можуть призводити до розвитку гіперпластичних процесів органів малого таза, у тому числі генітального ендометріозу, залозистої гіперплазії ендометрію, міоми матки.
4. Жінки репродуктивного віку після тиреоїдектомії та РЙТ з приводу диференційованої карциноми ЩЗ у подальшому, при призначенні терапії препаратами левотироксину, потребують корекції порушень менструального циклу за допомогою гормональних та негормональних методів. Дана категорія хворих потребує тривалого моніторингу (раз на 3–6 місяців) гормональних показників: рівня ТТГ, тиреоглобуліну, антитіл до тиреоглобуліну, ФСГ, ЛГ, пролактину, прогестерону, тестостерону, естрадіолу.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Паньків В.І. Вплив дисфункції щитоподібної залози на репродуктивну систему жінки / В.І. Паньків // Репродуктивна ендокринологія. — 2016. — № 1(27). — С. 52-57.
2. Redmond G.P. Thyroid dysfunction and women reproductive health // Thyroid. — 2004. — Vol. 14(1). — P. 5-15.
3. Apfelbaum M.E., Taleisnsk S. Influence of estrogen admi–nistration in vivo and in nitro on the release and synthesis of prolactin from incubated pituitaries // Acta Endocrinol. (Copenh). — 1997. — Vol. 87(4). — P. 714-721.
4. Kawabata W., Suzuki T., Moria T. et al. Estrogen receptors in Thyroid disorders: Possible in situ estrogen synthesis and actions // Mod. Pathol. — 2003. — Vol. 16(5). — P. 437-444.
5. Poppe K., Glinoer D., Tournaye H. Impact of ovarian hyperstimulation on thyroid function in women with and without thyroid autoimmunity // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89(8). — P. 3808-3812.
6. Пасєчко Н.В., Гнат С.В., Свистун І.І., Наумова Л.В. Вплив субклінічного гіпотиреозу на репродуктивну функцію у жінок та шляхи її корекції // Міжнародний ендокринологічний журнал. — 2015. — № 1(65). — С. 98-101.
7. Пашковська Н.В. Захворювання щитоподібної залози і вагітність // Міжнародний ендокринологічний журнал. — 2012. — № 8(48). — С. 78-82.
8. Haddow J.E., Cleary-Goldman J., McClain M.R. et al. Thyroperoxidase and thyroglobulin antibodies in early pregnancy and preterm delivery // Obstet. Gynecol. — 2010. — Vol. 116(1). — P. 58-62.
9. Krassas G.E., Poppe K., Glinoer D. Thyroid Function and Human Reproductive Health // Endocr. Rev. — 2010. — Vol. 31. — P. 702-55.
10. Lazarus J.H. Epidemiology and prevention of thyroid disease in pregnancy // Thyroid. — 2002. — Vol. 12(10). — P. 861-5.
11. Negro R., Schwartz A., Gismondi R. et al. Universal screening versus case finding for detection and treatment of thyroid hormonal dysfunction during pregnancy // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95(4). — P. 1699-707.
12. Patil-Sisodia K., Mestman J.H. Graves hyperthyroidism and pregnancy: a clinical update // Endocr. Pract. — 2010. — Vol. 16(1). — P. 118-29.
13. Stagnaro-Green A. Оptimal care of the pregnant woman with thyroid disease // J Clin. Endocrinol. Metab. — 2012. — Vol. 97(8). — P. 2619-22.
14. Stagnaro-Green А., Pearce E. Thyroid disorders in pregnancy // Nature Reviews Endocrinology. — 2012. — Vol. 8. — P. 650-8.
15. Yassa L., Marqusee E., Fawcett R. et al. Thyroid hormone early adjustment in pregnancy (the therapy) trial // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95(7). — P. 3234-41.
16. Agbajanova L., Lindeberg M., Carlsson I.B. Receptors for thyroid-stimulating hormone and thyroid hormones in human ovarian tissue // Reprod. Biomed. Online. — 2009. — Vol. 18(3). — P. 337-347.