Международный эндокринологический журнал Том 13, №3, 2017
Вернуться к номеру
Особливості фагоцитарної активності моноцитів та нейтрофілів у хворих на анкілозивний спондилоартрит з ожирінням залежно від носійcтва HLA B27-антигена
Авторы: Гаєвська В.Ю.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
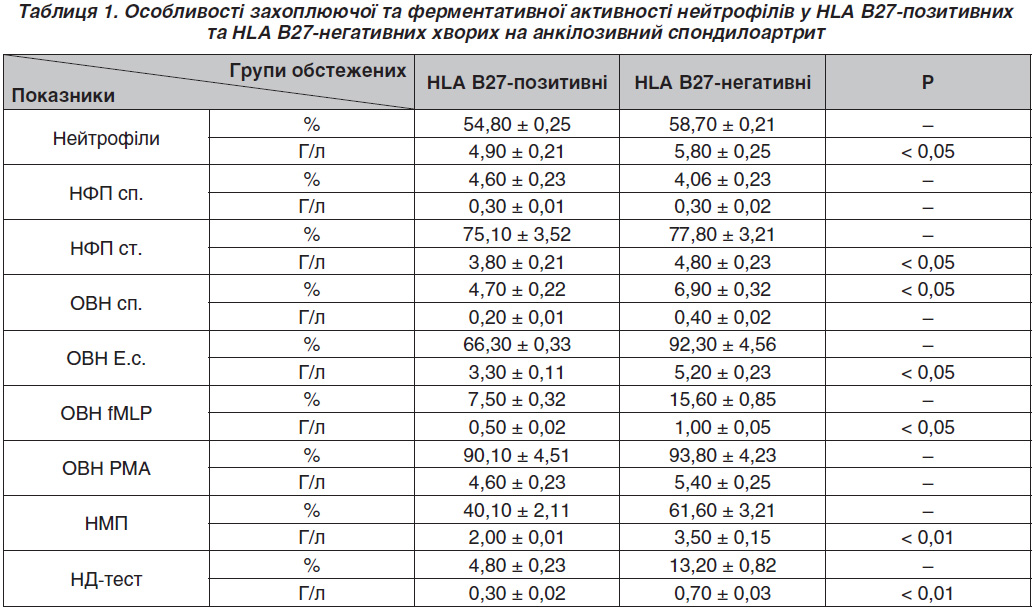
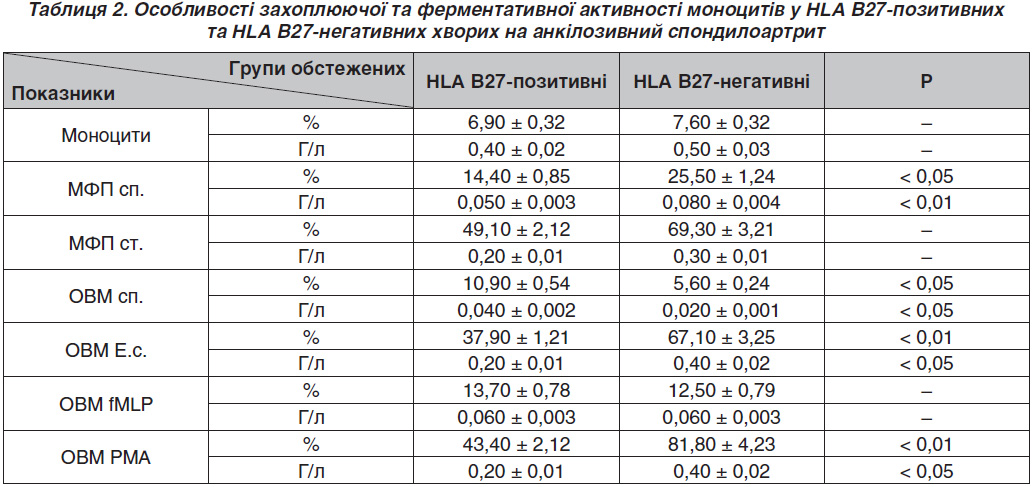
Актуальність. Анкілозивний спондилоартрит (АС, хвороба Бехтерева) — значно поширена патологія в усьому світі. Мета дослідження: установити взаємозв’язок між носійством гена HLA B27 та станом імунної системи у хворих на АС. Матеріали та методи. Під нашим спостереженням перебувало 68 хворих на АС з ожирінням. Усім пацієнтам були проведені загальнолабораторні та спеціальні для АС обстеження, що містили загальний аналіз крові з лейкоформулою (%, г/л), визначення швидкості осідання еритроцитів, рівня С-реактивного протеїну, протеїнограми, ревматоїдного фактора, ВІЛ-носійства, HCV- і HBV-специфічних антитіл та HLA B27-носійства. Результати. У хворих на АС спостерігається більш посилений оксидантний вибух при слабкій стимуляції. Установлені особливості вказують, що у хворих на АС досліджувані зміни функціональної активності фагоцитів є менш вираженими порівняно з полінуклеарними нейтрофілами і в основному страждає резервна слабостимульована їх окисно-відновна функція, що в них стимулюється. Вказані зміни можна охарактеризувати певними генетичними особливостями зміненої продукції окисно-відновних ферментів цими клітинами з включенням компенсаторних механізмів за рахунок спонтанного окисно-відновного вибуху. Висновки. У хворих на АС із носійством HLA B27-гена встановлено посилення спонтанного та фізіологічного оксидантного вибуху нейтрофілів та фізіологічного — моноцитів, що може слугувати раннім предиктором виникнення автоімунного процесу в організмі людини.
Актуальность. Анкилозирующий спондилоартрит (АС, болезнь Бехтерева) — широко распространенная патология во всем мире. Цель исследования: установить взаимосвязь между носительством гена HLA B27 и состоянием иммунной системы у больных АС. Материалы и методы. Под нашим наблюдением находились 68 больных АС с ожирением. Всем пациентам были проведены общелабораторные и специальные для АС обследования, содержащие общий анализ крови с лейкоформулой (%, г/л), определение скорости оседания эритроцитов, уровня С-реактивного протеина, протеинограммы, ревматоидного фактора, ВИЧ-носительства, HCV- и HBV-специфических антител и HLA B27-носительства. Результаты. У больных АС наблюдается более усиленный оксидантный взрыв при слабой стимуляции. Установленные особенности указывают на то, что у больных АС исследуемые изменения функциональной активности фагоцитов менее выражены по сравнению с полинуклеарными нейтрофилами и в основном страдает резервная слабостимулированная их окислительно-восстановительная функция, которая у них стимулируется. Указанные изменения можно охарактеризовать определенными генетическими особенностями измененной продукции окислительно-восстановительных ферментов этими клетками с включением компенсаторных механизмов за счет спонтанного окислительно-восстановительного взрыва. Выводы. У больных АС с носительством HLA B27-гена установлено усиление спонтанного и физиологического оксидантного взрыва нейтрофилов и физиологического — моноцитов, что может служить ранним предиктором возникновения аутоиммунного процесса в организме человека.
Background. Ankylosing spondylitis (AS) is a widespread pathology all over the world. The AS prevalence in different countries ranges from 0.2 to 2 %. Usually the disease debuts at the age of 20–40 years, men suffer from this pathology 6–9 times more often than women. Materials and methods. We observed 68 patients with acute stage. The general laboratory and AS-specific testing were done for all patents, namely clinical blood analysis with leucogram (%, g/l), ESR, C-reactive protein, proteingram, for HIV carrier, for HCV and HBV specific antibodies and HLA B27 carrie. Results. AS patients with HLAB27 antigene had enhanced spontaneous and physiologic output of neutrophils and physiologic output of monocytes. Conclusions. Oxidative output can serve as an early predictor of autoimunne process in human.
анкілозивний спондилоартрит; ожиріння; фагоцитарні показники; ген HLA B27; імунне запалення
анкилозирующий спондилоартрит; ожирение; фагоцитарные показатели; ген HLA B27; иммунное воспаление
ankylosing spondylitis; obesity; phagocytic indexes; antigene HLA B27; immune inflammation