Проблема цереброваскулярных заболеваний является одной из самых актуальных в современной медицине, что обусловлено высокими показателями смертности и инвалидизации вследствие этой патологии. В последние годы эксперты Всемирной организации здравоохранения прогнозируют рост сосудистой патологии мозга и ее осложнений, что связано с глобальным постарением населения планеты и распространением в популяции таких факторов риска, как артериальная гипертензия, гиперхолестеринемия, сахарный диабет, курение и т.д. Согласно статистике, ежегодно от 100 до 120 тыс. жителей Украины впервые заболевают мозговым инсультом; 35,5 % от всех мозговых инсультов происходит у людей трудоспособного возраста [1–5].
При этом особенность современного патоморфоза состоит в том, что цереброваскулярная патология часто сопровождается депрессивными расстройствами, которые усугубляют клиническую картину, значительно влияют на социальную и профессиональную деятельность и как следствие — на качество жизни пациента. Для депрессивных расстройств, развивающихся при цереброваскулярной патологии, характерны особенно неблагоприятные медико-социальные последствия [6–13].
Указанные расстройства развиваются у лиц старше 45 лет и характеризуются сложными коморбидными взаимоотношениями сосудистой и аффективной патологии, результатом чего являются анергия, выраженный когнитивный дефицит и прогрессирующее нарушение социального функционирования [11, 14–17].
Присоединение к цереброваскулярной патологии депрессивных расстройств создает сложности в диагностике и препятствует эффективности терапии. В связи с этим в последнее время активно исследуется возможность усиления эффективности терапии депрессивных и коморбидных им расстройств как на наиболее ранних стадиях цереброваскулярных заболеваний, так и в пожилом возрасте [18–23]. Исходя из современных представлений о патогенезе депрессивных расстройств, которые развиваются при дисциркуляторной энцефалопатии (ДЭ), весьма перспективным представляется применение препаратов, улучшающих пластичность мозговой ткани и обладающих нейротрофическими свойствами. Одним из препаратов, обладающих выраженным нейропластическим эффектом, является Церебролизин, мультимодальное нейротрофическое действие которого доказано в различных экспериментальных исследованиях, а клиническая эффективность и безопасность подтверждены результатами ряда рандомизированных двойных слепых плацебо-контролируемых клинических исследований [24–27].
С целью оценки эффективности применения препарата Церебролизин в комплексном лечении депрессивных расстройств у больных с ДЭ II стадии, обусловленной атеросклерозом, проведено обследование 84 пациентов обоих полов в возрасте от 47 до 68 лет (средний возраст — 57,63 ± 6,32 года) с диагнозом «депрессивное расстройство органического (сосудистого) генеза» в соответствии с критериями МКБ-10, находящихся на амбулаторном лечении в ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины».
Диагноз ДЭ II стадии атеросклеротического генеза устанавливали на основании жалоб больных, данных анамнеза, неврологического, психиатрического статусов и подтверждали результатами инструментальных (ядерно-магнитная резонансная томография головного мозга, ультразвуковая допплерография магистральных артерий головы, офтальмоскопия) и лабораторных (клинический анализ крови, клинический анализ мочи, анализ крови на уровень глюкозы, анализ крови на холестерин, липидный профиль) методов обследования.
В исследование включали пациентов, давших письменное информированное согласие на участие в исследовании.
В исследование не включали пациентов с выраженными двигательными и речевыми нарушениями, которые могли затруднить проведение нейропсихологического и электрофизиологического исследований, а также пациентов со значимым стенозированием сонных артерий (до 50 % просвета).
Все пациенты случайным образом были распределены в основную (48 пациентов) и контрольную (36 пациентов) группы лечения. Пациенты основной группы получали дополнительно к базовой терапии (витаминотерапия, вазоактивные средства, антидепрессанты) Церебролизин по 10 мл внутривенно (15 инъекций); пациенты контрольной группы — базовую терапию без использования Церебролизина. В качестве антидепрессивной терапии больные принимали антидепрессанты группы селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина.
Продолжительность лечения и наблюдения для каждого пациента составила 3 недели (21 день).
Все пациенты проходили комплексное клиническое обследование с оценкой соматического, неврологического, психоэмоционального состояния и когнитивного функционирования до и после курса лечения. Нейропсихологическое обследование включало оценку депрессивного состояния по оценочной шкале Гамильтона (HDRS) [28]; оценку функционирования различных когнитивных сфер (внимание и концентрация, исполнительные функции, память, речь, зрительно-конструктивные навыки, абстрактное мышление, счет и ориентация) по Монреальской шкале оценки когнитивных функций (МоСА) [19, 30]; диагностику параметров работоспособности по тесту Ландольта [31]; исследование качества жизни с помощью опросника Европейской группы качества жизни (EuroQol EQ-5D) [32]. Статистическую обработку полученных данных проводили с применением электронных таблиц Excel 97 и статистического пакета Statistica 6.0, с использованием параметрических и непараметрических методов анализа данных: t-теста и точного метода Фишера.
При оценке жалоб больных и данных неврологического статуса на исходном уровне до лечения среди наиболее часто встречающихся синдромов были выявлены цефалгический (87,5 % больных основной и 86,1 % больных контрольной группы), вестибуло–атактический (62,5 и 63,9 % соответственно), подкорковый (22,9 и 22,2 % соответственно) синдромы, экстрапирамидная недостаточность (27,1 и 25,0 % соответственно) и сенсорные расстройства (18,7 и 19,4 % соответственно).
В структуре психопатологических проявлений у всех обследуемых доминировала депрессивная симптоматика.
Депрессивные расстройства проявлялись преимущественно сниженным настроением (100 % пациентов обеих групп), апатией, снижением энергичности, ангедонией (87,5 % больных основной и 86,1 % больных контрольной группы), нарушениями сна (70,8 и 72,2 % соответственно), снижением аппетита (66,7 и 63,9 %), ипохондрическими переживаниями (81,3 и 77,8 % соответственно) и различными телесными неопределенными ощущениями («жжет», «печет», «сдавливает») (52,1 и 50,0 % соответственно), неопределенным чувством тревожности (66,7 и 63,9 % соответственно), структурно связанной с переживаниями о своем соматическом неблагополучии.
Неотъемлемой составляющей клинической картины у обследованных являлись когнитивные нарушения, проявляющиеся в субъективных жалобах на рассеянное внимание, снижение умственной работоспособности, ухудшение памяти, преимущественно фиксационного типа (100 % пациентов обеих групп); у 56,3 % больных основной и 55,6 % больных контрольной группы объективизировались также идеомоторная заторможенность, быстрая истощаемость, снижение беглости речи.
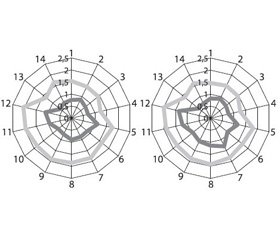
Основные субъективные жалобы больных были оценены в баллах (от 0 до 3) до и после проведенного лечения. Полученные профили, отражающие субъективные жалобы больных до и после проведенного лечения, представлены на рис. 1.
Полученные данные отражают идентичность субъективных жалоб больных сравниваемых групп до начала терапии как по представленности, так и по степени выраженности.
Наибольшую интенсивность имели такие симптомы, как снижение работоспособности (2,08 и 2,02 балла у больных основной и контрольной группы соответственно), слабость (1,98 и 1,92 балла соответственно), подавленность (1,92 и 1,88 балла), рассеянное внимание (1,88 и 1,94 балла), снижение памяти (1,86 и 1,84 балла), апатия (1,86 и 1,82 балла соответственно).
После проведенного лечения более выраженная позитивная динамика у больных основной группы отмечена по всем оцениваемым симптомам, особенно в оценке снижения памяти (0,88 балла у больных основной группы в сравнении с 1,32 балла у больных группы контроля, при p < 0,05), рассеянного внимания (0,92 и 1,16 балла соответственно), слабости (0,96 и 1,22 балла соответственно), снижения работоспособности (1,14 и 1,38 балла соответственно), подав–ленности (0,76 и 1,08 балла соответственно), апатии (0,72 и 0,96 балла соответственно).
Оценку психоэмоционального состояния больных проводили с использованием шкалы Гамильтона для оценки депрессивного состояния (HDRS).
До начала лечения суммарный балл по шкале HDRS у больных исследуемых групп был идентичным и находился в диапазоне от 12 до 18 баллов (средний балл в основной группе — 15,75, в контрольной — 15,55), что соответствовало легкому и среднему уровню депрессии.
Динамика выраженности депрессивной симптоматики по данным шкалы депрессии Гамильтона у обследованных в процессе терапии (рис. 2) такова: в процессе лечения депрессивная симптоматика уменьшалась у больных обеих групп: средний показатель шкалы HDRS на 21-й день лечения в основной группе составил 7,12 балла, в контрольной — 8,44 балла, что отражает уменьшение симптомов депрессии у больных обеих групп.
Отсутствие изменений в показателях депрессии по шкале HDRS под влиянием 21-дневной терапии в сравниваемых группах выявлено не было, что согласуется с динамикой показателей субъективных жалоб больных оцениваемых групп.
Вместе с тем регрессирование депрессивной симптоматики у больных основной группы было более выраженным (при p < 0,05), что свидетельствовало о лучшем ответе на лечение у больных депрессивным расстройством органического (сосудистого) генеза при дополнительном включении в терапию Церебролизина.
Рассматривая динамику показателей HDRS по отдельным пунктам, следует отметить, что у больных основной группы улучшение показателей депрессии по сравнению с группой контроля происходило преимущественно за счет пунктов «депрессивное настроение (подавленность, безнадежность, беспомощность, чувство собственной малоценности)» — с 1,43 до 0,74 балла при p < 0,04, «работоспособность и активность» — с 1,46 до 0,66 балла при p < 0,03, «заторможенность (замедленность мышления и речи, нарушение способности концентрировать внимание, снижение моторной активности)» — с 1,26 до 0,48 балла при p < 0,03, тогда как у больных контрольной группы динамика по данным пунктам шкалы HDRS была достоверно ниже.
Полученные данные демонстрируют также взаимосвязь выраженности депрессивной симптоматики у больных депрессивными состояниями органического (сосудистого) генеза обеих групп и соматического состояния больного и ипохондрической фиксации на нем (достоверно позитивная динамика в процессе терапии и редукция депрессии по пунктам шкал HDRS «общие соматические симптомы» (с 1,22 до 0,54 балла при p < 0,05 у больных основной группы и с 1,32 до 0,62 балла при p < 0,04 у больных группы контроля) и «ипохондрия» (с 1,42 до 0,58 балла при p < 0,02 у больных основной группы и с 1,28 по 0,54 балла при p < 0,04 у больных группы контроля)).
Анализ когнитивных функций больных на основании данных Монреальской шкалы (МоСА-test) продемонстрировал, что до начала лечения статистически значимых различий между больными основной и контрольной групп по общему уровню функционирования когнитивных процессов, а также по отдельным когнитивным функциям обнаружено не было.
В табл. 1 представлены усредненные значения показателей функционирования различных аспектов когнитивной деятельности, а также общий уровень когнитивного функционирования обследованных больных.
Как видно из приведенных данных, показатели обеих выборок по всем исследуемым параметрам были идентичны: больные характеризовались снижением функционирования когнитивных процессов (общий балл МоСА-теста в основной группе составил 24,75 ± 1,32, в контрольной — 24,80 ± 0,92, что меньше нормативного показателя на 26 баллов и отражает снижение функционирования когнитивных процессов).
После проведенного курсового лечения у пациентов основной группы отмечалось достоверное улучшение общего балла МоСА-теста — с 24,75 ± 1,32 до 26,80 ± 1,44 при p < 0,0347, что уже соответствовало нормативному уровню функционирования когнитивных процессов. Что касается показателей конкретных когнитивных функций у больных основной группы после проведенного лечения, то значительное улучшение отмечалось в сферах зрительно-пространственного праксиса (исполнительных функций) — с 4,20 ± 0,48 до 4,7 ± 0,4 балла при p < 0,0310; памяти (отсроченного воспроизведения) — с 3,7 ± 1,2 до 4,40 ± 0,85 балла при p < 0,0481 и внимания — с 4,3 ± 1,1 до 5,20 ± 0,87 балла при p < 0,0290.
У больных же контрольной группы отмечалось незначительное увеличение общего балла МоСА-теста — с 24,80 ± 0,92 до 25,50 ± 0,81, достоверно значимые различия не были обнаружены, а уровень функционирования когнитивных процессов так и не достигал нормативного. По отдельным показателям МоСА-теста у больных контрольной группы также не было обнаружено статистически значимых изменений по результатам лечения.
Исследование параметров работоспособности осуществляли с помощью методики «Кольца Ландольта». Полученные данные в сравнительном аспекте представлены в табл. 2.
Полученные результаты демонстрируют, что исходные (до начала лечения) параметры показателей работоспособности у больных исследуемых групп были идентичны и соответствовали среднему и ниже среднего уровню. По результатам лечения у больных обеих исследуемых групп отмечалось увеличение показателей скорости переработки информации (в основной группе — с 0,79 ± 0,22 до 0,89 ± 0,18 при p < 0,0325; в контрольной — с 0,77 ± 0,27 до 0,86 ± 0,20 при p < 0,0344), что свидетельствовало об улучшении функциональной по–движности нервной системы в процессе курса терапии.
При этом остальные показатели работоспособности у больных контрольной группы в результате лечения значимо не изменились, в то время как у больных основной группы достоверно возросли показатели точности (Аt) с 0,76 ± 0,14 до 0,89 ± 0,16 при p < 0,0387 и продуктивности (Pt) — с 157,63 ± 5,20 до 188,44 ± 4,70 при p < 0,0480. То есть у больных основной группы отмечалось повышение работоспо–собности за счет увеличения и скорости, и качества переработки информации, в то время как у больных контрольной группы значимо повышалась лишь скорость обработки данных.
На рис. 3 графически представлена динамика показателей продуктивности обследуемых больных в ходе выполнения деятельности (заданий по методике Ландольта). У больных обеих исследуемых групп до начала лечения кривая продуктивности деятельности характеризовалась незначительным повышением продуктивности в начале работы с постепенным ее снижением к концу выполнения задания ниже первоначального уровня, что свидетельствовало о нарастании признаков утомления.
/33-2.jpg )
После проведенного курса лечения у больных контрольной группы отмечалось увеличение показателей продуктивности с сохранением изначальной тенденции: нарастанием продуктивности в начале работы и ее снижением к концу деятельности. При этом у больных основной группы кривая продуктивности характеризовалась относительной стабильностью: повышение продуктивности стабилизировалось в ходе выполнения задания с достижением ее максимальных значений в середине работы и сохранением исходного уровня к концу выполнения задания, что свидетельствовало об отсутствии признаков утомляемости и стабильном уровне работоспособности.
Исследование качества жизни больных депрессивным расстройством органического (сосудистого) генеза обеих групп до и после 21-дневного лечения проводили с помощью опросника Европейской группы качества жизни (EQ-5D).
Данные по группам, полученные до и после лечения, при оценке 5 компонентов, связанных с такими аспектами жизни, как подвижность, самообслуживание, активность в повседневной жизни, боль/дискомфорт и беспокойство/депрессия, представлены графически в виде профиля состояния здоровья (рис. 4).
Согласно представленным данным, до начала лечения показатели по всем пяти компонентам в группах сравнения были идентичны.
Данные, полученные после проведенного 21-дневного лечения, демонстрируют наличие различий в показателях между сравниваемыми группами по всем компонентам опросника Европейской группы качества жизни: у больных основной группы отмечалась более выраженная позитивная динамика, особенно при оценке состояния собственного здоровья по шкалам «беспокойство/депрессия» (при p < 0,01), «активность в повседневной жизни» (при p < 0,05) и «подвижность» (при p < 0,05).
Использование при работе с опросником EuroQol EQ-5D визуально-аналоговой шкалы (так называемого термометра здоровья) позволило получить количественную оценку общего статуса здоровья больных и выявить динамику в самооценке больными состояния собственного здоровья в процессе терапии. Так, до лечения средние показатели в сравниваемых группах были сопоставимы и не имели достоверных различий (32 — у больных основной группы и 35 — у больных группы контроля), тогда как после проведенной терапии у больных основной группы наблюдалось достоверно более выраженное увеличение среднего показателя самооценки общего состояния их здоровья (84 — у больных основной группы и 62 — у больных контрольной группы, p < 0,01).
Результаты опросника EuroQol EQ-5D свидетельствуют, что в группе больных, принимавших дополнительно к терапии Церебролизин, прирост доли пациентов с восстановлением активности в повседневной жизни, подвижности, способности к самообслуживанию на фоне уменьшения депрессивных и болевых проявлений был более значительным, чем в группе контроля.
Таким образом, проведенное исследование продемонстрировало, что нейротрофическая терапия в виде внутривенного введения Церебролизина позитивно влияет на редукцию депрессивной симптоматики, улучшение когнитивных функций и качества жизни больных депрессивным расстройством органического (сосудистого) генеза.
Для определения конкретных симптомов-мишеней в структуре депрессивной симптоматики больных ДЭ II стадии сосудистого (атеросклеротического) генеза, в отношении которых нейротрофическая терапия оказалась наиболее эффективной, вычисляли средние значения разностей показателей до и после лечения (MD) по всем измеряемым в ходе обследования параметрам с дальнейшим сравнительным анализом полученных значений методом t-теста (t-test).
Полученные данные представлены в табл. 3, где отражены только статистически значимые (p < 0,05) признаки, которые в группах сравнения достоверно отличались и, собственно, являлись симптомами-мишенями. А представленные в табл. 3 показатели средних значений разностей (MD) являются показателями редукции симптомов.
/35-1.jpg )
Согласно полученным данным, симптомами-–мишенями, редукцию которых обеспечивает применение Церебролизина в комплексной терапии больных депрессивными расстройствами сосудистого (атеросклеротического) генеза, являются: в структуре депрессивной симптоматики — уменьшение уровня общей работоспособности/активности и заторможенность (замедленность мышления и речи, нарушение способности концентрировать внимание, снижение моторной активности); в структуре когнитивных нарушений — уменьшение уровня общего когнитивного функционирования, снижение памяти и концентрации внимания, точности и продуктивности деятельности; в структуре субъективного восприятия качества жизни — уменьшение уровня активности в повседневной жизни.
Результаты проведенного исследования показывают, что нейротрофическая терапия позитивно влияет на динамику депрессивных расстройств у больных ДЭ ІІ стадии сосудистого (атеросклеротического) генеза. При этом симптомами-мишенями являются уменьшение уровня общей работоспособности и активности, заторможенность (в структуре депрессивной симптоматики); уменьшение уровня общего когнитивного функционирования, снижение памяти и концентрации внимания, точности и продуктивности деятельности (в структуре когнитивных нарушений); уменьшение уровня активности в повседневной жизни (в структуре субъективного восприятия качества жизни).
В целом результаты проведенного исследования доказывают высокую эффективность применения Церебролизина в терапии больных депрессивными расстройствами органического (сосудистого) генеза за счет редукции когнитивного компонента депрессивных нарушений, повышения качества жизни и уровня функционирования больных, их активности и работоспособности, что определяет возможность и перспективность его применения у данной категории пациентов.
Конфликт интересов. Не заявлен.
Список литературы
1. Гусев Е.И. Когнитивные нарушения при цереброваскулярных заболеваниях / Е.И. Гусев, А.Н. Боголепова. — 3-е изд-е, доп. — М.: МЕДпресс-информ, 2013. — 176 с.
2. Нарушения кровообращения в головном и спинном мозге / Дамулин И.В., Парфенов В.А., Скоромец А.А., Яхно Н.Н. // Болезни нервной системы: Руководство для врачей. — Т. 1. — М.: Медицина, 2005. — С. 232-303.
3. Зозуля Ю.П. Проблеми судинно-церебральної патології та шляхи їх вирішення / Ю.П. Зозуля, Т.С. Міщенко // Журнал НАМН України. — 2011. — Т. 17, № 1. — С. 19-25.
4. Проблемы профилактики ишемии мозга у больных с сердечно-сосудистыми заболеваниями: взгляд невролога / Румянцева С.А., Федин А.И., Свищева С.П. и др. // Ліки України. — 2009. — № 9. — С. 72-76.
5. Ярынкина Е.А. Цереброваскулярная патология и профилактика инсульта у больных с артериальной гипертензией / Е.А. Ярынкина // Здоров’я України. — 2007. — № 2. — С. 18-19.
6. Вознесенская Т.Г. Депрессия в пожилом возрасте / Т.Г. Вознесенская // Consilium Medicum. — 2009. — 11(2). — С. 74-79.
7. Марута Н.О. Клініко-психопатологічні особливості депресій у осіб похилого віку / Марута Н.О., Панько Т.В., Череднякова О.С. // Міжнародний психіатричний, психотерапевтичний та психоаналітичний журнал. — 2008. — Т. 2. — № 1, 2(2, 3). — С. 24-27.
8. Марута Н.А. Особенности формирования аутоагрессии у больных депрессивным эпизодом пожилого возраста / Н.А. Марута, И.А. Явдак // Український вісник психоневрології. — 2010. — Т. 18, вип. 3(64). — С. 136-137.
9. Microstructural white matter abnormalities and remission of geriatric depression / Alexopoulos G.S., Murphy C.F., Gunning-Dixon F.M. et al. // Am. J. Psychiatry. — 2008. — 165. — 238-244.
10. Chen H. Trophic factors counteract elevated FGF-2-induced inhibition of adult neurogenesis / H. Chen // Neurobiol. of aging. — 2007. — 28(8). — 1148-62.
11. Structural brain abnormalities in major depressive disorder: A selective review of recent MRI studies / Lorenzetti V., Allen N.B., Fornito A. et al. // J. Affective Disorders. — 2009. — 117. — 1-17.
12. Depression in the elderly: does family system play a role? A cross-sectional study / Taqui A.M., Itrat A., Qidwai W., Qadri Z. // BMC Psychiat. — 2007. — 7. — 7-57.
13. The CANMAT task force recommendations for the management of patients with mood disorders and comorbid anxiety disorders / Schaffer A., McIntosh D., Goldstein B.I. et al.; Canadian Network for Mood and Anxiety Treatments (CANMAT) Task Force // Ann. Clin. Psychiatry. — 2012. — 24(1). — Р. 6-22.
14. Захаров В.В. Когнитивные расстройства в пожилом и старческом возрасте: Метод. пособ. для врачей / В.В. Захаров, Н.Н. Яхно. — М., 2005. — 71 с.
15. Is Vascular Cognitive Impairment the preclinical stage of Vascular Dementia: The Tajiri Project / Meguro K., Ishii H., Yamaguchi S. et al. // 2nd Congress of the International Society for Vascular Behavioural and Cognitive Disorders (Vas-Cog). Abstract book. — Florence, 2005. — P. 71.
16. Mild Cognitive Impairment of primary and vascular aetiology: AD and VaD in their preliminary stages? / Nordlung A., Rolstad S., Klang O. et al. // Ibid. — P. 33.
17. Rockwood K. Progression to dementia in patients with vascular cognitive impairment without dementia: a multi-centre clinical study / Rockwood K., Black S., Feldman H. // Ibid. — P. 105.
18. Круглов Л.С. Оптимизация терапии пожилых больных с коморбидностью депрессии и психоорганических нарушений сосудистого генеза / Л.С. Круглов, И.А. Мешандин // Психиатрия и психофармакотерапия. — 2012. — Т. 14, № 2. — С. 40-45.
19. Мешандин И.А. Динамика клинических характеристик и социального функционирования в процессе терапии больных позднего возраста с сочетанием депрессивного расстройства и психоорганических нарушений сосудистого генеза: Автореф. дис… канд. мед. наук / И.А. Мешандин. — СПб., 2012. — 194 с.
20. Depression in Parkinson disease — epidemiology, mechanisms and management / Aarsland D., Pahlhagen S., Ballard C.G., Svenningsson U.E. & P. // Nat. Rev. Neurol. — 2012. — 8. — 35-47.
21. Марута Н.А. Возможности антидепрессивной терапии в ХХІ веке // НейроNews. — 2008. — № 6(11). — С. 24-28.
22. Мосолов С.Н. Биологические механизмы развития рекуррентной депрессии и действия антидепрессантов: новые данные / С.Н. Мосолов // Психофармакотерапия депрессий. — 2011. — 15. — 1-14.
23. Кожина А.М. Терапевтические подходы к коррекции депрессивных расстройств / А.М. Кожина, Л.М. Гайчук // Психічне здоров’я. — 2007. — № 3(16). — С. 67-68.
24. Оптимизации психофармакотерапии эндогенных депрессий с помощью препарата Церебролизин / Пантелеева Г.П., Артюх В.В., Крылова Е.С. и др. // Психиатрия и психофармакотерапия. — 2012. — № 1.
25. Дамулин И.В. Влияние церебролизина на умеренные когнитивные расстройства / Дамулин И.В., Коберская Н.Н., Мхитрян Э.А. // Журнал неврологии и психиатрии. — 2007. — № 2. — С. 86-89.
26. Masliah E. The pharmacology of neurotrophic treatment with Cerebrolysin: brain protection and repair to counteract pathologies of acute and chronic neurological disorders / E. Masliah, E. Diez-Tejedor // Drugs of Today. — 2012. — 48(Supрl. A). — 3-24.
27. Чуканова Е.И. Церебролизин в лечении пациентов с синдромом мягкого когнитивного снижения / Е.И. Чуканова // Трудный пациент. — 2008. — № 6(2–3). — С. 3-6.
28. Hamilton M. Development of a rating scale for primary depressive illness / M. Hamilton // Br. G. Soc. Clin. Psychol. — 1967. — Vol. 6. — P. 278-296.
29. Cumming T.B. The Montreal cognitive assessment short cognitive evaluation in a large stroke trial / Cumming T.B., Bernhardt J., Linden T. // Stroke. — 2011. — 42. — 2642-2644.
30. Montreal cognitive assessment (MoCA). Version 7.1 [Electronic Resource]. — Mode of access: URL: http://mocatest.org/pdf_files/ test/MoCA-Test-English_7_1.pdf
31. Сысоев В.Н. Тест Э. Ландольта: диагностика работоспособности: Методическое руководство / В.Н. Сысоев. — СПб.: Иматон, 2003. — 31 с. — (Серия «Комплексное обеспечение психологической практики»).
32. Новик Н.А. Руководство по исследованию качества жизни в медицине / Н.А. Новик, Т.Н. Ионова. — М.: Олма-пресс, 2002. — 320 c.

/31-1.jpg )
/31-2.jpg )
/32-1.jpg )
/33-1.jpg )
/33-2.jpg )
/34-1.jpg )
/35-1.jpg )