Введение
Появление настоящей публикации продиктовано рядом моментов: во-первых, неудовлетворенностью уровнем интерпретации полученных данных у пациентов с эпилепсией, трактуемых с позиций предыдущей классификации, во-вторых, возможностью получения информации об эпилептическом мозге благодаря открытию Центра позитронно-эмиссионной томографии в Республике Беларусь. Появление данной технологии нейровизуализации приближает нас к пониманию патогенеза болезни за счет информации о структурно-метаболических процессах при ряде неврологических заболеваний.
Эпилепсия — это хроническое неврологическое заболевание, характеризующееся повторными приступами в результате чрезмерной активности нейронов в головном мозге. В настоящее время приблизительно 65 миллионов человек во всем мире страдают эпилепсией, около 40 % из них являются фармакорезистентными.
Важными для постановки клинического диагноза эпилепсии являются нейровизуализационные и нейрофизиологические критерии и заключение невролога, что определяет тактику лечебных мероприятий.
Раннее выявление заболевания имеет определенное значение в лечении пациентов с данной патологией. Современные неинвазивные методы для оценки структурно-функциональной локализации зоны поражения и фокуса эпилептогенеза включают электроэнцефалографию (ЭЭГ), магнитно-резонансную томографию (МРТ), однофотонную эмиссионную компьютерную томографию, совмещенную с компьютерной томографией (ОФЭКТ/КТ), и позитронно-эмиссионную томографию, совмещенную с компьютерной томографией (ПЭТ/КТ).
ЭЭГ представляет собой первый этап в диагностике эпилепсии и является важным первичным методом для дифференциации пароксизмальных состояний различного характера. Выявление характерных нарушений по данным ЭЭГ является достаточно специфичным и широко используется для диагностики эпилепсии. Однако важно понимать, что «нормальная» ЭЭГ не исключает диагноза эпилепсии. Однократная процедура записи ЭЭГ выявляет патологическую активность у 29–38 % взрослых пациентов, страдающих эпилепсией, при повторных регистрациях ЭЭГ эта цифра возрастает до 69–77 %. Чувствительность метода повышается за счет выполнения ЭЭГ вскоре после приступа либо после депривации сна.
Нейровизуализация является важным этапом диагностики эпилепсии, определения этиологического и синдромального диагноза, прогнозирования и тактики лечения, будучи незаменимым инструментом для дифференциации вещества мозга, желудочковой системы, субарахноидальных пространств и оболочек головного мозга.
Эпилепсия часто ассоциируется с различного рода структурными изменениями или метаболическими поражениями головного мозга. Современный неврологический подход в диагностике патологических изменений, лежащих в основе эпилепсии, зачастую основывается на информации, полученной с помощью различных методов нейровизуализации.
Современные опции позволяют более определенно локализовать морфологические изменения головного мозга, обосновать особенности формирования эпилептогенного очага, роли локальной деструкции и состояния неспецифических систем мозга.
МРТ, являясь золотым стандартом оценки поражения головного мозга, демонстрирует высокий диагностический эффект при выявлении общих патологических очагов у пациентов с фокальными приступами, включая мезиальный темпоральный склероз, сосудистые аномалии, глиальные новообразования и пороки развития коры головного мозга [1, 2].
Главной проблемой в оценке пациента, страдающего эпилепсией, является корректная идентификация области начала приступа, особенно при наличии негативных МР-данных. Биоэлектрические изменения, происходящие в зоне очагового поражения, ассоци–ируются с изменениями перфузии и метаболизма в зоне областей начала приступа.
ОФЭКТ успешно применяется с целью определения изменения регионального церебрального кровотока. Использование ОФЭКТ при эпилепсии связано с необходимостью установления корреляции приступов с повышенной иктальной региональной перфузией или уменьшением межприступной перфузии головного мозга. Многочисленные исследования с использованием динамических и статических ОФЭКТ продемонстрировали наличие межприступной временной гипоперфузии головного мозга примерно у 50 % пациентов с верифицированной височной эпилепсией. Тем не менее у 5–10 % обследуемых наблюдается гипоперфузия в противоположной височной области, что увеличивает возможность ложной латерализации. Интериктальное сканирование может быть использовано в качестве базового исследования для сравнения с иктальным или постиктальным состоянием (рис. 1).
Пациентам с первично выявленными приступами обычно необходима срочная визуализация для исключения критической причины, например субдуральной гематомы, которая может потребовать специфического вмешательства. Существуют специальные протоколы для оценки структурных поражений у пациентов с генерализованными судорогами.
Основными процессами, приводящими к возникновению приступов, являются мезиальный височный склероз, пороки развития коры, очаговая энцефаломаляция, первичные опухоли головного мозга, сосудистые мальформации и нейроцистицеркоз.
Роль нейровизуализации важна для определения локуса, генерирующего патологическую активность у пациентов с неуточненной эпилепсией. МРТ решает ряд задач, включая выявление причинного очагового поражения и диагностику характера процесса. У значительного числа пациентов с эпилепсией результаты МРТ являются нормальными или трактуются как неопределенные. Для пациентов с фармакорезистентной фокальной эпилепсией необходимы функциональные методы нейровизуализации, такие как позитронно-эмиссионная томография c 18F-фтордезоксиглюкозой (ФДГ-ПЭТ), иктальная ОФЭКТ или функциональная МРТ, особенно в случаях отрицательных результатов рутинной МРТ [2, 4].
В настоящее время ПЭТ-КТ является действующим клиническим стандартом в крупных неврологических центрах. Использование ПЭТ-МРТ при эпилепсии продолжает активно изучаться. Сочетание высоких тканевых характеристик МРТ головного мозга с получением метаболической информации может способствовать уточнению локализации зоны эпилептогенеза.
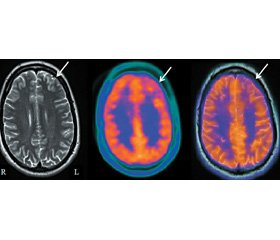
ПЭТ-нейровизуализация предоставляет широкий спектр функциональной и метаболической информации для понимания механизмов ряда неврологических заболеваний и выбора терапевтических стратегий. ПЭТ наиболее эффективна у пациентов с эпилепсией, которые являются кандидатами для хирургического лечения. В большинстве случаев используют ФДГ для исследования в межприступном периоде. При височной эпилепсии интериктальные исследования уточняют гипометаболические области в эпилептогенных регионах примерно у 70–80 % пациентов. Изменения при этом более обширны, чем ЭЭГ-нарушения, и показывают вовлечение также различных ипсилатеральных отделов других областей. В случаях отрицательных результатов МРТ выполнение ПЭТ может оказаться решающим в определении локального патологического процесса (рис. 2).
/113-1.jpg )
Соотношение гипометаболизма в ипсилатеральном регионе оказалось значительно выше, чем с контралатеральной стороны, в группе пациентов с благоприятным исходом после оперативного лечения. Наиболее надежным прогностическим фактором был гипометаболизм гиппокампа и миндалины, причем у пациентов с дискордантным предоперационным обследованием не обнаружены значимые латерализованные изменения. Тем не менее в случаях, когда пациенты имеют значительно высокий уровень соотношения гипометаболизма в мезиальном отделе височной доли, можно прогнозировать хороший результат хирургического лечения. Разница гипометаболизма у пациентов, которым проведена селективная амигдалогиппокампэктомия либо передняя височная лобэктомия, не влияла на положительный исход оперативного лечения. Наличие определенного значительного гипометаболизма в мезиальных отделах височной доли на ФДГ-ПЭТ с 3D-SSP является полезным для прогнозирования хорошего хирургического результата у дискордантных пациентов с мезиальным темпоральным склерозом [5].
Главной проблемой в обследовании является правильная идентификация очага эпилептогенеза, особенно у пациентов с негативными МР-данными. В связи с этим сопоставление данных ASL-перфузии (arterial spin labeling) и метаболизма 18F-ФДГ, полученных при ПЭТ/МРТ, раскрывает высокую корреляцию между гипометаболизмом и гипоперфузией в одной и той же зоне мозга у большинства пациентов. При одновременном получении этих данных отмечается надежное соответствие по латерализации фокуса и хорошей корреляции очаговых изменений, что дает полезную дополнительную информацию для дальнейшей тактики ведения пациента [6].
Целью нашего исследования были определение возможностей 18F-ФДГ-ПЭТ/КТ для латерализации и локализации очага при височной и вневисочной эпилепсии и картирование функционально значимых зон мозга у данной категории пациентов.
18F-ФДГ-ПЭТ/КТ головного мозга позволяет оценивать его анатомию и визуализировать структурные нарушения, которые могут быть результатом различных неврологических заболеваний.
В настоящее время основными показаниями для проведения нейровизуализации в центре являются два основных направления — нейроонкология и неврологические заболевания:
— нейроонкология — первичные новообразования головного мозга, метастатическое поражение головного мозга и оболочек, дифференциальная диагностика опухолевых и неопухолевых поражений;
— неврология — нейродегенеративные заболевания головного мозга — деменции, болезнь Альцгеймера, паркинсонизм и др., эпилепсия, неопухолевые процессы — демиелинизирующие и цереброваскулярные заболевания.
Основным радиофармпрепаратом, используемым в центре, является 18F-ФДГ. С химической точки зрения 18F-ФДГ — это аналог природной глюкозы, который позволяет оценивать гликолитическую активность тканей. При внутривенном введении 18F-ФДГ интенсивно накапливается в органах и тканях, в которых активно протекает процесс гликолиза (головной мозг, миокард, желудок, кишечник, печень и мышцы). Данный препарат имеет определенные достоинства и недостатки при проведении ПЭТ/КТ у пациентов с эпилепсией (табл. 1).
18F-ФДГ-ПЭТ/КТ реализовывалась на основе статистического анализа с использованием трехмерной стереотаксической проекции поверхности (3D-SSP) на рабочей станции ADW4.6 с применением программного пакета CortexID. Одновременно анализировались клинические данные, результаты МРТ и электроэнцефалографии.
CortexID представляет собой специализированное программное приложение, которое позволяет получить точные количественные результаты метаболической активности головного мозга. CortexID обеспечивает легкий, надежный анализ данных ПЭТ/КТ за счет сопоставления полученных изображений с изображениями из стратифицированных по возрасту нормалей и групп пациентов, выявляя функционально пораженные участки головного мозга, которые могут быть изменены патологическими процессами, т.е. в системе имеются данные ПЭТ группы контроля, что упрощает проведение сопоставления полученной информации.
CortexID позволяет проводить автоматизированный количественный анализ поглощения 18F-ФДГ и сравнение с соответствующим поглощением 18F-ФДГ у нормальных субъектов на основе визуализации объемов интереса (VOI), воксельных карт или трехмерных стереотаксических поверхностных проекционных карт мозга. Пакет позволяет пользователю генерировать информацию об относительных изменениях метаболизма глюкозы по данным 18F-ФДГ-ПЭТ/КТ. CortexID облегчает интерпретацию ПЭТ-данных и является дополнением к другим диагностическим методикам (рис. 3, 4).
Предлагаемый способ анализа метаболической активности с помощью программного пакета CortexID состоит из следующих этапов:
— анатомическая стандартизация набора ПЭТ- и КТ-данных пациента методом стереотаксической трансформации;
— извлечение данных кортикальной метаболической активности;
— нормализация полученных данных в сопоставлении с таламической активностью;
— вычисление Z-счета у конкретного пациента по сравнению с данными группы сравнения;
— расчет разницы Z-счета снижения метаболической активности ассоциативной коры по отношению к сенсомоторной коре;
— представление данных в виде трехмерной модели головного мозга.
Материалы и методы
Обследовано 42 пациента (25 мужчин и 17 женщин, возраст которых составил 33 ± 11 лет), страдающих эпилепсией с фармакорезистентным течением, с применением следующих методов: МРТ головного мозга, 18F-ФДГ-ПЭТ/КТ, ЭЭГ и ЭЭГ-картирования. Время проведения ПЭТ/КТ с момента последнего приступа составляло от 3 до 14 дней.
Критериями включения пациентов с эпилепсией в исследование были: фармакорезистентная эпилепсия, отсутствие определенных структурных изменений по данным МРТ и наличие локализованной эпилептической активности по данным ЭЭГ.
Исследование проводилось на ПЭТ/КТ-томографах GE Discovery 710 и Discovery IQ. Радиофармпрепарат вводится с помощью автоматизированной инъекторной системы дозирования (Karl 100 или Medrad Intego); активность 18F-ФДГ составляла 200 ± 20 МБк. Исследование выполнялось через 50–60 минут после введения радиофармпрепарата. Общая длительность ПЭТ/КТ-исследования составляет около 10–12 минут. При проведении КТ-сканирования выбирается диагностический алгоритм сканирования. Лучевая нагрузка на пациента составляет 3–5 мЗв.
Обязательными требованиями перед проведением ПЭТ/КТ головного мозга являются определение уровня гликемии экспресс-методом (требуется не более 8 ммоль/л) и наличие МРТ головного мозга для последующего сопоставления данных ПЭТ/КТ и МРТ (fusion) — получения последовательной совмещенной ПЭТ с МРТ.
Анализ полученных результатов ПЭТ/КТ проводился на основе визуальной оценки изображений и оценки статистических данных для определения очагов гипометаболизма или аномалий метаболической активности независимо двумя врачами — врачом-рентгенологом и врачом радионуклидной диагностики (обеспечивается двойное прочтение). В случае наличия разночтений при первичном прочтении обеспечивается чтение данных ПЭТ/КТ заведующим отделением.
Результаты и обсуждение
Для подтверждения наличия метаболических аномалий у пациентов с эпилепсией анализировалась региональная метаболическая активность с использованием 18F-ФДГ-ПЭТ/КТ в лобной, височной, теменной и затылочной долях, мозжечке, продолговатом мозге, базальных ядрах.
Стереотаксическая анатомическая стандартизация метаболической активности головного мозга на индивидуальном наборе изображений ПЭТ с помощью CortexID определяется в наборе предопределенных поверхностных пикселей (трехмерная стереотаксическая проекция поверхности, 3D-SSP). База данных ПЭТ/КТ сканера группы контроля создается путем использования усредненных данных обычных субъектов (обеспечено компанией-производителем). Наборы ПЭТ-данных пациентов сравнивались индивидуально с обычной базой данных путем вычисления Z-счета по пиксельной основе и отображались в виде 3D-SSP-анализа для визуального просмотра.
У 21 пациента из 42 (в 50 % случаев) визуально обнаружены очаги гипометаболизма в височной (преимущественно), а также теменной и лобной долях полушарий головного мозга. Выявленные фокусы и зоны гипометаболизма, как правило, соответствовали эпилептогенному очагу, выявляемому по данным ЭЭГ-картирования. Подтвержденное снижение уровня метаболизма 18F-ФДГ количественно определялось в корковых структурах височных долей головного мозга по данным 3D-SSP-анализа.
При оценке 18F-ФДГ-ПЭТ/КТ с помощью программного пакета CortexID дополнительно констатировались гипометаболизм и зоны асимметрии метаболической активности у 8 из 42 пациентов (в 19 % случаев), которые не были выявлены при стандартной визуальной оценке. Это свидетельствует о важности проведения 3D-SSP-анализа у пациентов с эпилепсией как более детальной и объективной методики, оценивающей состояние головного мозга (повышение диагностической значимости в сравнении с общей группой исследуемых пациентов).
При сравнении гипометаболических фокусов и областей, визуально и статистически выявленных на 18F-ФДГ-ПЭТ/КТ, локализация эпилептического очага по данным рутинной ЭЭГ была сопоставима у 16 из 42 пациентов, а по данным ЭЭГ-картирования — у 20 из 42 пациентов. В 31 % случаев (у 13 из 42 пациентов) отсутствовали достоверные признаки патологической метаболической активности головного мозга.
После нормализации данных по таламической активности симметрия метаболизма 18F-ФДГ височной, лобной, теменной и затылочной ассоциации коры были сохранены.
Благодаря оценке метаболической активности различных участков головного мозга ПЭТ/КТ предоставляет возможность функционального определения состояния ряда структур и позволяет идентифицировать область мозга, генерирующую эпилептическую активность, т.е. выявлять эпилептический очаг. Вместе с тем более достоверное определение эпилептогенной зоны требует комплексного использования разнообразных диагностических методов (ЭЭГ-картирование, МРТ, ПЭТ/КТ и др.).
С позиции невролога и эпилептолога существует основная задача оценки получаемых результатов для решения конкретной определенной тактики дальнейшего ведения пациента. Для достижения данных целей диагностические алгоритмы должны быть адаптированы прежде всего к нуждам пациента. Сопоставление данных, полученных разными методами исследования, требует комплексной оценки, поскольку патологические изменения, связанные с эпилепсией, иногда являются неоднозначными или неопределенными. Совокупное использование данных различных модальностей позволяет повысить диагностическую точность и эффективность использования каждой модальности в отдельности.
Отсутствие аномалий метаболической активности головного мозга у пациентов с эпилепсией можно связать со сроками проведения ПЭТ/КТ в отношении реализации последнего эпилептического приступа.
Выводы
В настоящее время 18F-ФДГ-ПЭТ/КТ головного мозга является важным компонентом диагностических алгоритмов у пациентов с эпилепсией и другими опухолевыми и неопухолевыми поражениями. Важно отметить, что совокупная оценка данных 18F-ФДГ-ПЭТ/КТ с результатами других методов исследования повышает точность диагностики, так как особенностью патогенеза эпилепсии являются динамические изменения, происходящие в разных структурах мозга.
Высокая актуальность изучаемой проблемы определяет необходимость определения диагностических возможностей 18F-ФДГ-ПЭТ/КТ головного мозга у пациентов с эпилепсией и другими формами заболеваний психоневрологического профиля.
Выявленные очаги гипометаболизма 18F-ФДГ могут рассматриваться как функциональная недостаточность и являться относительным показанием для повышения интегративного контроля мозга с помощью методов нейромодуляции или фармакологической коррекции.
Полученные результаты 18F-ФДГ-ПЭТ/КТ у пациентов с эпилепсией нередко свидетельствуют об отсутствии гипер- и гипометаболических очагов, что обусловлено проведением исследования в межприступном периоде. В настоящее время актуальна проблема выбора единого протокола сканирования и обработки результатов, а также стандартной процедуры сопоставления информативности различных методов анализа ПЭТ-изображений для унификации получаемых данных.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/113-1.jpg )
/114-1.jpg )
/114-2.jpg )