Мигрень является одним из наиболее распространенных и социально значимых заболеваний, внимание к которому в последнее время возросло не только среди неврологов, но и среди терапевтов, кардиологов, семейных докторов и врачей других специальностей. Как известно, мигрень встречается чаще, чем некоторые тяжелые хронические заболевания, такие как сахарный диабет и бронхиальная астма. Считается, что в среднем около 12 % населения в мире страдают мигренью [13, 14]. Это первичная эпизодическая форма головной боли (ГБ), которая проявляется интенсивными, чаще односторонними приступообразными ГБ, а также различным сочетанием неврологических, желудочно-кишечных и вегетативных симптомов. При этом мигрень — комплексное заболевание с гетерогенной клинической картиной, которое плохо диагностируется и лечится во всех странах мира, влияет на качество жизни пациентов, социальные и семейные отношения, приводит к серьезным прямым и косвенным экономическим потерям [1]. Ее распространенность в странах Европы и США колеблется у женщин от 11 до 25 %, у мужчин — от 4 до 10 % [3, 15, 38]. 92 % женщин и 89 % мужчин, которые страдают мигренью, испытывают сложности в повседневной жизни, а половина из них вынуждены находиться в постели в связи с тяжелыми приступами ГБ. Среди пациентов с мигренью 78 % отмечают затруднения в выполнении профессиональных обязанностей, 67 % указывают на ограничение участия в семейных делах, у 59 % больных данное заболевание существенно нарушает проведение досуга [4, 15, 16]. В 2000 году мигрень была включена в список болезней, имеющих глобальное значение и представляющих бремя для человечества (Global Burden of Disease, 2000), что обусловлено как широкой ее распространенностью, так и значимым влиянием на качество жизни больных. По данным Всемирной организации здравоохранения (ВОЗ), мигрень входит в двадцатку причин, которые в наибольшей степени нарушают социальную адаптацию пациентов [7, 14]. Глобальный обзор бремени заболеваний показал, что мигрень занимает шестое место среди специфических причин нетрудоспособности, первое — среди неврологических заболеваний по итогам 2015 года. Также по данным последнего Глобального обзора, опубликованного в 2016 году [30], мигренью страдает около одного миллиарда жителей планеты.
Пациенты с мигренью характеризуются вариабельностью частоты, длительности и интенсивности мигренозных приступов, широким спектром ведущих клинических проявлений, а также наличием специфических для каждого пациента провоцирующих факторов, среди которых у женщин ведущим является менструация [5, 7, 20, 22, 23]. Гормональные изменения, связанные с менархе, беременностью, лактацией и менопаузой, сопровождаются изменением паттернов и частоты приступов мигрени. Женские половые гормоны определяют строгие корреляции между частотой головной боли и менструальным циклом. Мигренозная головная боль впервые возникает в возрасте от 7 до 20 лет. Известно, что до пубертата мигрень больше распространена среди мальчиков, чем среди девочек [5, 16]. Начало мигренозных атак с менархе имеет место у одной шестой части девушек. Распространенность мигрени у девочек растет быстрее, в конце второго десятилетия жизни частота мигрени у девушек превышает таковую среди юношей и остается значительно более высокой у женщин, чем у мужчин, даже после 50 лет [10, 21]. В возрасте 35–45 лет частота и интенсивность мигренозных приступов достигают максимума, после 55–60 лет у большинства пациентов мигрень прекращается. В то же время у некоторых пациентов типичные приступы сохраняются и после 50 лет [5, 10, 16, 21]. Наибольшие различия распространенности мигрени среди мужчин и женщин достигаются в репродуктивном возрасте. Это касается и различной представленности двух основных форм мигрени у мужчин и женщин: так, при общем доминировании мигрени без ауры у женщин она встречается у 11 % в популяции (мигрень с аурой — в 5 %), в мужской популяции, напротив, несколько доминирует мигрень с аурой (3 %), а мигрень без ауры встречается с частотой 2 %. Около 60 % менструирующих женщин с мигренью испытывают четкую связь между мигренью и началом менструации. Установлено, что резкое падение уровня эстрогенов, предшествующее менструации, является ключевым фактором инициации приступов мигрени. Многочисленные клинические и экспериментальные исследования показали, что высокие уровни эстрогенов коррелируют с более высокой болевой толерантностью. Получены данные снижения болевых порогов во время пременструальной и менструальной фазы цикла. Перименструальное снижение болевых порогов отмечается и у женщин, использующих оральные контрацептивы [5, 20, 22, 23, 37, 39].
В недавно завершенном исследовании особенностей течения мигрени у пациентов старшей группы показано, что с возрастом происходит изменение типичного клинического паттерна в виде урежения приступов, появления эпизодов мигренозной ауры без головной боли, снижения частоты продромальных признаков, односторонней локализации, пульсирующего характера боли и рвоты в приступе, увеличения частоты сопровождающих приступ вегетативных симптомов и тяжести состояния [10, 21]. В то же время у некоторых пациентов мигрень после 50 лет не только не прекращается, но и может приобретать более агрессивное течение. Одним из предикторов персистенции мигрени в старшем возрасте являются частые приступы в начальном периоде заболевания. Сравнительное исследование лиц молодого и старшего возраста с использованием метода зрительных вызванных потенциалов позволило предположить, что возможной предпосылкой сохранения и персистирования мигрени в старшем возрасте является сохраняющаяся повышенная возбудимость коры головного мозга, которая характерна для пациентов с мигренью. Напротив, нормализация нейрофизиологических показателей при полном регрессе мигрени говорит о том, что корковая возбудимость мозга служит основой для прекращения мигрени [20, 21]. Следовательно, наступление климакса (возрастная стабилизация гормонального фона) нельзя рассматривать как основной фактор, определяющий прекращение мигрени в старшем возрасте [16, 20].
Долгое время симптомы мигрени связывали исключительно с изменением тонуса сосудов: ауру — с сужением внутримозговых артерий, боль — с расширением артерий твердой мозговой оболочки. В настоящее время известно, что важнейшим механизмом, запускающим приступ мигрени, обусловливающим развитие и сохранение боли, является активация тригеминоваскулярной системы (ТВС), которая рассматривается как ключевая система реализации болевой фазы приступа. Другие компоненты патофизиологии боли при мигрени включают нейрогенное воспаление с вазодилатацией интракраниальных сосудов, в первую очередь сосудов твердой мозговой оболочки (ТМО), а также экстравазацию — выделение болевых нейропептидов (кальцитонин-ген-родственного пептида — КГРП, оксида азота, гистамина). Механизм активации ТВС связывают с повышенной возбудимостью коры головного мозга у пациентов с мигренью. Многочисленные клинические наблюдения и электрофизиологические исследования подтверждают концепцию центральной гипервозбудимости как базового патофизиологического феномена, предполагающего наличие определенного мигренозного порога. Этот порог может быть преодолен под воздействием целого комплекса эндогенных и экзогенных провоцирующих факторов, мигренозные триггеры являются лишь одним из них [4, 12, 16, 19, 21, 31, 32, 40]. Показано также, что у пациентов с частыми приступами (более трех в месяц) и длительно болеющих развивается избыточная чувствительность тригеминоваскулярных волокон и других болевых структур. Феномен центральной сенситизации, клинически проявляющийся симптомами кожной аллодинии и тесно связанный с повышенной нейрональной возбудимостью, лежит в основе хронизации мигрени [2]. В инициации приступа мигрени важную роль играет активация серотонинергических нейронов ядер шва. Она, возможно, инициирует волну функциональной инактивации нейронов коры, которая предположительно является базой ауры. Эта волна корковой депрессии движется от затылочной коры кпереди и сопровождается вторичным снижением кровотока [27, 28, 31, 32]. Таким образом, приступ мигрени сопровождается расширением сосудов твердой мозговой оболочки, в иннервации которых участвуют волокна тройничного нерва (ВТН). Вазодилатация и ощущение боли во время приступа мигрени обусловлены выделением из окончаний ВТН болевых нейропептидов-вазодилататоров, важнейшим из которых является пептид, связанный с геном кальцитонина. По данным последних исследований, механизм такой активации связан с тем, что у пациентов имеется повышенная чувствительность ВТН, с одной стороны, и повышенная возбудимость коры головного мозга — с другой. Патофизиологические механизмы мигрени связаны с развитием асептического нейрогенного воспаления, высвобождением простагландина Е2 (ПГЕ2) и оксида азота, которые оказывают непосредственное влияние на периваскулярные ноцицепторы [31, 32, 40]. Дилатация церебральных и менингеальных артерий при приступе мигрени подтверждается исследованиями с использованием магнитно-резонансной ангиографии с величиной магнитной индукции сканера 3Т [33].
В настоящее время продолжается изучение патогенеза мигрени. Так, в 2010 году две независимые группы ученых идентифицировали различные генетические аномалии, связанные с часто встречающимися формами мигрени. Каждое из этих генетических нарушений приводит к изменению клеточной возбудимости в нервной системе. Это является подтверждением того, что мигрень — заболевание, обусловленное нарушением возбудимости мозга [11]. Генетическая предрасположенность к мигрени известна более 200 лет [16, 38]. Это заболевание, при котором часто прослеживаются генетически обусловленные нарушения в нервной, сосудистой и эндокринной системах. Строго наследственными считаются только редкие формы семейной гемиплегической мигрени, для которых выявлены специфические генные мутации [2, 15, 16, 23, 38]. Для самых распространенных форм мигрени семейный анамнез заболевания выявляется примерно у 40 % мужчин и 50 % женщин [38]. При этом известно, что семейные случаи в большей степени характерны для мигрени с аурой. Риск развития этой формы у родственников первой линии выше в четыре раза, тогда как при мигрени без ауры он сравним с таковым в популяции. В последние годы накоплены данные о роли генетических факторов в развитии коморбидных нарушений, зависимости от обезболивающих препаратов, а также хронизации мигрени [1, 2, 15, 16, 23, 38]. Показано, что мигрень является генетически обусловленным нейрососудистым заболеванием [1, 8, 16, 23, 24, 34, 38, 40].
В настоящее время во всем мире уделяется большое внимание изучению социально значимой медицинской проблемы — коморбидности различных заболеваний. Тот факт, что мигрень, являясь отдельной нозологической формой, часто сочетается с эпилепсией, депрессией, тревогой, вестибулярной дисфункцией и в значительной степени нарушает социальную адаптацию, качество жизни в целом, объясняет растущий интерес к проблеме коморбидности мигрени [13, 29]. Известна коморбидность мигрени с артериальной гипотензией, желчнокаменной болезнью, краниовертебральной аномалией, депрессией, астенией, эпилепсией, подтвержден факт ассоциации мигрени с инфарктом мозга. Многочисленные исследования показали, что пациенты с мигренью имеют повышенный риск сосудистых заболеваний [8, 11, 13, 26, 35, 37]. Первой была обнаружена связь между мигренью и инфарктом мозга. Впоследствии была продемонстрирована ассоциация мигрени с кардиоваскулярной смертностью, инфарктом миокарда, геморрагическим инсультом, ретинопатией и болезнью периферических артерий. Показано, что у лиц, которые перенесли инсульт до 50 лет, связь с мигренью прослеживается в 1–17 % случаев [16, 23]. Получены данные, предполагающие возможную роль повторяющихся приступов мигрени в формировании эндотелиальной дисфункции, которая характеризуется провоспалительными, пролиферативными, прокоагулянтными процессами, ускоряющими все стадии атерогенеза, усиливающими патологический воспалительный ответ. С увеличением риска развития инсульта ассоциирована и гипергомоцистеинемия (ГГЦ) при мигрени. Доказано, что ГГЦ приводит к сенсибилизации церебральных сосудов, изменяет резистентность эндотелия, сопровождается активацией внутрисосудистого свертывания, гиперкоагуляцией. К тому же эти изменения могут предшествовать структурным повреждениям [24, 34]. Описаны изменения сигнального пути оксида азота, а также повышение уровня пептида, связанного с геном кальцитонина (CGRP), повышение уровня сосудистого эндотелиального фактора роста (VEGF), активности фактора фон Виллебранда (vWF), антигена активатора тканевого плазминогена, С-реактивного белка и эндотелина-1 [23, 24, 29, 31, 32, 39]. Результаты проведенного систематического обзора указывают на наличие периферической сосудистой дисфункции, повышенной жесткости и нарушенного комплайенса артериальной системы у пациентов с мигренью. Кроме того, жесткость артерий у больных с мигренью, возможно, имеет гендерные различия (у женщин мигрень встречается в 3 раза чаще, что отражает влияние эстрогена). Маркером будущих сосудистых событий у больных мигренью считаются повышенный симпатический тонус, применение антимигренозных сосудосуживающих средств, изменения структуры сосудистой стенки, что подтверждается нарушенной активностью сывороточной эластазы. В настоящее время не установлено, влияют ли длительность мигрени и тяжесть приступов на жесткость артерий [18]. Изучались также риск возникновения мигренозного инсульта и локализация очага при различных формах заболевания и разной частоте приступов. Проведено большое кросс-секционное популяционное нейровизуализационное исследование трех групп пациентов (мигрень с аурой, мигрень без ауры и здоровые лица) в возрасте 30–60 лет, рандомизированных по полу и возрасту. Анализ подгрупп, выделенных по принципу локализации нейровизуализационных изменений, показал, что пациенты с мигренью имели более высокую частоту «немых» инфарктов в заднем сосудистом бассейне (5,4 и 0,7 % соответственно). Частота инфарктов этой локализации была еще выше (в 13,7 раза) при мигрени с аурой по сравнению с отсутствием мигрени. У пациентов с мигренью при чаcтоте приступов 1 и более раз в месяц этот показатель был выше в 9,3 раза. Наиболее высоким риск ишемического инсульта был при мигрени с аурой и частоте приступов 1 и более раз в месяц (в 15,8 раза) по сравнению с лицами контрольной группы. Показана более высокая распространенность инфарктов мозжечка, инфарктов в бассейне задней мозговой артерии по отношению к другой локализации ишемических очагов [35].
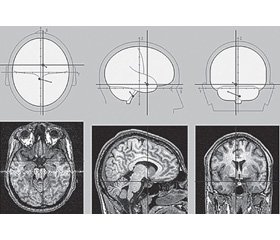
Приводим наблюдение пациента с нетипичной локализацией очага мигренозного инсульта [17]. Пациент П., 1958 г.р., 09.01.2014 года доставлен бригадой скорой помощи в 4-е неврологическое отделение 5-й клинической больницы г. Минска с жалобами на повторяющиеся приступы интенсивной головной боли в левой (реже в правой) лобно-височно-орбитальной области с распространением по типу гемикрании. В начале приступа беспокоила боль распирающего, затем пульсирующего характера, интенсивность — 9–10 баллов по визуально-аналоговой шкале (ВАШ). Головной боли сопутствовали тошнота, многократная рвота, свето- и звукобоязнь, нарушение работоспособности. Любой вид обычной физической нагрузки резко усиливал головную боль, поэтому во время приступа пациент лежал в постели, в темном и тихом помещении. Пациент также отмечал онемение в пальцах левой руки, которое распространялось по верхней конечности на нижнюю часть лица, язык и сохранялось до 20 минут. После прекращения парестезии сразу же начиналась головная боль вышеуказанного характера. Приступы ГБ с интенсивностью болевой фазы 6–8 баллов по ВАШ пациента беспокоят с 19 лет 1–2 раза в год. Не лечился. За медицинской помощью не обращался. С 2013 года эпизоды цефалгии участились до ежемесячных, сопровождались более интенсивной (9–10 баллов по ВАШ) по сравнению с предыдущими приступами односторонней (чаще слева) распирающей с последующим пульсирующим компонентом головной болью, тошнотой, неоднократной рвотой, светобоязнью. Продолжительность приступов — от 12 до 24 часов. Для купирования ГБ принимал неспецифические простые и комбинированные анальгетики, чаще нестероидные противовоспалительные средства. В последние 6 месяцев эффективность этих препаратов снизилась (приходится принимать до 2–3 доз за один приступ, часто неэффективны). 05.01.2014 года после ночного сна появилось онемение в пальцах левой руки, которое распространилось по верхней конечности на нижнюю часть лица, язык, сохранялось 20 минут, затем появилась головная боль вышеуказанного характера. 06.01 и 07.01 через 1 час после ночного сна приступы повторились. 08.01 головной боли не отмечалось. 09.01 через 30 минут после ночного сна появилось онемение в левой руке, в области лица, языка с нарушением речи, затем — головная боль вышеуказанного характера, которая сопровождалась многократной рвотой. Доставлен бригадой скорой помощи в неврологический стационар. Соматических заболеваний не отмечалось. В неврологическом статусе выявлены центральный парез VII нерва слева, девиация языка влево, легкий пирамидный парез левой руки, глубокие рефлексы S > D, положительный симптом Бабинского слева. При нейровизуализации 09.01 в задних отделах лобной области справа (в зоне кровоснабжения корковой ветви средней мозговой артерии) определяется гиподенсная зона 18 × 15 мм. Базальные цистерны, желудочки мозга, кортикальные борозды незначительно расширены.
При ЭЭГ-картировании регулярно регистрировались редуцированные по амплитуде комплексы «пик — медленная волна», исходящие из отведений правого полушария. Единичные вспышки тета-волн регистрировались в лобных отведениях. BrainLoс — средний диполь проецируется в зону глубоких отделов левой височной доли (рис. 1). Выявлены признаки гипервозбудимого типа мигательного рефлекса, а также выраженные изменения соотношения нейрометаболитов — NAA/(Cho + Cr) при протонной спектроскопии в пораженной зоне. Состояние расценено как осложненная инфарктом мозга (09.01.2014) в правой средней мозговой артерии мигрень с аурой, с легким центральным парезом левой верхней конечности, пирамидной недостаточностью слева, с центральным парезом VII, XII черепных нервов слева.
/122-1.jpg )
После стационарного лечения пациенту в связи со снижением эффективности простых и комбинированных анальгетиков рекомендованы триптаны (сумамигрен 50–100 мг) вместе с противорвотными средствами при первых симптомах приступа, а также метопролол 25 мг 2 раза в сутки в течение двух месяцев с профилактической целью. С этого времени два раза в год проводятся 2-месячные курсы превентивной терапии с чередованием и комбинированием бета-адреноблокаторов, антиконвульсантов, антагонистов кальция, антидепрессантов. На фоне проводимых мероприятий вплоть до настоящего времени приступы мигрени беспокоят реже (не чаще 1 раза в 3 месяца), интенсивность болевой фазы при приступе не превышает 6–7 баллов по визуальной аналоговой шкале. В большинстве случаев прием 50 мг сумамигрена при первых проявлениях приступа уже через один час приводит к существенному уменьшению интенсивности головной боли и сопутствующих симптомов, а через 2 часа боль, как правило, полностью купируется, восстанавливается общее состояние пациента. Таким образом, при общепризнанной более частой локализации мигренозных инфарктов в вертебробазилярной системе артерий они возможны при мигрени и в зоне крово–снабжения каротидного сосудистого бассейна, что подтверждается нашим клиническим наблюдением.
За последние десятилетия возможности диагностики и терапии мигрени расширились благодаря появлению новых лекарственных средств, внедрению новых методов нейровизуализации. Применяются препараты с измененными параметрами фармакокинетики, проведены сравнительные исследования эффективности и переносимости различных противомигренозных анальгетиков [1]. Научно-практическая программа «Глобальный год борьбы с головной болью (2011–2012 гг.)», проведенная под эгидой Всемирной ассоциации по изучению боли (JASP), подтвердила необходимость комплексного (медикаментозного и немедикаментозного — акупунктуры и т.д.) лечения мигрени [6]. Широкое внедрение методов нейровизуализации позволяет выявить функциональные и структурные изменения, которые происходят у пациентов с мигренью. У больных с высокой частотой приступов мигренозной боли (больше трех в месяц) отмечается снижение плотности серого вещества в лобной, лимбической и теменной областях, в стволе мозга и чечевицеобразном ядре, снижение плотности белого вещества в лобных долях, а также снижение анизотропии лобных долей, повышение плотности белого вещества в мозжечке [9, 25, 36]. По данным популяционного исследования CAMERA, очаги повреждения белого вещества полушарий мозжечка достоверно чаще выявляли у людей, страдающих частыми приступами мигрени с аурой, по сравнению со здоровыми лицами. Эти и другие исследования позволили предположить, что данный вид мигрени является фактором риска очагового ишемического поражения головного мозга [36]. В последние годы при мигрени широко используются магнитно-резонансная томография (МРТ) и МР-ангиография, перфузионно-взвешенная МРТ и церебральная ангиография [9, 25, 33]. При проведении функциональной МРТ у пациентов с мигренозной болью наблюдается активация дорсальной части ростральных отделов варолиева моста, центрального серого вещества, красного ядра, черной субстанции, передней прямой извилины, задней поясной извилины, мозжечка, таламуса, островка, префронтальной коры, височных долей, ножек мозга, голубого шатра. Позитронно-эмиссионная томография (ПЭТ) позволяет отметить активацию дорсальных отделов варолиева моста, ростральной части продолговатого мозга, передней поясной извилины, полушарий мозжечка, островка, префронтальной коры, скорлупы [9, 25, 33, 36].
В клиническом, нейрофармакологическом и нейрофизиологическом аспектах проблема мигрени и сейчас активно разрабатывается во всем мире, исследуется во многих лабораториях, научных центрах, институтах за рубежом и в нашей стране. Распространенность, высокий уровень коморбидности мигрени с другими заболеваниями, с эпилепсией, депрессией, тревогой, ассоциация с инфарктом мозга определяют актуальность и практическую значимость данной проблемы [1–6, 8–17, 21–23, 26, 29, 35–37, 39].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Амелин А.В. Мигрень (патогенез, клиника, лечение) / А.В. Амелин, Ю.Д. Игнатов, А.А. Скоромец и др. — М.: МЕДпресс-информ, 2011. — 265 с.
2. Артеменко А.Р. Хроническая мигрень: клиника, патология, лечение: Автореф. дис... д-ра мед. наук: 14.00.13 / А.Р. Артеменко. — М., 2010. — 48 с.
3. Боль: практическое руководство для врачей / Под ред. Н.Н. Яхно, М.Л. Кукушкина. — М.: Издательство РАМН, 2011. — 512 с.
4. Вейн А.М. Головная боль: классификация, клиника, диагностика, лечение / А.М. Вейн, О.А. Колосова, Н.А. Яковлев и др. — М., 1994. — 286 с.
5. Гафуров Б.Г. Клинико-физиологические различия мигрени у мужчин и женщин // Журн. неврол. и психиатр. имени С.С. Корсакова. — 2001. — № 12. — С. 57-58.
6. Данилов А.Б. Управление болью. Биопсихосоциальный подход / А.Б. Данилов, Ал.Б. Данилов. — М.: АММ ПРЕСС, 2012. — 568 с.
7. Европейские принципы ведения пациентов с наиболее распространенными формами головной боли в общей практике: практическое руководство для врачей / Т.Дж. Стайнер и соавт.: Пер. с англ. Ю.Э. Азимовой, В.В. Осиповой / Под ред. В.В. Осиповой, Т.Г. Вознесенской, Г.Р. Табеевой. — М.: ОГГИ. РП, 2010. — 56 с.
8. Евтушенко С.К. Мигрень и лакунарные инсульты как базисное проявление церебральной аутосомно-доминантной артериопатии с субкортикальными инфарктами и лейкоэнцефалопатией (CADASIL-синдром) / С.К. Евтушенко, И.С. Евтушенко, Е.А. Савченко и др. // Оригинальные исследования. — 2011. — № 8 (46). — С. 1-2.
9. Корешкина М.И. Совершенствование клинико-инструментальных подходов к диагностике и лечению мигрени: Автореф. дис... д-ра мед. наук: 14.00.13 / М.И. Корешкина. — СПб., 2014. — 42 с.
10. Максюкова Е.В. Мигрень у пациентов старшей возрастной группы: клинико-психологический анализ / Е.В. Максюкова, В.В. Осипова // Рос. журн. боли. — 2011. — Т. 2. — С. 33.
11. Мищенко Т.С. Мигрень как фактор риска развития мозгового инсульта: по материалам Международного инновационного симпозиума «Yalta Neuro Summit 2011: Современные аспекты практической неврологии» (17–20 сентября, г. Ялта. АР Крым) / Т.С. Мищенко // Человек и Лекарство (Казахстан). — 2013. — № 8 (24). — С. 60-64.
12. Мищенко Т.С. Современные подходы к фармакотерапии мигрени / Т.С. Мищенко, В.Н. Мищенко // Междунар. неврол. журнал. — 2015. — № 1 (71). — С. 90-98.
13. Морозова О.Г. Мигрень: вопросы коморбидности и дифференциальной диагностики / О.Г. Морозова // Здоров’я України. — 2010. — № 12. — С. 19-20.
14. Морозова О.Г. Мигрень: современные представления о диагностике и терапии / О.Г. Морозова // Человек и Лекарство (Казахстан). — 2012. — № 7 (11). — С. 110-118.
15. Осипова В.В. Первичные головные боли: практическое руководство / В.В. Осипова, Г.Р. Табеева. — М.: ПАГРИ-Принт, 2007. — 60 с.
16. Осипова В.В. Первичные головные боли: диагностика, клиника, терапия. Практическое руководство / В.В. Осипова, Г.Р. Табеева. — М.: Медицинское информационное агентство, 2014. — 336 с.
17. Садоха К.А. Осложненная мигренозным инсультом мигрень / К.А. Садоха, В.В. Евстигнеев, О.В. Кистень и др.: материалы Всероссийской научно-практической конференции с международным участием «Давиденковские чтения». — СПб.: Человек и его здоровье, 2015. — С. 240-242.
18. Сакко С. Периферическая сосудистая дисфункция при мигрени / C. Cакко, П. Рипа, Д. Грасси и др. // Здоров’я України. — 2014. — № 2 (29). — С. 36-37.
19. Сергеев А.В. Центральная нейрональная гипервозбудимость — предиспозиция к мигрени / А.В. Сергеев, Г.Р. Табеева, Ю.Э. Азимова // Рос. журн. боли. — 2010. — № 2. — С. 3-8.
20. Синельникова М.Н. Цереброваскулярная патология у женщин в климактерическом периоде: Автореф. дис… канд. мед. наук. — Иркутск, 2004. — 24 с.
21. Снопкова Е.В. Анализ клинико-психологических и нейрофизиологических особенностей мигрени у пациентов старшей возрастной группы / Е.В. Снопкова, А.В. Сергеев, В.В. Осипова // Рос. журн. боли. — 2012. — № 1. — С. 44.
22. Табеева Г.Р. Мигрень у женщин / Г.Р. Табеева, Ю.Э. Азимова // Леч. врач. — 2010. — № 9. — С. 21-23.
23. Табеева Г.Р. Мигрень / Г.Р. Табеева, Н.Н. Яхно. — М.: ГЭОТАР-Медиа, 2011. — 624 с.
24. Тадтаева З.Г. Полиморфизм гена метилентетрагидрофолатредуктазы, гипергомоцистеинемия и возможности ее медикаментозной коррекции при мигрени у детей / З.Г. Тадтаева, Ю.Л. Кацадзе // Казанский мед. журнал. — 2007. — Т. 88, № 1. — С. 16-19.
25. American Academy of Neurology. The utility of neuroimaging in the evaluation of headache in patients with normal neurological examinations // Neurology. — 1994. — Vol. 44. — P. 1353-1354.
26. Chang C.L. Duration, frequency, recency and type of migraine and the risk of ischaemic stroke in women of childbearing age / C.L. Chang, Michael Donaghy, Neil Poulter // J. Neurol. Neurosurg. Psychiatry. — 2002. — Vol. 73. — P. 747-750.
27. Charles A. Cortical spreading depression — new insights and persistent questions / A. Charles, K.C. Brennan // Cephalalgia. — 2009. — Vol. 29. — P. 1115-1124.
28. Choudhuri R. Cortical spreading depression and gene regulation: relevance to migraine / R. Choudhuri, L. Cui, C. Yong // Ann. Neurol. — 2002. — 51. — 499-506.
29.Cutler F.M. Migraine-associated dizziness / F.M. Cutler, R.W. Baloh // Headache. — 1999. — 32. — 300-304.
30. Global, regional and national incidence, prevalence and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015 // Lancet. — 2016. — 388. — 1545-602.
31. Goadsby P.J. Pathophysiology of Migraine: A disease of the Brain // Headache / Goadsby P.J., Silberstein S.D. (eds). — Butterworth-Heinemann, 1997. — P. 5-25.
32. Jenkins D. Characterization of the prostanoid receptor types involved in mediating calcitonin generelated peptide release from cultured rat trigeminal neurons / D. Jenkins, W. Feniuk, P. Humphrey // Br. J. Pharmacol. — 2001. — 134. — P. 1296-1302.
33. Koreshkina M.I. Magnetic resonance investigation 3,0 T defects white matter lesions of brain in case of chronic migraine / M.I. Koreshkina, S.W. Atlas, A.D. Khalikov et al. // Cephalalgia. — 2009. — Vol. 29. — P. 127.
34. Kowa H. The homoxygous C677T mutation in the methylenetetrahydrofolate reductase gene is a genetic risk factor for migraine / H. Kowa, K. Yasui, T. Takeschima et al. // Am. J. Med. Genetics. — 2000. — 96 (6). — 762-764.
35. Kruit M.C. Migraine as a risk factor for subclinical brain lesions / M.C. Kruit, van M.A. Buchen, P.A.M. Hoffman et al. // JAMA. — 2004. — 291. — 427-434.
36. Kruit M.C. Migraine is associated with an increased risk of deep white matter lesions, subclinical posterior circulation infarcts and brain iron accumulation: The population-based MRI CAMERA study / M.C. Kruit, van M.A. Buchen, L.J. Launer et al. // Cephalalgia. — 2010. — Vol. 30. — P. 129-136.
37. Kurth T. Migraine, headache and the risk of stroke in women: a prospective study / T. Kurth, M.A. Slomke, C.S. Kase // Neuro–logy. — 2005. — Vol. 64. — P. 1020-1026. 38. Merikangas K.R. Genetics of migraine and other headaches / K.R. Merikangas // Cur. Opinion Neurology. — 1996. — Vol. 9, № 3. — P. 202-205.
39. Sances G. Course of migraine during pregnancy and postpartum: A prospective study / G. Sances, А. Granella, R.E. Nappi et al. // Cephalalgia. — 2003. — 23. — 197-205.
40. Wei E.P. Calcitonin gene-related peptide mediates nitroglice–rine and sodium nitroprusside vasodilatation in feline cerebral arterioles / E.P. Wei, M.A. Moskowitz, P. Boccalini et al. // Circ. Res. — 1992. — 70. — 1313.

/122-1.jpg )