HIV-infection; HAART; brain; MRIПо оценкам Всемирной организации здраво–охранения [19], в конце 2014 г. в мире насчитывалось около 36,9 млн человек, живущих с позитивными показателями инфекции вируса иммунодефицита человека (ВИЧ), среди которых отмечается тенденция к увеличению числа неврологических заболеваний. По официальным данным Министерства здраво–охранения, на 1 ноября 2016 г. в Беларуси проживало 16 954 человека с ВИЧ-положительным статусом (0,2 % от общей численности населения). Показатель распространенности вирусной инфекции составил 176,9 на 100 тысяч населения, а удельный вес лиц в возрастной группе 15–49 лет в общей структуре ВИЧ-инфицированных — 93,3 % [15].
ВИЧ-инфекция — вирусное заболевание, характеризующееся прогрессирующей деструкцией иммунной системы с развитием синдрома приобретенного иммунодефицита. В жизненном цикле ВИЧ выделяют несколько ключевых моментов:
1) прикрепление вирусной частицы к лимфоциту человека посредством соединения гликопротеидов 41 и 120 вируса c рецептором CD4 и хемокиновым корецептором (CCR5 и СХСR4);
2) образование генетического материала вируса в результате действия фермента ВИЧ-обратной транскриптазы;
3) встраивание провирусной ДНК в ДНК человека с помощью фермента ВИЧ-интегразы;
4) формирование белков вируса под действием протеазы ВИЧ.
Центральная нервная система (ЦНС) и цереброспинальная жидкость (ЦСЖ) имеют свою иммунную систему, в которой функционируют три морфологически и функционально отличающиеся группы клеток. Первая группа представлена лимфоидными клетками ЦСЖ (Т- и В-клетки; естественные киллерные клетки, моноциты и макрофаги), которые и формируют иммунологический барьер мозга. Вторую группу составляют клетки нервной ткани — микроглии и макроглии (астроциты, олигодендроциты). К третьей группе относятся гуморальные факторы, биологически активные вещества — нейротрансмиттеры, нейропептиды, цитокины и др.
ВИЧ поражает глиальные клетки мозга — астроциты, олигодендроциты, эндотелиальные клетки сосудистых сплетений оболочек головного мозга и эпендимы желудочков, несущие СD4-рецепторы. Инфекция, обусловленная ВИЧ, приводит к повреждению белого вещества и гибели нервных клеток в результате цитопатического действия гликопротеида gp120 и нейротоксических веществ, продуцируемых клетками микроглии, астроцитами и мигрирующими из крови моноцитами [1, 3, 10, 11, 14]. На фоне развивающегося иммунодефицита активизируются оппортунистические инфекции: грибы (Candida albicans, Pneumocysta carinii и др.), вирусы (цитомегаловирус, вирус герпеса), бактерии (стрепто-, стафилококки и др.), которые, в свою очередь, могут вызывать различные повреждения нервной ткани головного мозга.
Н.А. Беляков с соавт. (2012) сообщают о 4 ниже–указанных путях проникновения ВИЧ в головной мозг на разных стадиях заболевания (рис. 1).
Другие исследователи рассматривают три пути распространения ВИЧ в ЦНС [11, 12, 21, 27]:
1. Вирус может транспортироваться в ЦНС в составе лимфоцитов и макрофагов. Зараженные ВИЧ моноциты играют роль «троянского коня», транспортируя вирус в ЦНС и обеспечивая его контакт с нейронами и нейроглией.
2. ВИЧ может распространяться в ЦНС по нервным волокнам. Глиальные клетки инфицируются благодаря их мембранному лизису белком gp120. Проникновение в спинномозговую жидкость gp120 может запустить аутоиммунный процесс против клеток ЦНС.
3. ВИЧ может проникнуть в ЦНС через щели между эндотелиальными клетками капилляров и инфицировать таким образом клетки нейроглии.
Вопрос о клетках-мишенях для ВИЧ окончательно не решен. В настоящее время общепризнанна способность этого вируса к репликации в периваскулярных макрофагах и клетках микроглии. Показана возможность первичного ВИЧ-поражения эндотелия сосудов головного и спинного мозга.
Поражения нервной системы при ВИЧ-инфекции и СПИДе наблюдаются у многих пациентов на любой стадии заболевания: в субклинической фазе — у 20 % инфицированных, в стадии развернутой клинической картины болезни — у 40–50 %, в более поздние сроки — у 30–90 % [1, 7, 10, 14, 23]. Неврологические структурные изменения головного мозга при лучевой диагностике были выявлены Н.А. Трофимовой с соавт. [16] в 59 % случаев среди 398 ВИЧ-инфицированных больных. Патология ЦНС обнаружена прозекторами в 46,2 % случаев из 122 патологоанатомических вскрытий умерших от ВИЧ-инфекции в 2012 году [21].
Вирус иммунодефицита человека может вызывать разнообразные неврологические поражения центральной и периферической нервной системы. Они могут быть как первичными — вызванными самим ретровирусом, так и вторичными — обусловленными оппортунистическими инфекциями, опухолями, цереброваскулярной патологией, метаболическими расстройствами, токсическим воздействием антиретровирусных препаратов [1, 7, 11, 19, 23]. Перечень возбудителей оппортунистических инфекций разнообразен. На первом месте находятся грибы, токсоплазма, вирус Эпштейна — Барр. Морфологический процесс вторичных повреждений протекает в виде менингоэнцефалита, демиелинизаций, объемных процессов, нарушений мозгового кровообращения [3]. В 10–20 % случаев синдрома приобретенного иммунодефицита неврологические расстройства бывают первыми проявлениями заболевания, причем достоверная связь обнаружена только с развитием ВИЧ-энцефалопатии и вакуольной миелопатии [2, 14].
Отличительной особенностью поражения головного мозга у ВИЧ-инфицированных пациентов является синхронное существование нескольких нозологий, например ВИЧ и злокачественных опухолей; ВИЧ, токсоплазмоза и криптококкоза [17, 28]. По данным А.С. Шеломова [19], в 28,6 % случаев поражения ЦНС вызваны микст-инфекциями. Анализ доминирующих вариантов коморбидности при ВИЧ-инфекции представлен Н.А. Беляковым и соавт. в 2016 г. [5]. На этапе быстрого распространения инфекции наблюдалось сочетание ВИЧ и наркомании, затем стали формироваться группы пациентов с полиморбидностью, появились основные коморбидные варианты течения: ВИЧ и коинфекция — вирусные гепатиты, туберкулез; ВИЧ и злокачественные опухоли; ВИЧ-ассоциированные неврологические заболевания и некоторые другие. Настоящий период эпидемии ВИЧ, несмотря на применение высокоактивной антиретровирусной терапии (ВААРТ), продолжает сопровождаться высокой летальностью.
По литературным данным [17], у 10–15 % пациентов с ВИЧ-инфекцией развиваются цереброваскулярные осложнения, которые не настолько хорошо изучены, как другие неврологические расстройства, вызванные непосредственно вирусом иммунодефицита и оппортунистическими инфекциями. ВИЧ считается одним из основных факторов риска инсульта у молодых пациентов (≤ 45 лет), причем самый высокий риск сосудистой патологии головного мозга возникает в первые 6 месяцев от начала антиретровирусной терапии [25]. Частота инсульта у ВИЧ-инфицированных моложе 40 лет в 50 раз выше, чем у лиц того же возраста в популяции [19].
В недавних исследованиях выявили [26] тесные биологические и клинические связи между ВИЧ-инфекцией и риском развития инфаркта миокарда, что повышает вероятность возникновения кардиоэмболического инсульта головного мозга. Проведенный метаанализ 5 исследований, включивший около 90 тысяч пациентов, показал, что такие традиционные факторы риска, как возраст, артериальная гипертензия, курение, гиперлипидемия, фибрилляция предсердий и диабет, являются независимыми предикторами инсульта при ВИЧ-инфекции [25].
Инсульт, связанный с инфекцией вируса иммунодефицита человека, может реализовываться через различные патогенетические механизмы. Клинические проявления первичного поражения включают васкулярную форму нейроСПИДа, которая вызвана развитием вирусиндуцированного васкулита церебральных сосудов, обусловленного целым рядом причин [10, 11, 17, 21]. Первичные васкулиты и васкулопатии возникают из-за наличия CD4-рецепторов на эндотелиальных клетках сосудистых сплетений оболочек мозга и эпендимы желудочков. На фоне первичных ВИЧ-васкулитов отмечаются множественные микроинфаркты в базальных ядрах, перивентрикулярных отделах белого вещества. На поздних стадиях ВИЧ-инфекции наблюдаются вторичные церебральные васкулиты как реакция на оппортунистическую инфекцию. Клинические формы вторичного нейроСПИДа отличаются значительным многообразием, в том числе развиваются и сосудистые поражения: вторичная геморрагическая тромбоцитопения, церебральные васкулиты с инфарктами мозга, геморрагические инсульты. Многие авторы [11, 18] предполагают, что васкулиты и оппортунистические заболевания, обусловленные Mycobacterium tuberculosis, Aspergillus spp., Candida spp., герпесвирусами, токсоплазмой и другими патогенными и условно-патогенными микроорганизмами, являются основными причинами инсультов у ВИЧ-позитивных лиц. Реже отмечаются гранулематозные ангииты на фоне первичной лимфомы головного мозга или герпетического поражения лица, но ангиит наблюдается и у ВИЧ-инфицированных пациентов, не болевших герпетической инфекцией [10]. Церебральные ишемические поражения могут быть обусловлены ангиитами, ассоциированными с бактериальными менингитами. По последним данным, цитомегаловирусная (ЦМВ) инфекция является предиктором ишемического инсульта среди пациентов с ВИЧ/СПИДом [30]. Характерным признаком церебральных васкулитов является волнообразное течение. Вследствие поражения большого числа сосудов развиваются повторные ишемические инсульты с появлением новых очаговых симптомов. Мультифокальное поражение белого вещества при острых нарушениях мозгового кровообращения у ВИЧ-инфицированных отмечается примерно в 15 % случаев и представлено первичными или вторичными васкулитами, связанными с присоединением оппортунистической инфекции или употреблением наркотиков [11, 13, 17].
Клинический случай 1
Пациентка Ш., 29 лет, поступила в отделение сосудистой патологии головного мозга в ноябре 2015 г. с жалобами на головную боль. Со слов гражданского мужа, около 5–6 месяцев тому назад у женщины появились дизурические явления на фоне умеренного повышения температуры. После лечения в урологическом отделении городской больницы она чувствовала себя удовлетворительно, однако спустя 3–4 недели отметила головную боль, прогрессирующее ухудшение зрения на правый глаз, субфебрильную температуру, вновь была госпитализирована и дважды проходила лечение в неврологических отделениях городских больниц по поводу аневризматической внутримозговой гематомы в правом полушарии головного мозга. Развился двусторонний амавроз и когнитивные нарушения. В сентябре 2015 г. пациентка была прооперирована по поводу аневризмы правой средней мозговой артерии (эмболизация) и гидроцефалии (шунтирование). Из анамнеза: сифилис в 2005 г.
Объективно при поступлении: состояние средней тяжести. АД — 180/110 мм рт.ст. Тоны сердца приглушены, ритмичные, тахикардия — 86 в мин. В легких дыхание везикулярное. Органы брюшной полости при пальпации без особенностей. Мочится самостоятельно в памперсы. Неврологический статус: в сознании. Продуктивный контакт ограничен, память и критика снижены (мини-схема исследования психического состояния: MMS — 24 балла, батарея лобной дисфункции: FAB — 15 баллов). Двусторонний амавроз. Частичный парез взора вверх. Центральный парез лицевой мускулатуры справа. Активные движения в правых конечностях ограничены, умеренный правосторонний гемипарез. Легкий левосторонний гемипарез. Сухожильно-надкостничные рефлексы D > S. Положительные патологические кистевые рефлексы, стопных знаков не выявлено. Умеренная ригидность мышц затылка.
Обследование. Спиральная компьютерная томография (СКТ) головного мозга: состояние после оперативного лечения патологии мозга. Дренаж в правом боковом желудочке. Участки пониженной плотности в области базальных ядер справа, в теменной области слева, мозжечке и варолиевом мосту. В области базальных ядер справа киста размером 13 × 28 мм и внутримозговой очаг повышенной плотности размером 6 × 11 мм. При КТ-ангиографии аневризм, артериовенозных мальформаций, патологических сужений сосудов не обнаружено. Магнитно-резонансная томография (МРТ-мощность магнитного поля 3 тесла) головного мозга: в области базальных ядер справа — постгеморрагическая киста размером 36 × 10 мм. Гиперинтенсивный очаг в заднелобной области слева размером 15 × 10 мм. В правой затылочной области — зона рубцово-атрофических изменений размером 26 × 31 мм, затрагивающая белое и серое вещество головного мозга. В области ножек среднего мозга и мозжечка — зона неоднородно повышенного сигнала на Т2-ВИ. В области варолиева моста, мозжечка, базальных ядер — множественные мелкие очаги метаболитов крови. Заключение: МР-картина васкулита на фоне ВИЧ-инфекции. Общий анализ крови: гемоглобин — 98–105 г/л; тромбоциты — 114 и 120 • 109 г/л. Гемостазиограмма — без особенностей. Серологические анализы крови и ликвора на герпетическую инфекцию (вирусы простого герпеса 1, 2; цитомегаловирус) отрицательные. Анализ крови на маркеры аутоиммунной патологии (антитела к кардиолипину, бета-2-гликопротеину класса M и G, волчаночные анти–коагулянты) отрицательный. Анализ крови на ВИЧ: CD4 — 99 кл/мкл, 15,9 %. Серологические анализы крови на антитрепонемные антитела (реакция гемагглютинации и иммуноферментного анализа) положительные; серологические анализы ЦСЖ отрицательные. Анализ ЦСЖ: неизмененные эритроциты — 70–72 в п/зр, частично измененные — 7 в п/зр, белок — 1,25 г/л, глюкоза — 2,95 ммоль/л, цитоз — 35/3, лимфоциты — 90 %. Консультация эпидемиолога-инфекциониста: первичный нейроСПИД, 1-я клиническая стадия, церебральный ВИЧ-ассоциированный васкулит. Остаточная серопозитивность перенесенного сифилиса.
В описанном клиническом случае развитие очаговой неврологической симптоматики у молодой 29-летней женщины, повторные геморрагические и ишемические очаги поражения головного мозга, ранее перенесенный сифилис создавали диагностические трудности причинно-следственного характера. Инсульты у лиц молодого возраста, как правило, требуют проведения сложной дифференциальной диагностики между сосудистым, инфекционным, аутоиммунным поражением головного мозга. Проводился поиск других заболеваний, способных вызвать васкулит или васкулопатию (например, антифосфолипидный синдром) церебральных сосудов. Предполагаем, что особенность данного наблюдения состоит в сочетании ВИЧ-ассоциированного и сифилитического церебрального васкулита на фоне анемии и тромбоцитопении.
Поражения ЦНС у наркопотребителей обусловлены васкулитами, билатеральными инфарктами бледных шаров (героин) и кровоизлияниями (амфетамин). Очаги геморрагии размерами до 3,0–4,0 см, окруженные зоной массивного перифокального отека, локализуются в базальных ганглиях и субкортикальных отделах белого вещества. При употреблении героина возможно развитие токсической лейкоэнцефалопатии, проявляющейся диффузным изменением белого вещества [17].
Инсульт у ВИЧ-инфицированных может быть связан с повышенным риском тромбоза, состоянием протромбинового статуса, который характеризуется повышением уровня фактора Виллебранда и низким уровнем металлопротеиназы (ADAMS13), расщепляющей этот фактор. И.И. Чукаева с соавт. (2013) при обследовании 21 пациента с естественным течением ВИЧ-инфекции и уровнем СD4-клеток более 350 кл/мл не выявили проатерогенных сдвигов в липидном и углеводном профиле, но обнаружили достоверно более высокий уровень фактора Виллебранда по сравнению с контрольной группой [22]. Другие исследователи [24] предполагают, что фактор Виллебранда является маркером эндотелиальной дисфункции и повышенного риска вирусной иммунодефицитной инфекции человека.
Частым проявлением церебральной сосудистой патологии у ВИЧ-инфицированных и больных
СПИДом является развитие ишемического инсульта. Основные формы нарушений, которые наблюдаются у ВИЧ-инфицированных лиц, — это большой ишемический инфаркт обычно в бассейне средней мозговой артерии; множественные мелкие перивентрикулярные лакунарные инфаркты либо мелкие кортикальные зоны ишемии, протекающей по типу малого ишемического инсульта и регрессирующей в течение 2–3 недель [1, 10].
Клинический случай 2
Пациент Р., 62 лет, поступил в отделение сосудистой патологии головного мозга, жалоб не предъявлял в связи с нарушениями речи. Со слов родственников,
накануне развилась слабость правых конечностей.
Объективно при поступлении: состояние средней тяжести, АД — 160/100 мм рт.ст., тоны сердца ритмичные, приглушены, пульс — 70–85 в минуту; в легких выслушиваются рассеянные мелкие хрипы, больше — в верхних долях; живот мягкий, при пальпации безболезненный, мочеиспускание самостоятельное в памперсы.
Неврологический статус: в сознании, заторможен, менингеальных знаков не выявлено. Зрачки D = S, глазо–двигательных расстройств не обнаружено, сглажена правая носогубная складка. Рефлексы орального автоматизма положительные. Сухожильно-надкостничные рефлексы D > S. Правосторонняя гемиплегия. Симптом Бабинского вызывается справа. Сенсомоторная афазия (заключение логопеда).
Обследование. Анализ крови: гемоглобин — 113 г/л; тромбоциты — 199–280 • 109 г/л. Гемостазиограмма — без особенностей. Тропонин — 0,03 нг/мл (норма — 0,02). Серологические анализы крови на вирусы простого герпеса, токсоплазмоз отрицательные; на цитомегаловирус — положительный. Анализы крови на ВИЧ: CD4 — 113 кл/мкл, 10,2 %. Анализ ЦСЖ: белок — 0,12 г/л, глюкоза — 2,7 ммоль/л, цитоз — 1/3. СКТ головного мозга: в глубоких отделах левой теменной доли зона пониженной плотности размером 52 × 35 × 47 мм без четких контуров. Признаки ишемического инсульта в левом полушарии головного мозга. СКТ органов грудной клетки: очаговая правосторонняя нижнедолевая пневмония, двусторонний плеврит, застойные явления в малом круге кровообращения. УЗИ органов брюшной полости: гепатомегалия, диффузные изменения печени с признаками венозного полнокровия. Эхокардиография: уплотнение стенок аорты, створок клапанов. Аортальная, митральная и трикуспидальная регургитация 2-й степени. Выраженная гипертрофия левого желудочка; выраженная дилатация предсердий и правого желудочка. Подвижных наложений на клапанах не выявлено. Легочная гипертензия. Умеренный застой по большому кругу кровообращения. Консультация терапевта: ишемическая болезнь сердца: атеросклеротический кардиосклероз, недостаточность аортального и трикуспидального клапанов с регургитацией 2-й степени. Артериальная гипертензия 2-й степени, риск — 4-й. Пневмония в верхней доле справа. Двусторонний плеврит. Консультация фтизиатра: активный туберкулез не выявлен. Консультация эпидемиолога-инфекциониста: ВИЧ-инфекция, 3-я клиническая стадия.
На первый взгляд, в приведенном случае кардио–эмболического инфаркта головного мозга в левом каротидном бассейне артерий у мужчины 62 лет нет никаких особенностей, однако при обследовании были выявлены не только сердечная недостаточность и артериальная гипертензия, но и признаки другого заболевания. Окончательный диагноз был установлен на основании данных вирусологического исследования, анализов крови, ликвора и нейровизуализации. Правомерно полагать, что развитию ишемического инсульта способствовали проявления вторичного нейроСПИДа — сочетание вирусной иммунодефицитной и цитомегаловирусной инфекций.
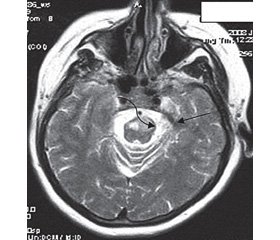
Нередко встречаются тяжелые стволовые инсульты (рис. 2), для которых характерны симптомы поражения ядер черепных нервов и парезы конечностей в виде альтернирующих синдромов [10]. E.M. Sweeney et al. (2014) подчеркнули, что смертность от острого ишемического инсульта среди ВИЧ-инфицированных в стационаре выше, чем среди ВИЧ-неинфицированных пациентов [29].
/140-1.jpg )
В структуре острых нарушений мозгового крово–обращения у пациентов с ВИЧ-инфекцией и в стадии СПИДа описаны геморрагические варианты сосудистых катастроф. Довольно часто наблюдается трансформация ишемического поражения в геморрагический инсульт, в то время как первичные геморрагические инсульты описываются редко. Кровоизлияния в ткань мозга могут быть обусловлены нарушениями реологических свойств крови. Одним из многих гематологических проявлений ВИЧ-инфекции наряду с анемией и лейкопенией является тромбоцитопения, которая встречается на всех стадиях ВИЧ-инфекции — от ранней до развернутой. Снижение уровня тромбоцитов при ВИЧ-инфекции, по данным литературы, выявляется у 10–15 % инфицированных и растет по мере снижения числа CD4-лимфоцитов. Аутоиммунная тромбоцитопения сопровождает течение ВИЧ-инфекции и повышает риск развития интрацеребральных геморрагий [10, 20]. Геморрагический инсульт чаще встречается у пациентов с тяжелой тромбоцитопенией и при метастазах саркомы Капоши в головной мозг. Не исключена ассоциация между тромбоцитопенической пурпурой и СПИДом [8]. Описаны случаи развития паренхиматозных и субарахноидальных кровоизлияний в мозг в результате разрыва микотических аневризм [10].
Клинический случай 3
Пациент К., 54 лет, поступил в отделение сосудистой патологии головного мозга в экстренном порядке, найден на улице. Со слов сына: пациент страдает редкими генерализованными судорожными приступами после черепно-мозговой травмы и 5–6 мес. тому назад перенес внутримозговое кровоизлияние в левое полушарие головного мозга с развитием правостороннего гемипареза и тотальной афазии.
Объективно при поступлении: состояние тяжелое. АД — 140/80 мм рт.ст. В неврологическом статусе: оглушен, но выполняет простые инструкции. Контакт ограничен из-за речевых нарушений. Менингеальных знаков не выявлено. Зрачки D = S, центральный парез VII нерва справа. Язык не показывает. Глоточный рефлекс сохранен. Грубые симптомы орального автоматизма. Псевдобульбарный синдром. Легкий правосторонний гемипарез. Сухожильно-надкостничные рефлексы D > S. Симптом Бабинского вызывается справа. Грубая сенсомоторная афазия (заключение логопеда).
Спектральная КТ головного мозга: в области базальных ядер слева выявляется внутримозговое скопление крови размером 24 × 19 × 16 мм. Диффузно-атрофические изменения. КТА: убедительных данных по аневризме, артериовенозной мальформации не выявлено.
Анализ крови общий: тромбоцитопения (106, 130 и 100 • 109 г/л). Анализ крови на ВИЧ: CD4 — 99 клеток, 15,9 %; CD8 — 403 клетки, 66,5 %.
В описанном случае повторные внутримозговые кровоизлияния у пациента во 2-й клинической стадии ВИЧ-инфекции возникали на фоне тромбоцитопении.
Дополнительные факторы риска инсульта у ВИЧ-позитивных лиц были опубликованы в 2010 году специалистами из университета Сан-Диего B. Ovbiagele и A. Nath. Установлено, что число ишемических инсультов у ВИЧ-позитивных лиц увеличилось на 67 % в период, когда в лечении стала применяться высокоактивная антиретровирусная терапия (ВААРТ), которая продлевает жизнь пациентов. Однако лекарственные препараты ВААРТ оказывают влияние на уровень липидов и глюкозы — биомаркеров возможного возникновения инсульта [11]. Поражение сердечно-–сосудистой системы при ВИЧ-инфекции всегда значительно ухудшает прогноз. Полагают, что сердечно-сосудистые заболевания у пациентов с ВИЧ-инфекцией могут быть связаны с воздействием антиретровирусных препаратов для лечения оппортунистических осложнений [6]. F. D’Ascenzo, G. Quadri et al. [26] подчеркивают, что инсульт является относительно распространенным осложнением у молодых, ВААРT-леченных пациентов с ВИЧ. При многомерном анализе 22 наименований антиретровирусных препаратов [9] пять из них по частоте приема были сопряжены с определенной нозологической формой, которая была причиной летального исхода. Содержащие абакавир, лопинавир/ритонавир схемы ВААРТ были ассоциированы с летальным исходом вследствие сердечно-сосудистых заболеваний.
ЦНС относится к органам-мишеням для вируса иммунодефицита, и лучевые методы играют важную роль в диагностике поражений головного мозга. Когда у пациента с положительной реакцией на ВИЧ-инфекцию обнаруживают неврологическую симптоматику, при обследовании ставится задача выявления структурных изменений в головном мозге, определения конкретной нозологии и проведения дифференциальной диагностики. По данным Н.А. Трофимовой с соавт. [18], у большинства обследованных на МР-томограммах были выявлены изменения, которые соответствовали ВИЧ-энцефалопатии и оппортунистическим инфекциям, особенно токсоплазмозу и криптококкозу. Наиболее часто в патологический процесс вовлекались субкортикальные и субэпендимальные отделы головного мозга, а также базальные ганглии [18].
Некоторые авторы полагают [16], что нейровизуализация в обычном клиническом формате (МРТ и КТ) не дает продуктивной информации на стадиях раннего развития ВИЧ-инфекции и важна для исключения сопутствующей патологии мозга, а для получения новой информации оправданно привлечение других лучевых методов диагностики. Например, МР-спектроскопия позволяет оценить метаболические изменения, рано развивающиеся в головном мозге при ВИЧ-инфекции. Так, по данным А.Н. Белякова с соавт., при таком исследовании у всех пациентов отмечались зоны снижения метаболизма глюкозы в передней трети поясной извилины и зоны увеличения метаболизма глюкозы в первичной зрительной коре [3]. С помощью позитронной эмиссионной томографии авторы выявили нарушения энергетического метаболизма глюкозы на ранних этапах заболевания у 40 % пациентов и в 100 % случаев через 5–6 лет после выявления ВИЧ-инфекции [4]. Диффузные и локальные электроэнцефалографические изменения локализовались на ранних стадиях заболевания (2–3-я стадии) преимущественно в области височных долей и ствола головного мозга, что подчеркивает первичный тропизм ВИЧ к данным областям. С позиции клинической практики для выявления функциональных нарушений головного мозга предпочтителен определенный алгоритм исследований ВИЧ-инфицированных лиц, который начинается с неврологической и психологической диагностики и завершается позитронной эмиссионной томографией и МР-спектроскопией [3].
Таким образом, формы и течение ВИЧ-ассоциированных инсультов имеют ряд особенностей, обусловленных преморбидными изменениями сосудов головного мозга и состоянием протромбиновых факторов крови. Васкулиты и перенесенные оппортунистические заболевания являются основными причинами инсультов у ВИЧ-позитивных лиц.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Бартлетт Д. Клинические аспекты ВИЧ-инфекции / Д. Бартлетт, Д. Галант, П. Фам. — М.: Р. Валент, 2012. — 528 с.
2. Безрукова Е.Г. Диагностические подходы при нетипичном (неврологическом) дебюте ВИЧ-инфекции / Е.Г. Безрукова, О.Г. Гамов, Е.Б. Лаукарт, А.В. Девяткин и др. // Кремлевская медицина. Клинический вестник. — 2014. — 4. — 11-17.
3. Беляков Н.А. Механизмы поражения головного мозга при ВИЧ-инфекции / Н.А. Беляков, С.В. Медведев, Т.Н. Трофимова и др. // Вестник РАМН. — 2012. — 9. — 4-12.
4. Беляков Н.А. Диагностика и механизмы поражения центральной нервной системы при ВИЧ-инфекции / Н.А. Беляков, Т.Н. Трофимова, В.В. Рассохин // Мед. академ. журн. — 2012. — 2(12). — 56-67.
5. Беляков Н.А. Коморбидные и тяжелые формы ВИЧ-инфекции в России / Н.А. Беляков, В.В. Рассохин, Т.Н. Трофимова, Е.В. Степанова и др. // ВИЧ-инфекция и иммуносупрессии. — 2016. — 3(8). — 9-25.
6. Евтушенко С.К. НейроСПИД как одна из актуальнейших проблем современной практической неврологии / С.К. Евтушенко, И.Н. Деревянко // Междун. неврол. журн. — 2006. — 5(9). — 147-157.
7. Густов А.Н. Клинические варианты поражения нервной системы при ВИЧ-инфекции / А.В. Густов, Е.А. Руина, Д.В. Шилов, М.Н. Ерохина // Клин. медицина. — 2010. — 3. — 61-65.
8. Зайцев И.А. Поражение нервной системы при ВИЧ-инфекции и СПИДе / И.А. Зайцев, В.А. Мирошниченко // Новости мед. и фарм. в Украине. — 2011. — 9(364). — 20-25.
9. Захарова Н.Г. Причины неблагоприятных исходов у больных с ВИЧ-инфекцией, принимавших ВААРТ. Часть II / Н.Г. Захарова, С.И. Дворак, З.В. Губа, С.Л. Плавинский и др. // ВИЧ-инфекция и иммуносупрессии. — 2015. — 4. — 52-63.
10. Иванова М.Ф., Евтушенко С.К. с соавт. Ранняя диагностика ВИЧ-ассоциированных неврологических нарушений как актуальная проблема в практике невролога / М.Ф. Иванова, С.К. Евтушенко, А.В. Семенова и др. // Междун. неврол. журн. — 2016. — 8(86). — 53-62.
11. Корсунская Л.А. Особенности клинического течения цереброваскулярных заболеваний у ВИЧ-позитивных пациентов / Л.А. Корсунская, С.В. Шиян // Междун. неврол. журн. — 2011. — 4(24).
12. Нейронауки и ВИЧ-инфекция: Медицинский тематический архив / Под ред. Н.А. Белякова, Т.Н. Трофимовой, В.В. Рассохина. — СПб.: Балтийский медицинский образовательный центр, 2013. — № 5. — 306 с.
13. Пиголкин Ю.И. Морфологическая диагностика наркотических интоксикаций в судебной медицине. — М., 2004. — 78 с.
14. Сорокоумов В.А. К дифференциальной диагностике острого нарушения мозгового кровообращения и ВИЧ-энцефалита у лиц молодого возраста (с описанием собственного наблюдения) / В.А. Сорокоумов, Н.В. Шулешова, К.В. Голиков, О.Р. Мацкевич, А.Ю. Пономарева // Ученые записки СПбГМУ им. акад. И.П. Павлова. — 2009. — 4(16). — 35-39.
15. Справка «ВИЧ-инфекция в Республике Беларусь на 1 ноября 2016 г.» // http://www.belta.by/society/view/v-belarusi-sredi-vich-infitsirovannyh-preobladajut-muzhchiny-221252-2016.
16. Трофимова Т.Н. Общие особенности лучевой диагностики ВИЧ-ассоциированных поражений головного мозга / Т.Н. Трофимова, Н.А. Беляков, А.В. Трофимова, Ю.А. Щербук // ВИЧ-инфекция и иммуносупрессии. — 2010. — 1(2). — 51-60.
17. Трофимова Т.Н. Многоликая нейрорадиология ВИЧ-инфекции / Т.Н. Трофимова, Н.А. Беляков // Лучевая диагностика и терапия. — 2010. — 3(1). — 3-11.
18. Трофимова Т.Н. Поражения головного мозга у ВИЧ-инфицированных пациентов. Клинико-лабораторные и радиологические сопоставления / Т.Н. Трофимова, Е.Г. Багулина, В.В. Рассохин, Н.А. Беляков // Мед. академ. журн. — 2015. — 4(15). — 31-37.
19. Шеломов А.С. Оппортунистические заболевания как причины поражения центральной нервной системы у больных ВИЧ-инфекцией / А.С. Шеломов, Е.В. Степанова, О.Н. Леонова, Н.Л. Смирнова // Журн. инфектологии. — 2016. — 3(8). — 107-115.
20. Хайретдинов Р.К. Тромбоцитопения при ВИЧ-инфекции / Р.К. Хайретдинов, И.Л. Давыдкин, И.В. Куртов, М.А. Селихова, Е.В. Зорина // Вестник РУДН, серия «Медицина». — 2010. — 3. — 129-132.
21. Цинзерлинг В.А. Поражения центральной нервной системы при ВИЧ-инфекции // ВИЧ-инфекция и иммуносупрессии. — 2014. — 1(6). — 40-45.
22. Чукаева И.И. Влияние ВИЧ-инфекции на факторы риска развития сердечно-сосудистых заболеваний у пациентов с сохраненной функцией иммунной системы / И.И. Чукаева, И.В. Комарова, А.В. Кравченко, Т.Е. Кушакова // Вестник Российского гос. мед. университета. — 2013. — 2. — 9-13.
23. Яковлев Н.А., Жулев Н.М., Слюсарь Т.А. Нейроспид: неврологические расстройства при ВИЧ-инфекции/СПИДе. — М., 2005.
24. Allie S., Stanley A., Bryer A., Meiring M., Combrinck M.I. High levels of von Willebrand factor and low levels of its cleaving protease, ADAMTS13, are associated with stroke in young HIV-infected patients // J. Stroke. — 2015. — 10(8). — 1294-6.
25. Benjamin L.A. HIV, antiretroviral treatment, hypertension, and stroke in Malawian adults: A case-control study / Benjamin L.A., Corbett E.L., Connor M.D. et al. // Neurology. — 2016, Jan 26. — 86(4). — 324-33.
26. D’Ascenzo F. A meta-analysis investigating incidence and features of stroke in HIV-infected patients in the highly active antiretroviral therapy era / D’Ascenzo F., Quadri G., Cerrato E. et al. // J. Cardiovasc. Med. (Hagerstown). — 2015. — 16(12). — 839-43.
27. Shapshak P. Неврологические проявления ВИЧ-инфекции / P. Shapshak, P. Kangueance, R.K. Fujimura // AIDS (русское издание). — 2011. — 1. — 3-21.
28. Stefaniak J. HIV/AIDS presenting with stroke-like features caused by cerebral Nocardia abscesses: a case report // BMC Neurol. — 2015, Oct 7. — 15. — 183.
29. Sweeney E.M. Outcomes of intravenous tissue plasminogen activator for acute ischaemic stroke in HIV-infected adults / Swee–ney E.M., Thakur K.T., Lyons J.L. et al. // Eur J. Neurol. — 2014, Nov 21. — 11. — 1394-1399.
30. Yen Y.F., Jen I., Chen M., Chuang P.H., Liu Y.L., Sharp G.B., Chen Y.M. Association of Cytomegalovirus End-Organ Disease with Stroke in People Living with HIV/AIDS: A Nationwide Population-Based Cohort Study // J. PLoS One. — 2016. — 11(3). — 0151684.

/137-1.jpg )
/140-1.jpg )