Резюме
Актуальність. Транскраніальна сонографія — ультразвуковий метод, що використовується для ранньої діагностики хвороби Паркінсона (ХП). Мета дослідження: встановити нові можливості транскраніальної сонографії в діагностиці клінічних проявів ХП, розробити нейровізуалізаційні біомаркери церебральної атрофії, що супроводжується когнітивними порушеннями у пацієнтів із ХП. Матеріали та методи. Проведено обстеження 100 пацієнтів із ХП і 31 неврологічно здорової людини, порівнянних за статтю, віком, рівнем освіти. Оцінювалися вираженість когнітивних розладів і параметри транскраніальної сонографії (площа гіперехогенності чорної субстанції (ГЧС), ширина III шлуночка, ширина фронтального рогу бічного шлуночка). Результати. Встановлено зворотну кореляційну залежність між сумарною площею ГЧС, а також шириною III шлуночка і результатами нейропсихологічного тестування пацієнтів із ХП за всіма застосовуваними шкалами (р < 0,001). За допомогою ROC-аналізу розрахований оптимальний поріг поділу ширини III шлуночка, що дозволяє оцінювати атрофічні зміни мозку при когнітивних порушеннях у пацієнтів із ХП, який становив 7,4 мм, площа AUC під ROC-кривою 0,78 (95% довірчий інтервал 0,68–0,89; p = 0,001) свідчила про добру інформативність виявленого нейровізуалізаційного критерію. Чутливість транскраніальної сонографії в оцінці церебральної атрофії при когнітивних порушеннях у пацієнтів з ХП становила 82,1 %, специфічність — 77,8 %, діагностична точність — 81,2 %.
Актуальность. Транскраниальная сонография — ультразвуковой метод, использующийся для ранней диагностики болезни Паркинсона (БП). Цель исследования: установить новые возможности транскраниальной сонографии в диагностике клинических проявлений БП, разработать нейровизуализационные биомаркеры церебральной атрофии, сопровождающейся когнитивными нарушениями у пациентов с БП. Материалы и методы. Проведено обследование 100 пациентов с БП и 31 неврологически здорового человека, сопоставимых по полу, возрасту, уровню образования. Оценивались выраженность когнитивных расстройств и параметры транскраниальной сонографии (площадь гиперэхогенности черной субстанции (ГЧС), ширина III желудочка, ширина фронтального рога бокового желудочка). Результаты. Установлена обратная корреляционная зависимость между суммарной площадью ГЧС, а также шириной III желудочка и результатами нейропсихологического тестирования пациентов с БП по всем применяемым шкалам (р < 0,001). С помощью ROC-анализа рассчитан оптимальный порог разделения ширины III желудочка, позволяющий оценивать атрофические изменения мозга при когнитивных нарушениях у пациентов с БП, который составил 7,4 мм, площадь AUC под ROC-кривой 0,78 (95% доверительный интервал 0,68–0,89; p = 0,001) свидетельствовала о хорошей информативности выявленного нейровизуализационного критерия. Чувствительность транскраниальной сонографии в оценке церебральной атрофии при когнитивных нарушениях у пациентов с БП составила 82,1 %, специфичность — 77,8 %, диагностическая точность — 81,2 %.
Background. Transcranial sonography is an ultrasound method used for early diagnosis of Parkinson’s disease (PD). The purpose of the study was to establish potential of the transcranial sonography for detecting PD clinical symptoms, to develop neuroimaging biomarkers of cerebral atrophy, accompanied by cognitive impairment in patients with PD. Materials and methods. The study involved 100 patients with PD and 31 healthy controls matched for age, sex and education. We assessed the cognitive impairment severity and parameters of transcranial sonography (hyperechogenicity area of substantia nigra, the width of the III ventricle, the width of the frontal horns of the lateral ventricle). Results. We have found an inverse correlation between the total area of substantia nigra hyperechogenicity, as well as the width of III ventricle and the results of neuropsychological testing of patients with PD (p < 0.001). Using ROC-analysis we calculated optimal threshold division of the III ventricle width that allows evaluate atrophic changes in the brain, accompanied by cognitive decline in patients with PD, which was 7.4 mm, AUC 0.78 (95% CI 0.68–0.89). P value equal to 0, showed a good informative value of the identified neuroimaging criteria. Transcranial sonography had sensitivity 82.1 %, specificity 77.8 %, diagnostic accuracy 81.2 % for the evaluation of cerebral atrophy, accompanied by cognitive impairment in patients with PD.
Введение
Активный поиск методов обследования, которые позволили бы установить диагноз болезни Паркинсона (БП) на ранних стадиях, в латентной и премоторной фазе болезни, то есть до появления двигательных расстройств, определил высокий интерес исследователей во всем мире к транскраниальной сонографии [1, 5, 7].
Транскраниальная сонография — это метод ультразвуковой диагностики изменений вещества головного мозга в В-режиме. В-режим (от англ. brightness — яркость) дает информацию в виде двухмерных серо–шкальных томографических изображений анатомических структур и позволяет оценивать их морфологическое состояние. Применение транскраниальной сонографии началось с конца 80-х годов ХХ века. На тот момент транскраниальная сонография позволяла визуализировать только крупные паренхиматозные поражения головного мозга — гематомы и опухоли. Появление нового поколения ультразвуковых аппаратов с высокими разрешающими способностями в течение последнего десятилетия позволило выявлять и оценивать структуры небольших размеров, патология которых лежит в основе нейродегенеративных заболеваний. За последние 7–10 лет разработан диагностический и методологический стандарт проведения процедуры транскраниальной сонографии при экстрапирамидных расстройствах [5, 6, 15]. Транскраниальная сонография позволяет оценивать размеры и интенсивность эхогенности черной субстанции, базальных ядер, эхогенность срединного шва, состояние желудочковой системы [5, 6, 15]. Наиболее часто транскраниальная сонография используется для ранней и дифференциальной диагностики БП [8, 10, 11, 17–19].
Впервые гиперэхогенность черной субстанции (ГЧС) при проведении транскраниальной сонографии у пациентов с БП была выявлена G. Becker в 1995 году [9]. Затем эти результаты были подтверждены и другими исследователями (Berg D., 1999; Walter U., 2002; Okawa M., 2007; Ressner P., 2007; Tsai C., 2007; Budisic М., 2009; Федотова Е.Ю., 2011) [3, 11, 13, 14, 17, 19, 20].
ГЧС признается, если интенсивность ультразвукового сигнала от нее превышает таковую от окружающих областей или измеренная площадь превышает нормальные значения, полученные в популяционных исследованиях (более 0,20 см2) [6, 11, 14, 15]. По данным проведенных исследований, ГЧС выявляется у 68–99 % пациентов с БП [5, 6, 11]. Однако у 9–10 % здоровых людей также выявляется ГЧС [5, 6, 12].
Этот факт натолкнул исследователей на мысль о проведении скринингового обследования эхогенности в зоне топического расположения черной субстанции у лиц без клинических проявлений БП. Лонгитудинальное (на протяжении 3 лет) мультицентровое исследование с использованием транскраниальной сонографии 1847 пожилых людей без клинических проявлений БП, проведенное D. Berg с соавторами (2011), показало, что у части обследуемых с выявленной ГЧС развилась БП [12]. Таким образом, рассчитанный риск развития БП у клинически здоровых лиц с ГЧС оказался в 17 раз выше, чем у лиц с нормальной эхогенностью черной субстанции [12]. В группе клинически здоровых пациентов с ГЧС было выявлено снижение накопления в базальных ганглиях внутривенно введенной F18-флюородопы [20]. Проведенные исследования позволили рассматривать ГЧС как потенциальный биомаркер премоторной стадии БП [5, 6, 12].
Использование транскраниальной сонографии оказалось эффективным и для проведения дифференциальной диагностики БП с другими нейродегенеративными заболеваниями с синдромом паркинсонизма. Установлено, что феномен ГЧС редко выявляется при мультисистемной атрофии (в 25 % случаев) и прогрессирующем надъядерном параличе (в 39 % случаев) [10, 16]. В то же время при этой патологии в 72–82 % случаев определяют гиперэхогенность лентикулярных ядер, крайне редко отмечающуюся при БП [10, 16].
Согласно исследованию Е.Ю. Федотовой, чувствитель–ность транскраниальной сонографии для подтверждения диагноза БП составляет 91 % и специфичность — 87 % [3]. В исследовании P. Ressner чувствительность транскраниальной сонографии составила 87 %, а спе–цифичность — 95 % [13]. Таким образом, в настоящее время ГЧС рассматривают как надежный ультразвуковой маркер БП на всех стадиях заболевания [5].
Во всем мире продолжается исследование диагностических возможностей транскраниальной сонографии. Остаются неизученными корреляции параметров транскраниальной сонографии с клиническими данными, выраженностью немоторных проявлений и результатами нейропсихологического тестирования.
Единственным ограничением метода транскраниальной сонографии является отсутствие височных ультразвуковых окон у 2–20 % лиц европеоидной расы [8, 18] и 15–60 % людей азиатского происхождения [17, 19]. Вместе с тем неоспоримыми достоинствами транскраниальной сонографии являются отсутствие противопоказаний к применению и необходимости специальной подготовки пациента, простота и быстрота выполнения исследования, относительно недорогая стоимость, безопасность, неинвазивность обследования, независимость от двигательной активности пациента, возможность неоднократного повторения обследования в динамике без риска для здоровья пациента.
Цель исследования: установить новые возможности транскраниальной сонографии в диагностике клинических проявлений БП, разработать нейровизуализационные биомаркеры церебральной атрофии, сопровождающейся когнитивными нарушениями у пациентов с БП.
Материалы и методы
Проведено обследование 100 пациентов с БП, из них 49 мужчин (49 %) и 51 женщина (51 %). Медиана возраста пациентов с БП составила 65,5 [58,0; 72,0] года. Контрольную группу составил 31 невро–логически здоровый человек, сопоставимые по полу, возрасту, уровню образования. Все лица, участвующие в исследовании, давали добровольное письменное согласие на участие в исследовании в соответствии с принципами Хельсинкской декларации. Протокол ис–следования одобрен этическим комитетом больницы.
Всем пациентам было проведено клиническое неврологическое обследование с оценкой двигательных нарушений с использованием унифицированной рейтинговой шкалы оценки проявлений БП — UPDRS (Unified Parkinson’s Disease Rating Scale), III подраздел. Нейропсихологическое обследование включало краткую шкалу оценки психического статуса — MMSE (Mini-Mental State Examination), батарею лобной дисфункции — FAB (Frontal Assessment Battery). Транскраниальную сонографию выполняли на ультразвуковом сканере экспертного класса Aplio XG фирмы Toshiba (Япония) в В-режиме фазированным секторным датчиком частотой 2,5 МГц. Ультразвуковое исследование проводили согласно разработанному международному стандарту проведения обследования при экстрапирамидных расстройствах через височное акустическое окно по орбитомеатальной линии в преаурикулярной области с двух сторон в аксиальной плоскости сканирования [6, 15]. Отсутствие височных ультразвуковых окон, то есть удовлетворительной визуализации структур среднего мозга в связи со снижением ультразвуковой проницаемости костей свода черепа, отмечено у 8 % (8/100) пациентов с БП и 3,2 % (1/31) — группы контроля. В этой связи учитывали результаты 92 пациентов с БП и 30 пациентов группы контроля.
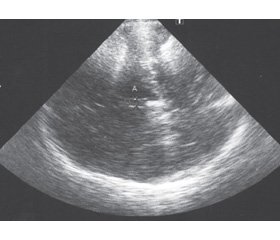
В ножках мозга в мезэнцефальной аксиальной плоскости сканирования ипсилатерально по отношению к датчику в зоне топического расположения черной субстанции оценивали наличие и размеры эхогенности черной субстанции (рис. 1, 2).
ГЧС признавали, если измеренная площадь превышала нормальные значения, полученные в популяционных исследованиях (> 0,20 см2) [15]. Площадь ГЧС измеряли в правой и левой ножке мозга, затем рассчитывали среднюю суммарную площадь ГЧС.
Потом переходили в плоскость визуализации таламусов (диэнцефальную аксиальную плоскость сканирования), что достигали наклоном датчика на 10 градусов вверх. На этом уровне визуализировали желудочковую систему в виде анэхогенной области, окруженной тонкими гиперэхогенными границами линейной формы. Между округлыми гипоэхогенными таламусами оценивали наибольший поперечный размер III желудочка (рис. 3).
Определяли также ширину фронтального рога контралатерального бокового желудочка и наличие возможной гиперэхогенности лентикулярных ядер.
/146-1.jpg )
Статистический анализ включал проверку нормальности распределения. Поскольку распределения большинства анализируемых переменных не подчинялись закону нормального распределения, использовали непараметрические методы статистического анализа. Сравнительный анализ количественного признака в независимых группах осуществляли с использованием критерия Манна — Уитни (Mann-Whitney test, U-критерий), качественного признака — хи-квадрат (Chi-square test, χ2). Корреляционный анализ проводили с использованием метода ранговой корреляции Спирмена (Spearman rank correlation coefficient, rs). Оценка информативности диагностических тестов проводилась с помощью четырехпольной таблицы для оценки эффективности диагностических исследований, на основании которой рассчитывались операционные характеристики, позволяющие оценить эффективность диагностического метода: чувствительность (Se, sensitivity), специфичность (Sp, specificity), диагностическая точность (Ac, accuracy), прогностическая ценность положительного результата (PPV, positive predictive value), прогностическая ценность отрицательного результата (NPV, negative predictive value), отношение правдоподобия положительного результата (LR(+), positive likelihood ratio), отношение правдоподобия отрицательного результата (LR(–), negative likelihood ratio) [1].
Был проведен ROC-анализ диагностических тестов с использованием программы Attestat, версия 13.1, основанный на расчете прогностической ценности площади под ROC-кривой (area under ROC-curve, AUC) и определении порогового значения показателя диагностического теста. Выбор оптимального порогового значения показателя диагностического теста определялся требованием максимальной суммарной чувствительности и специфичности модели. Количественные признаки характеризовали медианой (Me), нижним (25-й процентиль) и верхним (75-й процентиль) квартилями [LQ; UQ] в случае распределения, отличного от нормального. При нормальном распределении признака и использовании относительных величин данные представляли в виде среднего значения (M) и доверительного интервала (95% доверительный интервал (ДИ)). Пороговое значение уровня значимости (p) при проверке статистических гипотез принимали равным 0,05. Статистическая обработка данных осуществлялась с использованием пакета прикладных программ Statisticа 8.
Результаты
При проведении транскраниальной сонографии у 95,7 % пациентов с БП средняя суммарная площадь ГЧС оказалась больше 0,20 см2 по сравнению с 10 % лиц группы контроля. Отсутствие височных ультразвуковых окон отмечалось у 8 % группы БП и 3,2 % группы контроля, однако статистически значимых различий между ними не выявлено (p > 0,05). Медиана площади ГЧС у пациентов с БП составила 34,0 [27,5; 38,5] мм2 cправа и 33,0 [28,0; 37,5] мм2 слева, ширина III желудочка оказалась равной 8,1 [7,2; 9,65] мм.
В контрольной группе медиана площади черной субстанции составила 15,5 [13,0; 18,0] мм2 справа и 16,0 [14,0; 18,0] мм2 слева, а ширина III желудочка — 7,2 [5,6; 8,5] мм. Выявлены статистически значимые различия размеров площади ГЧС у пациентов с БП и размеров площади повышенной эхогенности черной субстанции у лиц группы контроля при сравнении групп с помощью критерия Манна — Уитни (p < 0,001). Также было установлено наличие статистически значимых различий (c2 = 86,85; p < 0,001) частоты встречаемости ГЧС у группы пациентов с БП и группы контроля.
При сопоставлении данных транскраниальной сонографии и результатов нейропсихологического тестирования у пациентов с БП установлены следующие клинико-ультразвуковые зависимости. Выявлена обратная корреляционная зависимость между суммарной площадью ГЧС и результатами нейропсихологического тестирования по всем применяемым шкалам: MMSE (rs = –0,34; р < 0,001), FAB (rs = –0,38; р < 0,001). Статистически значимая умеренная обратная корреляционная зависимость выявлена между шириной III желудочка и результатами нейропсихологического тестирования по всем применяемым шкалам: MMSE (rs = –0,57; р < 0,001), FAB (rs = –0,49; р < 0,001). Таким образом, чем больше была площадь ГЧС и ширина III желудочка, тем большая выраженность когнитивных нарушений была отмечена.
Для расчета оптимального порога разделения ширины III желудочка, позволяющего оценивать атрофические изменения мозга при когнитивных нарушениях у пациентов с БП и выявлять пациентов с наличием когнитивных нарушений, проведен ROC-анализ (рис. 4). Оптимальный порог разделения ширины III желудочка составил 7,4 мм (Se = 82,1 %, Sp = 77,8 %).
Расчет прогностической эффективности маркера оценивался с помощью площади AUC под ROC-кривой, которая составила 0,78 (95% ДИ 0,68–0,89; p = 0,001) и свидетельствовала о том, что выявленный нами нейровизуализационный критерий является хорошим классификатором.
Проведен анализ информативности транскраниальной сонографии для выявления когнитивных нарушений у пациентов с БП с помощью четырехпольной таблицы для оценки эффективности диагностических исследований (табл. 1). В качестве референтного теста использовались результаты нейропсихологического тестирования, а в качестве тестируемого метода — результаты транскраниальной сонографии. Отрицательным результатом нейропсихологического тестирования считалось отсутствие когнитивных нарушений при проведении нейропсихологического тестирования (MMSE — 28–30 баллов и FAB — 17–18 баллов), положительным результатом — наличие когнитивных нарушений по оценке результатов тестирования.
На основании данных табл. 1 произведен расчет операционных характеристик теста, позволяющих оценить эффективность транскраниальной сонографии как диагностического метода, которые представлены в табл. 2.
На основании рассчитанных показателей, представленных в табл. 2, можно сделать заключение, что транскраниальная сонография характеризуется высоким уровнем чувствительности (82,1 %), спе–цифичности (77,8 %) и диагностической точности (81,2 %) в выявлении когнитивных нарушений у пациентов с БП.
Обсуждение
В проведенном исследовании выявлены значимые клинико-сонографические зависимости, а именно между средней суммарной площадью ГЧС и балльной оценкой по всем когнитивным шкалам, а также между шириной III желудочка и всеми когнитивными шкалами, что позволяет использовать транскраниальную сонографию для оценки и объективизации когнитивных нарушений у пациентов с болезнью Паркинсона. В недавно опубликованной статье A. Bouwmans (2016) также получены данные о наличии зависимости между площадью гиперэхогенности черной субстанции и выраженностью когнитивных нарушений, а также между шириной III желудочка и выраженностью когнитивных расстройств у пациентов с болезнью Паркинсона и у пациентов с прогрессирующим надъядерным параличом [4]. В течение последних 2–3 лет появилось несколько исследований, раскрывающих новые диагностические возможности транскраниальной сонографии. В частности, F.A. Wollenweber с соавторами (2011) провели долгосрочное (в течение 5 лет) проспективное исследование с использованием транскраниальной сонографии 500 здоровых людей, которое показало, что ширина третьего желудочка у лиц с прогрессирующим когнитивным снижением была значимо больше, чем у людей без когнитивных расстройств [21]. В связи с этим Wollenweber высказал предположение, что расширение третьего желудочка, оцениваемое при транскраниальной сонографии, может являться маркером преклинической субартрофии головного мозга [21].
Выводы
Полученные нами результаты позволили обосновать применение транскраниальной сонографии, а именно определение ширины III желудочка, в качестве доступного, простого, неинвазивного и безопасного метода выявления церебральной атрофии при когнитивных нарушениях у пациентов с болезнью Паркинсона. Доказана высокая информативность транскраниальной сонографии с использованием нейровизуализационного критерия «расширение III желудочка свыше 7,4 мм» в выявлении церебральной атрофии, сопровождающейся когнитивными нарушениями у пациентов с БП.
Особо следует отметить, что транскраниальная сонография у пациентов с БП использовалась ранее только в качестве способа подтверждения БП при выявлении гиперэхогенности черной субстанции, нами предложено новое применение известного ранее метода ультразвукового исследования у пациентов с БП. Таким образом, в течение последнего десятилетия новый метод нейровизуализации — транскраниальная сонография находит все более широкое применение во всем мире для проведения научных исследований и в клинической практике, а согласно данным нашего исследования, может использоваться также для оценки атрофических изменений мозга при когнитивных нарушениях у пациентов с БП.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Власов В.В. Эффективность диагностических исследований / В.В. Власов. — М.: Медицина, 1988. — 256 с.
2. Иллариошкин С.Н. Течение болезни Паркинсона и подходы к ранней диагностике / С.Н. Иллариошкин // Болезнь Паркинсона и расстройства движений: рук. для врачей по материалам II Нац. конгр., Москва, 21–23 сент. 2011 г. / НЦ неврологии РАМН; Под ред. С.Н. Иллариошкина [и др.]. — М., 2011. — С. 41-47.
3. Федотова Е.Ю. Транскраниальная сонография в диагностике болезни Паркинсона: Автореф. дис… канд. мед. наук: 14.01.11; 14.01.13 / Е.Ю. Федотова; НЦ неврологии РАМН. — М., 2010. — 24 с.
4. Abnormal Echogenicity of the Substantia Nigra, Raphe Nuclei, and Third-Ventricle Width as Markers of Cognitive Impairment in Parkinsonian Disorders: A Cross-Sectional Study [Electronic resource] / A. Bouwmans [et al.] // Parkinsons Dis. — 2016. — Mode of access: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4737005/. — Date of access: 30.09.2016.
5. Berg D. Hyperechogenicity of the substantia nigra: pitfalls in assessment and specificity for Parkinson’s disease / D. Berg // J. Neural. Transm. — 2011. — Vol. 118, iss. 3. — P. 453-461.
6. Berg D. Transcranial sonography in movement disorders / D. Berg, J. Godau, U. Walter // Lancet Neurol. — 2008. — Vol. 7, iss. 11. — P. 1044-1055.
7. Brooks D.J. Parkinson’s disease: diagnosis / D.J. Brooks // Parkinsonism Relat. Disord. — 2012. — Vol. 18, iss. 1. — Р. 31-33.
8. Correlation between substantia nigra features detected by sonography and Parkinson disease symptoms / P. Bártová [et al.] // J. Ultrasound Med. — 2010. — Vol. 29, iss. 1. — P. 37-42.
9. Degeneration of substantia nigra in chronic Parkinson’s disease visualized by transcranial color-coded real-time sonography / G. Becker [et al.] // Neurology. — 1995. — Vol. 45, iss. 1. — P. 182-184.
10. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound / S. Behnke [et al.] // J. Neurol. Neurosurg. Psychiatry. — 2005. — Vol. 76, iss. 3. — P. 423-425.
11. Distinguishing Parkinson’s disease and essential tremor with transcranial sonography / M. Budisic [et al.] // Acta Neurol. Scand. — 2009. — Vol. 119, iss. 1. — P. 17-21.
12. Enlarged substantia nigrahyperechogenicity and risk for Parkinson disease: a 37-month 3-center study of 1847 older persons / D. Berg [et al.] // Arch. Neurol. — 2011. — Vol. 68, iss. 7. — P. 932-937.
13. Hyperechogenicity of the substantia nigra in Parkinson’s disease / P. Ressner [et al.] // J. Neuroimaging. — 2007. — Vol. 17, iss. 2. — P. 164-167.
14. Substantia nigra echogenicity is normal in non-extrapyramidal cerebral disorders but increase in Parkinson’s disease / U.J. Walter [et al.] // Neural. Transm. — 2002. — Vol. 109, iss. 2. — P. 191-196.
15. Transcranial brain parenchyma sonography in movement disorders: State of the art / U. Walter [et al.] // Ultrasound Med. Biol. — 2007. — Vol. 33, iss. 1. — P. 15-25.
16. Transcranial brain sonography findings in discriminating between parkinsonism and idiopathic Parkinson disease / U. Walter [et al.] // Arch. Neurol. — 2007. — Vol. 64, iss. 11. — P. 1635-1640.
17. Transcranial color-coded sonography helps differentiation between idiopathic Parkinson’s disease and vascular parkinsonism / C.F. Tsai [et al.] // J. Neurol. — 2007. — Vol. 254, iss. 4. — P. 501-507.
18. Transcranial sonography for diagnosis of Parkinson’s disease / S. Mehnert [et al.] // BMC Neurol. — 2010. — Vol. 10. — P. 9-16.
19. Transcranial sonography of substantia nigra in Japanese patients with Parkinson’s disease or atypical parkinsonism: clinical potential and limitations / M. Okawa [et al.] // Intern. Med. — 2007. — Vol. 46, iss. 18. — P. 1527-1531.
20. Vulnerability of the nigrostriatal system as detected by transcranial ultrasound / D. Berg [et al.] // Neurology. — 1999. — Vol. 53, iss. 5. — P. 1026-1031.
21. Width of the third ventricle assessed by transcranial sonography can monitor brain atrophy in a time- and cost-effective manner: results from a longitudinal study on 500 subjects / F.A. Wollenweber [et al.] // Psychiatry Res. — 2011. — Vol. 191, iss. 3. — P. 212-216.

/146-1.jpg )
/147-1.jpg )
/148-1.jpg )