Более 100 лет тому назад благодаря французскому терапевту Арману Труссо (1861 г.) и австрийскому дерматологу Гебра (1868 г.) в литературе появились сообщения о связи злокачественных опухолей и неонкологических заболеваний. Первые неврологические паранеопластические синдромы (ПНС) — периферическая невропатия у пациентов с солидным раком и бульбарными расстройствами при лимфосаркоме — были описаны Оппенгеймом еще в 1888–89 гг. Профессор М. Ауче в 1890 г. отметил связь между периферической нейропатией и раком; Д. Дени-Браун описал пациентов с сенсорной нейропатией и легочной карциномой. Термин «паранеопластический синдром», означающий синдром, сопутствующий опухоли, был предложен G. Boudin в 1961–62 гг. Guichard и Vignon (1949 г.) применили его при обсуждении дифференциальной диагностики у пациентов с нейропатиями, вызванными метастазами опухоли матки [12].
По определению Л.И. Дворецкого, паранеопластический синдром — клинико-лабораторное проявление злокачественной опухоли, обусловленное неспеци–фическими реакциями со стороны различных органов и систем или эктопической продукцией опухолью биологически активных веществ [4]. Согласно последним опубликованным данным [3], ПНС развиваются в 10–18,5 % случаев при мелкоклеточном раке легкого, яичников и молочной железы, толстой кишки, злокачественных лимфомах у лиц среднего и пожилого возраста. Наиболее часто используется классификация ПНС по системному признаку: эндокринные, нейромышечные или мышечно-скелетные, сердечно-сосудистые, дерматологические, гематологические, гастроэнтерологические, нефрологические, неспецифические, смешанные. Неврологические ПС включают поражения центральной и периферической нервной системы, нарушения нейромышечной передачи, вовлечение в процесс скелетных мышц [12, 16, 26]. Новые исследования в нейроонкологии привели к выделению классических и неклассических паранеопластических неврологических поражений (табл. 1).
/70-1.jpg )
Большинство авторов [1, 4, 6, 9, 19, 27] склонны считать, что ведущее место в патогенезе развития ПНС занимает иммунный механизм, в основе которого лежит ответная реакция на продукцию опухолью биологически активных веществ (полипептидов, факторов роста, интерлейкинов и др.) с формированием аутоиммунных и иммунных комплексов. Значительное место отводится образованию эктопических рецепторов в опухолевой ткани и блокированию действия нормальных (физиологических) гормонов [9, 27]. J. Wiley и соавт. полагают [27], что появление неврологических синдромов в рамках ПНС обусловлено иммунологическим механизмом антителообразования к антигенам, продуцируемым опухолью. В настоящее время известно около 30 паранеопластических антигенов, ассоциированных с поражением нервной системы у онкологических пациентов [6, 19, 24, 25, 27]. Антитела против подобных антигенов могут появляться в крови обследуемого задолго до того, как будет диагностирован органный рак, но наличие таких антител не обязательно приводит к развитию соответствующего неврологического ПНС. Обнаружение антител в цереброспинальной жидкости (ЦСЖ) и сыворотке крови пациентов является основой практических нейроонкологических диагностических тестов [6]. Согласно иммунным изменениям патогенетическая классификация ПНС различает антителопозитивные и антителонегативные синдромы [10].
Неврологические ПНС возникают в различные сроки развития онкологического заболевания. Клинические признаки ПНС, как правило, развиваются до появления симптомов опухоли или в тех случаях, когда опухоль имеет настолько маленький размер, что является излечимым заболеванием. Если ПНС являются предвестниками рака, клиническая картина пораженного органа протекает нетипично и предпринятая терапия часто не дает положительного результата [3]. К неврологическим ПНС относятся такие варианты, когда первичная локализация рака еще не определена, но есть неврологический дефицит, умеренно выраженные соматические жалобы и идентифицированные онкомаркеры [22]. Онкологическое и неонкологическое заболевание как паранеопластический процесс могут иметь и параллельное развитие [6]. Изучение клинических особенностей и иммунных механизмов послужило основой для разработки критериев диагностики ПНС.
Критерии диагностики пара–нео–пластического синдрома [12, 22]
Достоверный диагноз ПНС
1. Классический синдром (подострая сенсорная нейропатия, хроническая вегетативная нейропатия с желудочно-кишечной псевдообструкцией, поражение центральной нервной системы, нарушение нервно-мышечной передачи и мышц при онкологических заболеваниях) и злокачественное новообразование, проявляющееся в течение 5 лет после диагностики ПНС.
2. Неклассический синдром, который регрессирует или существенно улучшается после лечения злокачественного новообразования без сопутствующей иммунотерапии, притом что для данного синдрома не характерны спонтанные ремиссии.
3. Неклассический синдром с любыми онконевральными антителами и злокачественным новообразованием, которое проявляется в течение 5 лет после диагностики паранеопластической нейропатии.
4. Неврологический синдром (классический и неклассический) со специфическими онконевральными антителами (к антигенам Hu, Yo, CV2, Ma2, амфифизину) в отсутствие установленного злокачественного новообразования.
Вероятный диагноз ПНС
1. Классический синдром в отсутствие онконевральных антител или установленного злокачественного новообразования, но при высоком риске онкологического заболевания.
2. Паранеопластический синдром (классический или неклассический) с недостаточно изученными онконевральными антителами (к антигенам Tr, Zic4, mGluR1 и др.) в отсутствие установленного злокачественного новообразования.
3. Неклассический синдром в отсутствие онконевральных антител при наличии злокачественного новообразования, установленного в течение 2 лет после диагностики паранеопластической нейропатии.
В классификации неврологических ПНС представлены следующие формы поражения спинного мозга (СМ): 1) миелит; 2) некротическая миелопатия; 3) синдромы двигательного нейрона.
Миелит — воспалительное заболевание СМ, захватывающее часть его поперечника с поражением как серого, так и белого вещества. Этиология заболевания может быть различной: вирусный, параинфекционный, токсический, паранеопластический процесс, а также миелит при системных аутоиммунных процессах. В большинстве случаев при изолированном воспалении СМ причину заболевания выяснить не удается. К категориям поперечного миелита относят: острый парциальный поперечный миелит и острый полный поперечный миелит, продольный распространенный поперечный миелит. Острый парциальный поперечный миелит характеризуется асимметричным поражением СМ, не превышающим трех сегментов. Острый полный поперечный миелит сопровождается полным/почти полным неврологическим дефицитом ниже уровня повреждения СМ протяженностью не более трех сегментов. «Продольно распространенный поперечный миелит» (LETM — Longitudinally Extensive Transverse Myelitis) — относительно новый термин, под которым понимают идиопатический поперечный миелит. Наиболее частой формой LETM является оптиконейромиелит, при котором спинальные очаги характеризуются центральной локализацией, склонностью к слиянию и увеличением протяженности более чем на три сегмента в длину и более чем на 50 % площади поперечного среза [8]. Наиболее частая локализация подобного миелита — грудной отдел СМ. Доминируют двигательные спинальные нарушения: прогрессирующая спастическая параплегия сменяется вялым параличом в восходящем направлении. Расстройства чувствительности только вначале заболевания имеют диссоциированный, а затем приобретают тотальный характер. Они сопровождаются нарушениями функции тазовых органов (НФТО). Прогрессирование симптомов наблюдается в течение 2 недель. Со стороны ЦСЖ отмечается белково-клеточная диссоциация с легким/умеренным плеоцитозом. При нейровизуализации (магнитно-резонансная томография — МРТ) обнаруживается асимметричное или симметричное поражение трех или более спинальных сегментов СМ (при продольном распространенном миелите). Одним из наиболее важных диагностических тестов при оптиконейромиелите, чувствительность которого составляет 50–75 %, а специфичность — 90 %, является определение в крови антител к аквапорину-4 [5, 8].
/73-1.jpg )
Особым вариантом миелита является подострый некротический миелит, описанный Фуа и Алажуанином в 1926 г., который чаще наблюдается у людей пожилого возраста, нередко с хроническим легочным сердцем. Причиной этого миелита, как правило, служит тромбофлебит спинальных вен либо врожденная аномалия венозных сосудов СМ. Клиническая картина характеризуется нарастающим спастико-атрофическим парезом ног, вариабельными расстройствами чувствительности и тазовыми нарушениями. Поражение нижних отделов СМ и конского хвоста увеличивается в течение нескольких лет, постепенно распространяясь вверх. В ЦСЖ повышено содержание белка, однако при ликвородинамических пробах блокирование отсутствует. В крови отмечают увеличение скорости оседания эритроцитов (СОЭ) и лейкоцитоз со сдвигом формулы влево. Подострый некротический миелит почти никогда не диагностируется при жизни. Синдром спинального поражения, клинически не отличимый от подострого некротического миелита, может наблюдаться при паранео–пластической нейропатии, осложняющей висцеральную карциному. Сходную с миелитом картину могут давать злокачественные опухоли и спинальный инсульт.
Неопластические образования в СМ могут быть первичными опухолями и метастазами. Метастатические опухоли, вызывающие компрессию СМ, встречаются у пациентов (3–7,4 %), страдающих раком молочной железы, легких, предстательной железы. Источником метастазов также могут стать лимфомы, саркомы, опухоли яичка, рак почки, желудка, кишки, миеломная болезнь. Обычно опухоль, сдавливающая СМ, прорастает из позвонков, пораженных метастазами, и почти всегда располагается в экстрадуральном пространстве. Опухоли, вызывающие компрессию СМ, обнаруживают в грудном отделе позвоночника у 59–78 % пациентов, пояснично-крестцовом — у 16–33 %, шейном — у 4–15 %, примерное соотношение отделов составляет 4 : 2 : 1. У 25–49 % пациентов отмечаются множественные поражения позвонков [11]. Первым клиническим проявлением компрессии СМ у большинства пациентов являются боль в спине и/или корешковые боли. Локальная боль в спине обычно тупая, ноющая и локализируется в пределах нескольких сегментов. Корешковая боль может быть постоянной или возникать при движении. Болевой синдром часто усиливается при кашле, напряжении, поворотах шеи, в положении на спине. Дальнейшее сдавление СМ обычно проявляется слабостью преимущественно в проксимальных отделах ног и/или нарушением чувствительности в виде парестезий, сенситивной атаксией, которые возникают через недели или месяцы после начала болей. Пациент начинает жаловаться на трудности при вставании с низкого стула, унитаза или при ходьбе по лестнице. Тазовые нарушения обычно присоединяются позднее, однако при компрессии conus medullaris (метастазы в позвонки ТX–LI) нарушения мочеиспускания могут быть первым и единственным симптомом.
Частота интрамедуллярных опухолей среди пациентов всех возрастов составляет 10–18 % от общего числа опухолей СМ [8]. Боль в спине не столь типична. Опухоль, как правило, поражает несколько спинальных сегментов. Клиническая картина таких опухолей СМ развивается достаточно медленно, и на первое место выходят прогрессирующие двигательные расстройства, а чувствительные нарушения, согласно закону эксцентрического расположения длинных проводников, распространяются сверху вниз [17]. В случае кровоизлияния или инфаркта в опухоль симптомы могут развиться остро и имитировать острый поперечный миелит. МРТ регистрирует очаг, захватывающий несколько сегментов СМ, изо- или слабогипоинтенсивный в Т1-взвешенном изображении (ВИ), с неоднородным усилением сигнала от очага в Т2-ВИ. Типичны перифокальный отек, инфильтративный рост, увеличение в размерах СМ, чаще с неровными бугристыми краями. При введении контрастного вещества типично персистирующее накопление контраста, сохраняюще–еся месяцами, несмотря на лечение [7, 23]. Интрамедуллярные метастазы встречаются крайне редко, у 1–2 % больных с раком легких, молочной железы, почки, при меланоме [2]. Боль в спине чаще всего служит первым, хотя и не обязательным симптомом интрамедуллярного метастаза, вслед за ней развиваются нарастающий спастический парапарез и парестезии. Диссоциированное расстройство чувствительности наблюдается редко, обычно отмечаются асимметричный парапарез и частичная утрата чувствительности. При миелографии, компьютерной томографии (КТ) и МРT выявляется отечный СМ без признаков внешней компрессии; почти у 50 % пациентов КТ и миелография показывают нормальную картину.
В отдельных случаях спинальная симптоматика может быть обусловлена сосудистыми нарушениями ишемического типа вследствие сдавления опухолью корешковых и передней спинальной артерий, обычно на нижнем шейном или грудном уровнях. Апоплектиформное поражение СМ, обусловленное метастазом, обычно развивается на фоне анемии и резкого увеличения скорости оседания эритроцитов. Спондилограммы во многих случаях не выявляют деструкции при метастазах в позвоночник, и их роль в диагностике невелика. Подтверждается метастатическое поражение обнаружением висцеральной карциномы. Клиническая картина инфаркта СМ соответствует острому поражению передних отделов спинного мозга [21]: внезапно, на протяжении нескольких минут, развиваются центральный нижний парапарез (иногда — монопарез ноги), который в острой фазе заболевания может быть вялым, но спустя несколько недель трансформируется в спастический; задержка мочеиспускания, которая постепенно переходит в недержание мочи; снижение болевой и потеря температурной чувствительности. Тактильная и вибрационная чувствительность, способность локализовать раздражитель остаются сохранными. Нередко наблюдаются корешковые боли, соответствующие верхнему уровню поражения. На МРТ выявляется пролонгированный карандашеобразный очаг в передних отделах СМ.
«Миелопатия» — термин, применяемый для обозначения подострых и хронических поражений СМ, обусловленных различными патологическими процессами (вертеброгенный, атеросклеротический, посттравматический, интоксикационный, воспалительный, компрессионный, канцероматозный, радиационный, диабетический и др.). Спондилогенная миелопатия представляет собой хроническое ишемическое поражение СМ, связанное с компрессией его сосудов и структур при дистрофических изменениях позвоночника: остеохондрозе, спондилезе, спондилоартрозе. Этиологическими факторами хронической миелоишемии, помимо остеохондроза дисков, могут быть: атеросклероз аорты и ее ветвей, травма, гормональная спондилопатия, врожденный стеноз, хронический спаечный процесс и др. Спондилогенная миелопатия была впервые описана в 1952 г. W.R. Brain, D. Northfield, M. Wilkinson. Клиническая картина этого заболевания, характеризующегося чрезвычайным разнообразием, обусловлена выраженностью спондилогенных компримирующих факторов, компенсаторными возможностями СМ и состоянием его кровоснабжения. К особенностям клинической картины спондилогенной миелопатии относятся:
1) моторно-сенсорная диссоциация, когда на первый план выступают двигательные нарушения (преимущественно спастические или спастико-атрофические парезы; вялые парезы встречаются в 2 раза реже);
2) развитие синдрома бокового амиотрофического склероза или синдрома рассеянного склероза при дисгемии бассейна a. spinalis anterior; синдрома сирингомиелии или фуникулярного миелоза — в бассейне
aa. shinalis posterior; псевдотуморозного синдрома — в бассейне вертебральных и корешковых артерий;
3) полиморфные чувствительные расстройства: проводниковые, корешково-сегментарно-диссоциированные, полиневритические, мозаичные;
4) негрубые нарушения функции тазовых органов развиваются у 1/3 больных с цервикальной и 1/2 — с поясничной миелопатией;
5) наличие предвестников в виде преходящих двигательных, чувствительных или тазовых расстройств (миелогенная парестезия или симптом «электрического тока» Лермитта, миелогенной перемежающейся хромоты);
6) относительно доброкачественное, медленно прогрессирующее течение.
Дифференциальная диагностика спондилогенной миелопатии должна проводиться с различной спинальной патологией, но в практической неврологии наиболее часто приходится дифференцировать ее от следующих заболеваний, имитирующих компрессию спинного мозга [13]:
1. Инфаркт спинного мозга.
2. Поперечный и восходящий миелит (оптикомиелит Девика, вирусный миелит, рассеянный склероз).
3. Спирохетозы (сифилис, болезнь Лайма).
4. Метаболические миелопатии (тиреотоксическая, миелопатия при гормональной спондилопатии, патологии печени).
5. Паранеопластическая некротическая миелопатия.
6. Нейрональные дегенерации (атаксия Фридрейха, болезнь Шарко — Мари — Тута).
7. Аутоиммунные заболевания (синдром Съегрена).
Миелопатии при злокачественных заболеваниях в большинстве случаев являются компрессионными. Однако если с помощью радиологических исследований не удается обнаружить блокирование, то часто сложно бывает разграничить интрамедуллярные метастазы, паракарциноматозную и лучевую миелопатии. У пациента с диагностированным раком и прогрессирующей миелопатией, некомпрессионный характер которой подтвержден с помощью миелографии, КТ или МРТ, наиболее вероятен интрамедуллярный метастаз; реже в такой ситуации встречается паранеопластическая миелопатия. Развитие паранеопластической миелопатии наблюдается при мелкоклеточном раке легких, раке молочной железы и яичника [23]. Паранеопластические процессы являются редкими, но важными диагностическими вариантами при оценке миелопатии, потому что неврологические симптомы могут предвещать диагноз рака. При МРТ-ВИ-T2, иногда с усилением гадолинием, характерно выявление обширного симметричного сигнала изменений СМ [20]. Особые диагностические затруднения может вызвать диагностика лучевой миелопатии, которая нередко развивается через значительный временной интервал (до 15 лет) после проведения лучевой терапии на область позвоночника и медленно прогрессирует. На МРТ вначале могут обнаруживаться отек СМ и очаги, накапливающие контрастное вещество, позднее развиваются атрофия СМ, поражение прилежащих позвонков [23].
Подострая некротическая миелопатия описана при раке предстательной железы, легкого, почки, лимфоме [11]. Миеломаляция характеризуется развитием некроза в центральной части грудного отдела СМ (без метастазов), распространяющегося на несколько соседних выше- и нижележащих сегментов. Вначале клиническая картина часто имитирует синдром Броун — Секара. Вслед за болью в спине развиваются асимметричные двигательные нарушения; им сопутствуют парестезии в дистальных отделах конечностей, распространяющиеся вверх до формирования уровня чувствительных расстройств, и позднее — дисфункция мочевого пузыря. В ЦСЖ наблюдается увеличение концентрации белка. При проведении миелографии, КТ и МРТ выявляется отечный спинной мозг без признаков внешней компрессии, но почти у 50 % пациентов нейровизуализация не определяет патологии. Диагноз может быть установлен только после исключения эпидуральной компрессии СМ и интрамедуллярных метастазов. Дифференциальная диагностика должна проводиться с рассеянным склерозом, инфарктом спинного мозга, вирусным и инфекционным миелитом, миелопатией при коллагенозах.
Карциноматозная миелопатия обусловлена влиянием опухоли и воздействием синтезируемых ею биологически активных веществ, что приводит к изменениям спинномозговых структур. Клинический симптомокомплекс напоминает неврологические нарушения при амиотрофическом боковом склерозе (АБС), поэтому некоторые авторы относят этот вид миелопатии к особой форме этого заболевания. Вопрос о рассмотрении синдрома двигательного нейрона в группе паранеопластических неврологических расстройств остается спорным. Паранеопластическая болезнь моторного нейрона описана при лимфоме, тимоме, мелкоклеточном раке легкого, раке молочной железы и характеризуется подострым прогрессирующим течением, отсутствием болей, часто локальной и асимметричной слабостью по типу поражения нижнего мотонейрона (атрофия, фасцикуляции, снижение рефлексов) с вовлечением ног в большей степени, чем рук. Однако у некоторых больных наблюдаются признаки поражения верхнего мотонейрона (гиперрефлексия, симптом Бабинского, клонусы). По своей клинической картине заболевание напоминает АБС. Неврологическая картина ограничивается преимущественно двигательными расстройствами при минимальной чувствительной дисфункции. В ЦСЖ наблюдают умеренное повышение белка. Болезнь прогрессирует независимо от состояния опухоли и имеет тенденцию к относительно мягкому течению. Дифференцируют паранеопластическую болезнь моторного нейрона с лептоменингеальными метастазами, плексопатиями, обусловленными опухолями, синдромом Гийена — Барре [11].
Приводим наш клинический случай. У пациента Т., 62 лет, в ноябре — декабре 2014 г. появились боли в коленных суставах и незначительная слабость в правой ноге, затем в марте 2015 г. присоединились опоясывающие боли в груди. Проведенное обследование выявило онкологическое образование левой почки, и в мае 2015 г. он оперирован по поводу карциномы. Через месяц после операции отметил увеличение слабости в ногах и появление нарушений функции тазовых органов (НФТО — учащенные позывы к мочеиспусканию, ощущение неполного опорожнения мочевого пузыря). На протяжении последующих 8 месяцев пациент неоднократно (5 госпитализаций) обследовался и лечился в неврологических и онкологическом стационарах г. Минска по поводу подострого миелита на грудном уровне спинного мозга с наличием нижнего спастического проксимального умеренного парапареза, НФТО, артериальной гипертензии II степени, риск 3, Н-0. Проводились следующие обследования: нейровизуализация (МРТ и КТ) спинного мозга в динамике, КТ брюшной полости с болюс–ным усилением, КТ органов грудной клетки, сцинтигра–фия скелета с Тс-99m, исследование онкомаркеров в ЦСЖ. Данных по рецидиву опухоли почки не было выявлено, секундарные изменения позвоночника и спинного мозга были исключены.
Стационарное лечение в неврологическом отделении № 2 РНПЦ ННХ РБ 23.06–6.07.2015 г. (через полгода от появления первых очаговых симптомов). Неврологический статус: сознание ясное, ориентирован. Менингеальных знаков нет. Черепные нервы — без особенностей. Вызывается хоботковый рефлекс. Сила в руках достаточная, в ногах проксимально справа 3 балла, слева — 3,5–4 балла, сгибателях, разгибателях голени справа 3 балла, слева — 5 баллов, дистально — 5 баллов. Мышечный тонус не изменен. Глубокие рефлексы с верхних конечностей, D ≥ S, с нижних конечностей коленные и ахилловы рефлексы высокие, D = S, клонус стоп, более выраженный справа. Рефлекс Бабинского с 2 сторон. Снижение поверхностной чувствительности от уровня паховой складки, путает счет пальцев на правой стопе. Координаторные пробы выполняет удовлетворительно. В позе Ромберга устойчив. Походка спастико-паретическая. НФТО: задержка стула, императивные позывы к мочеиспусканию. Лечение с использованием внутривенного иммуноглобулина (180 г на курс), кортикостероидов, нестероидных противовоспалительных средств, антибиотиков — без эффекта.
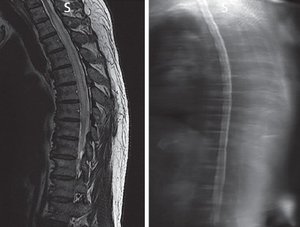
МРТ от 24.06.2015 г. грудного отдела позвоночника, МРТ-миелография в РНПЦ ННХ: МРТ грудного отдела позвоночника на уровне Th1-12 костно-деструктивных изменений не наблюдается. Дегенеративные изменения позвоночника на уровне Th8–11. Сагиттальный диаметр позвоночного канала на уровне Th8 — 15 мм. Признаков компрессии дурального мешка нет. Спинной мозг на уровне Th1-9 несколько расширен в поперечнике, участок накопления контраста без четких контуров на уровне Th1-9 позвонка размером 5 × 11 мм. Заключение: МР-признаки воспалительного процесса в грудном отделе СМ (рис. 1).
/74-1.jpg )
Стационарное лечение через 7 месяцев в неврологическом отделении 5-й ГКБ г. Минска с 18.02.2016 г. Невро–логический статус при поступлении: сознание ясное, ориентирован, несколько эйфоричен. Менингеальных знаков нет. Черепные нервы без особенностей. Сила мышц в верхних конечностях сохранена. В нижних конечностях — асимметричный проксимальный спастический парапарез: сила снижена до 2 баллов справа и 4 баллов слева; в дистальных отделах — 4–5 баллов. Сухожильные рефлексы с нижних конечностей высокие, D = S, клонусы стоп с преобладанием справа. Брюшные рефлексы не вызываются. Рефлексы Бабинского, Пуссепа, Россолимо положительны с 2 сторон. Патологических кистевых знаков нет. Сегментарное расстройство болевой чувствительности (гиперестезия) с уровня Th7-10, диссоциированная проводниковая болевая парагипестезия с уровня Th10-12 и температурная гипестезия только слева. Задержка мочеиспускания (катетеризация мочевого пузыря). Передвигается с помощью ходунков. Показатели клинических и биохимических анализов крови, анализа мочи, ЭКГ сохраняются в пределах нормы. КТ головного мозга от 02.03.2016 г. — без патологии. Исследование онкомаркеров в ЦСЖ — отрицательный результат.
Диагноз: рак левой почки (С64.9). Состояние после резекции почки (15.05.2015 г.), стадия T1aN0M0.1. Подострая паранеопластическая миелопатия с умеренным нижним проксимальным спастическим парапарезом, диссоциированной проводниковой болевой парагипестезией с уровня Th10-12 и левосторонней температурной гипестезией, НФТО (задержка мочеиспускания, катетеризация мочевого пузыря). Сопутствующий диагноз: ишемическая болезнь сердца: атеросклеротический кардиосклероз, атеросклероз аорты, Н1. Артериальная гипертензия II степени, риск 4.
Обоснование диагноза: появление неврологической симптоматики (нарушение походки из-за слабости в правой ноге) предшествовало диагностике карциномы левой почки. На протяжении 6–8 месяцев отмечалось постепенное развитие очаговых симптомов поражения спинного мозга с преобладанием двигательных нарушений в нижних конечностях, присоединением проводниковых чувствительных расстройств и нарушений функции тазовых органов. При нейровизуализации СМ было выявлено его увеличение в размерах на протяжении всего грудного отдела, сохраняющееся месяцами, несмотря на лечение миелита кортикостероидами и внутривенным иммуноглобулином. В ЦСЖ наблюдалось увеличение белково-клеточной диссоциации до 1,0 г/л. Заболевание имело непрерывно прогрессирующее течение с отрицательной динамикой.
Диагностика поражений спинного мозга должна базироваться на комплексном использовании современных технологий нейровизуализации и специальных исследованиях ликвора и крови, что создает необходимую основу для принятия решения о характере патологического процесса. ПНС остаются диагнозом исключения. Однако выявление специфических антител позволяет его подтвердить и заставляет проводить более целенаправленный поиск возможной опухоли. Большинство ПНС плохо поддаются лечению, тем не менее следует предпринять попытку лечения иммуносупрессорными средствами, применить плазмаферез или внутривенный иммуноглобулин.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Алексеева О.П. Паранеопластические синдромы в клинике внутренних болезней: Учеб. пособие / О.П. Алексеева, З.Д. Михайлова. — Н. Новрогод: Изд-во Нижнегород. госмедакадемии, 2008. — 112 с.
2. Белова А.Н. Дифференциальная диагностика очаговых некомпрессионных поражений спинного мозга шейно-грудной локализации / А.Н. Белова, И.В. Шаленков // Практическая медицина. Неврология. Лекции для практикующих врачей. — Н. Новгород: Изд-во НГМА. — 1(13).
3. Генс Г.П. Паранеопластический синдром и рак легкого: клинический случай / Г.П. Генс, В. Аниканова, А.Г. Малявин // Cons. Med. Болезни органов дыхания. — 2014. — 1. — С. 36-40.
4. Дворецкий Л.И. Паранеопластические синдромы // Cons. Med. — 2003. — 3(3). — С. 46-49.
5. Евдошенко Е.П. Рецидивирующий распространенный поперечный миелит, ассоциированный с антителами к аквапорину-4 / Е.П. Евдошенко, Л.Г. Заславский, С.В. Лапин // Неврол. журн. — 2011. — 3. — С. 34-38.
6. Евтушенко С.К. Паранеопластические неврологические синдромы (клиника, диагностика и возможности лечения) // МНЖ. — 2011. — 8(46).
7. Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиология / В.Н. Корниенко, И.Н. Пронин. — Т. 3. — М., 2009. — 325 с.
8. Прахова А.Н. Возможности комплексного диагностического обследования при проведении дифференциальной диагностики воспалительных и опухолевых поражений спинного мозга (два клинических наблюдения) / А.Н. Прахова, Ж.И. Савинцева, А.Ф. Гурчин (и др.) // Журн. неврол. и психиатр. — 2012. — 2(9). — С. 87-94.
9. Трошин В.Д. Паранеопластическая неврология / В.Д. Трошин, А.В. Алясова, И.Г. Терентьев. — Н. Новгород: Изд-во НГМА, 2010. — 214 с.
10. Шакирова И.Н. Паранеопластические синдромы // Журн. неврол. и психиатр. — 1999. — 10(99). — С. 55-62.
11. Шакирова И.Н. Метастатические поражения нервной системы / И.Н. Шакирова, И. Фокина // Врач. — 2006. — 5. — С. 20-24.
12. Шнейдер Н.А. Клиническая гетерогенность паранео–пластического неврологического синдрома / Н.А. Шнейдер, Ю.А. Дыхно, В.В. Ежина // Сибирский онкологический журн. — 2011. — 43(45). — С. 82-90.
13. Цеменетис С.А. Дифференциальная диагностика в неврологии и нейрохирургии / Под ред. Е.И. Гусева. — М.: ГЭОТАР-Медиа, 2005. — 368 с.
14. Dalmau J., Rosenfeld M.R. Paraneoplastic syndromes of the CNS // Lancet Neurol. — 2008. — 7(4). — С. 327-340.
15. Dalmau J., Rosenfeld M.R. Update on paraneoplastic neurologic disorders // Oncologist. — 2010. — 15(6). — С. 603-617.
16. Darnell R.B., Posner J.B. Paraneoplastic syndromes affecting the nervous system // Semin. Oncol. — 2006. — 33(3). — С. 270-98.
17. Ebner F.H. Management of intramedullary spinal cord lesions: interdependence of the longitudinal extension of the lesion and the functional outcome / F.H. Ebner, F. Roser, M. Falk, S. Hermann, J. Ho–negger, M. Tatagibа // Eur. Spine. J. — 2010. — 4(19). — С. 665-69.
18. Eckstein C., Syc S., Saidha S. Differential diagnosis of longitudinally extensive transverse myelitis in adults // ENJ. — 2011. — 3(1). — Р. 27-39.
19. Ferlito A. Paraneoplastic neurologic in patients with primary bread and neck cancer // Eur. Arch. Otorinolaryngol. — 2007. — 264. — С. 211-12.
20. Flanagan E.P. Paraneoplastic myelopathy / E.P. Flanagan, B.M. Keegan // Neurol. Clin. — 2013. — 31(1). — Р. 307-18.
21. Frohman E. Transverse Myelitis / E. Frohman, D. Wingerchuk // N. Engl. J. Med. — 2010. — 363. — Р. 564-72.
22. Graus F. Recommended diagnostic criteria for paraneoplastic neurological syndromes / F. Graus et al. // Neurol. Neurosurg. Psychiatry. — 2004. — Р. 1135-40.
23. Jacob A. An approach to the diagnosis of acute transverse myelitis / A. Jacob, B.G. Weinshenker // Semin. Liver. Dis. — 2008. — 1(28). — Р. 105-20.
24. Paraneoplastic anti-CV2 antibodies react with peripheral nerve and are associated with a mixed axonal and demyelinating peripheral neuropathy / J.C. Antoine et al. // Ann. Neurol. — 2001. — 2(49). —Р. 214-21.
25. Pelkofer H. Modelling paraneoplastic CNS disease: T-cells specific for the onconeuronal antigen PNMA1 mediat autoimmune encephalomyelitis in the rat / H. Pelkofer et al. // Brain. — 2004. — 127. — Р. 1822-30.
26. Rees J.H. Paraneoplastic syndromes: when to suspect, how to confirm, and how to manage // J. Neurol. Neurosurg. Psychiatr. — 2004. — 75(2). — Р. 43-50.
27. Wiley J. Onconeural antibodies in patients with neurological symptoms: detection and clinical significance // Acta Neurol. Scand. — 2011. — 191. — Р. 83-8.

/70-1.jpg )
/73-1.jpg )
/74-1.jpg )