Введение
Шило-каротидный (или шиловидно-каротидный) синдром (ШКС), возникающий в результате увеличения длины или аномального положения шиловидного отростка (ШО) в парафарингеальном пространстве, является редкой причиной инфарктов мозга. Каротидная диссекция в результате ШКС недостаточно изучена и крайне мало представлена в неврологической литературе. Зарубежные исследования также немногочисленны и опубликованы в нескольких десятках печатных работ, из которых во многих делается акцент на нецеребральных проявлениях. Вторичная профилактика инсульта при ШКС, применяемая за рубежом, свидетельствует об эффективности хирургического лечения. К сожалению, эта методология для цереброваскулярной патологии в нашей практике не применяется. Неосведомленность неврологов приводит к поздней диагностике, а в большинстве случаев — к неправильной трактовке этиологии инсульта в молодом возрасте.
Цель исследования: провести анализ роли ШКС в патогенезе экстракраниальной диссекции внутренней сонной артерии (ВСА) с развитием острых цереброваскулярных нарушений.
Материалы и методы
За последние 6 лет нами диагностировано два случая инфарктов мозга у молодых женщин (26 и 28 лет) в результате ШКС, осложнившегося диссекцией ВСА в шейном отделе. В работе приводится описание одного из собственных наблюдений (методология case report), а также дан анализ имеющихся публикаций по теме. Верификация каротидной диссекции у нашей пациентки проведена с использованием магнитно-резонансной томографии (МРТ) (аппарат Philips 1,5 Т) и спиральной компьютерной томографии (СКТ) головного мозга (аппарат GE LightSpeed Pro32, автоматический шприц-инжектор Ohio system, Ulrich medical). Анатомо-топографические характеристики ШО получены при КТ-ангиографии шеи и 3D-реконструкции изображений.
Результаты и обсуждение
Приоритет в установлении значения удлиненного ШО в этиологии специфической клинической патологии принадлежит американскому оториноларингологу W.W. Eagle [10]. Еще в 1937 г. он описал 2 пациентов с лицевой болью, которую объяснил воздействием ШО и связанных с ним структур на прилежащие образования. С тех пор в мировой литературе эта патология обозначается как синдром Игла (или синдром Эгла, по некоторым транскрипциям). W.W. Eagle выделил 2 клинических варианта: классический шиловидный (синонимы: шилоподъязычный, stylalgia) и ШКС [10, 11]. Несколько ранее A.W. Sterling и C.A. Thigpen отмечали роль ШО в появлении болей в горле, а T. Dwight описал несколько случаев оссификации шиловидного комплекса [9, 34, 35].
Удлинение ШО является достаточно частой анатомической особенностью, распространение которой в популяции составляет в среднем 4 %. Интересным является факт, что симптоматика (локальная или цереброваскулярная) развивается лишь у 4–10,3 % носителей, у подавляющего большинства увеличенные ШО не имеют клинического значения [19, 28]. Синдром Игла редко наблюдается у лиц младше 30 лет, случаи у детей единичны [25].
Предваряя клиническую характеристику синдрома Игла, следует дать краткую анатомо-топографическую характеристику ШО. Это отросток пирамиды височной кости, который имеет коническую, реже — цилиндрическую форму и расположен спереди сосцевидного отростка; своей верхушкой он направлен каудомедиально. Единого мнения по поводу размеров ШО в литературе нет. W. Eagle определил нормальную длину ШО как 25 мм, другие авторы относят к норме длину до 40 мм и даже больше, но в большинстве публикаций верхней
границей нормы считается 30 мм [19, 22]. В своем анализе мы опирались на результаты, полученные при
изучении российской популяции: средняя длина ШО составила 27,40 ± 0,34 мм (у мужчин — 28,50 ± 0,42 мм,
у женщин — 25,30 ± 0,56 мм) при крайних значениях вариационного ряда от 7 до 70 мм [3]. Выраженными индивидуальными различиями характеризовались также величины углов медиального отклонения от вертикали и диаметры ШО. Наиболее часто наблюдались средние (20–29°) и малые углы отклонения (8–19°), а средние размеры диаметров составили 3–4 мм. В целом углы отклонения у женщин больше, а сами отростки тоньше, чем у мужчин. Вариабельность длины, формы и пространственного расположения обусловливают особенности анатомо-топографических взаимодействий ШО с окружающими структурами. Показано, что ШО длиной 30 мм и углом медиального отклонения 22° расположен латерально на расстоянии 6–11 мм от боковой стенки глотки, позади него на расстоянии 5–7 мм залегают ВСА, языкоглоточный и подъязычный черепные нервы (ЧН) [3]. В непосредственной близости от указанных структур расположены также внутренняя яремная вена, лицевой, блуждающий, добавочный ЧН.
К ШО крепятся 3 мышцы, иннервируемые разными нервами: m.styloglossus, иннервируемая XII ЧН; m.stylopharyngealis, иннервируемая IX ЧН; m.stylohyoideus, иннервируемая VII ЧН, и 2 связки — l.stylohyoideus, l.stylomandibularis [32]. Отдельной структурой выделяется шиловидный комплекс, включающий ШО, шилоподъ–язычную связку и малый рог подъязычной кости. Анатомически важно, что ШО либо шилоподъязычная связка расположены между наружной сонной артерией и ВСА.
Воздействие ШО или шиловидного комплекса на соседние структуры зависит от длины и степени искривления: чем он длиннее и больше искривлен, тем меньший угол отклонения необходим для его контакта с окружающими образованиями [3]. Как показано автором, верхушка отростка длиной 30 мм соприкасается с боковой стенкой глотки при угловом отклонении 35–40°; отросток длиной 40 мм, направленный под углом 28–30°, оказывает давление на шилоглоточную мышцу и выходящий из-под нее IX ЧН, а его верхушка достигает боковой стенки глотки на уровне середины небной миндалины. При искривлении верхушка ШО может оказывать давление на ВСА. Вместе с тем даже значительно удлиненный ШО (до 60 мм) не соприкасается с соседними анатомическими структурами, если его угол медиального отклонения не превышает 20–21°.
Специфической особенностью строения ШО является наличие в нем остатков эмбрионального хряща даже у лиц зрелого возраста. В ряде случаев наблюдаются процессы пролиферации хрящевой ткани и остео–генеза в ШО. Длительное сохранение эмбрионального хряща, пери- и эндохондральное новообразование костной ткани в отростках считается причиной удлинения ШО у взрослых людей. Другим механизмом формирования увеличенных ШО является оссификация шилоподъязычной связки. Описана казуистическая патологоанатомическая находка (на трупе мужчины) в виде отсутствия шилоподъязычной связки и удлинения одного из ШО вплоть до подъязычной кости [3].
Классический шилоподъязычный синдром не имеет цереброваскулярных проявлений. Его возникновение чаще всего связано с тонзиллэктомией либо фарингеальной травмой. Наиболее частыми симптомами являются постоянная тупая односторонняя шейно-лицевая либо глоточно-лицевая боль и чувство инородного тела в горле («застрявшая рыбная, куриная косточка», «больное горло»), однако при поворотах головы и глотании боль может быть резкой, прокалывающей. Описаны также спонтанные либо спровоцированные указанными факторами болевые атаки. Могут наблюдаться шум/звон в ухе, иррадиация боли в височную либо теменную область, глаз, нижнечелюстной сустав, область подъязычной кости, ухо. Кроме указанной симптоматики реже отмечаются гиперсаливация, дисфазия и изменение голоса, дисфагия (иногда преходящая), нарушение чувствительности и вкуса на задней трети языка [3, 21, 23, 32]. Семиологию шилоподъязычного
синдрома объясняют воздействием шиловидного комплекса либо спазмированной шилоглоточной мышцы на прилежащие каудальные ЧН. В частности, описан случай языкоглоточной невралгии в рамках синдрома Игла [21]. Распределение отдельных симптомов при шилоподъязычном синдроме проанализировано в работе J.R. Gossman, J.J. Tarsitano: жалобы на горло предъявляли 80 % пациентов (чувство инородного тела — 55 %, боли — 40 %), оталгия наблюдалась у 40 %, цефалгия — у 25 %, каротидиния — у 20 %, боли в области височно-нижнечелюстного сустава — у 10 %, языкоглоточная невралгия — у 10 %, лицевая боль — у 5 % [14].
Клиническим диагностическим тестом является интраоральная пальпация увеличенного ШО в тонзиллярной ямке (при нормальной длине он, как правило, не пальпируется), провокация симптомов при этом исследовании, а также их исчезновение либо уменьшение после блокады 2% раствором лидокаина. Предложен аналогичный тест с экстраоральной пальпацией: ниже угла нижней челюсти на 2,5 см c легким краниальным направлением воздействия [17]. Подтверждение диагноза шилоподъязычного синдрома требует выполнения компьютерной томографии либо панорамной рентгенографии челюстей, которые позволяют визуализировать размеры и топографию ШО у пациента [13, 18, 24].
Лечение шилоподъязычного синдрома может быть консервативным и хирургическим. При консервативном лечении в зависимости от наблюдаемой симптоматики показано назначение анальгетиков, антиконвульсантов, антидепрессантов, а также локальное введение стероидов либо анестетиков (блокады). Большинство зарубежных публикаций содержат описания успешного хирургического лечения этой патологии [5, 13, 24].
Вторым вариантом синдрома Игла является ШКС. Его симптоматика весьма многообразна: от бессимптомного течения, нетипичных шейно-лицевых болей с распространением по каротидной территории, синкопальных состояний, системного головокружения, до случаев каротидной диссекции с развитием острых цереброваскулярных осложнений (транзиторных ишемических атак (ТИА), инсультов) и даже внезапной смерти в результате вагусиндуцированной кардиодепрессии [6, 7, 12, 29, 33, 37]. Клинические проявления ШКС связаны в основном с возникновением «шило-каротидного конфликта», при котором удлиненный ШО компремирует расположенные рядом артерии (ВСА либо наружную сонную артерию) или вызывает ирритацию периартериального симпатического сплетения и других анатомических образований парафарингеального пространства.
Симптомы локального воздействия ШО могут быть аналогичными описанным при классическом шилоподъязычном синдроме, однако отмечается иррадиация болей по каротидной территории: при воздействии на ВСА описана головная (чаще в теменной области) и супраорбитальная боль, при вовлечении наружной сонной артерии — лицевая боль ниже глаза и боль в затылке. Кроме того, каротидная компрессия ШО либо шиловидным комплексом может сопровождаться болевой иррадиацией в мышцы шеи, лицо, горло, язык, краниальные зоны (теменную и височную) [32]. При возникновении шило-каротидного конфликта с крат–ковременной компрессией ВСА, например, при поворотах головы в проблемную сторону, кроме описанных симптомов может появиться очаговая неврологическая симптоматика. В 2004 г. был опубликован случай развития ТИА у 36-летнего пациента с анамнезом непостоянной тупой боли в шее в течение 10 дней после небольшой травмы. Выполненное ультразвуковое исследование (УЗИ) брахиоцефальных артерий продемонстрировало компрессию ВСА после поворота головы. КТ шеи и КТ-ангиография магистральных артерий выявили удлиненный ШО, конец которого воздействовал на ВСА, вызывая ее стеноз [15]. Американскими авторами описаны повторные ТИА в течение 1 года у пациента 77 лет, проявляющиеся афазией, онемением и слабостью в правой руке. Симптоматика появлялась через 15 секунд после поворота головы влево —
вниз и исчезала через 5 секунд после возвращения в нейтральную позицию (голова прямо). Выполнение КТ шейного отдела, дополненного функциональной КТ-ангиографией, позволило установить компрессию левой ВСА оссифицированным шиловидным комплексом с резким снижением кровотока в ней при повороте головы в проблемную сторону. Проведенное хирургическое лечение позволило полностью избавить пациента от преходящего церебрального дефицита [7].
Диссекция ВСА в результате шило-каротидного конфликта была описана еще в конце прошлого века [37]. Опубликованные случаи диссекции ВСА при ШКС возникали у пациентов после резкого поворота шеи либо при форсированных движениях головой. В одном из описаний 45-летняя пациентка в течение нескольких месяцев жаловалась на рецидивирующие эпизоды шейно-лицевой боли с иррадиацией до области орбит, а после резкого поворота шеи у нее остро появилась очаговая церебральная симптоматика, обусловленная диссекцией ВСА [6]. В другом случае инфаркт мозга на фоне двусторонней диссекции ВСА развился у ранее здорового 60-летнего мужчины, оказавшегося бессимптомным носителем увеличенных ШО, после энергичных движений головой во время танцев [12]. Результатом шило-каротидного конфликта может быть развитие псевдоаневризмы наружной сонной артерии с возникновением припухлости и атипичных цервикальных болей в переднелатеральной проекции с
безуспешным лечением от предполагаемой инфекции [8].
Вопрос о механизмах возникновения шило-каро–тидного конфликта неоднозначен и является в настоящее время предметом многих исследований. Результаты, полученные у 38 пациентов с каротидной дис–секцией и в такой же по количеству контрольной группе, свидетельствуют, что длина ШО на стороне диссекции существенно больше по сравнению с аналогичными параметрами в контрольной группе. Интересно, что в основной группе статистически значимой разницы между ШО на проблемной и асимптомной сторонах не получено. Это свидетельствует о важности не только длины, но и топографических особенностей расположения ШО, которые отличаются у одного и того же пациента, — несимметричны справа и слева. Было показано также, что на стороне диссекции существенно меньше расстояние между ШО и ВСА, при этом каждый 1 мм увеличения этой дистанции ассоциируется с уменьшением вероятности каротидной диссекции на 21 %. Полученные данные позволили авторам прийти к выводу, что механическое воздействие ШО на ВСА является одним из патогенетических механизмов каротидной диссекции [26]. Шило-каротидный конфликт образно называют феноменом «ножевого саморанения» («самопронзания») [27]. Однако имеются клинические публикации, а также экспериментально-анатомические данные о том, что при нормальной длине ШО компрессия ВСА при поворотах головы может быть вызвана спазмированной шилоглоточной мышцей в результате либо аномальной направленности («медиализации») ШО, либо аномального расположения сосудов шеи [7, 36]. Приведенные в литературе клинические описания ШКС проиллюстрируем собственным наблюдением.
Пациентка С., 28 лет, проживает в г. Минске, не работает (отпуск по уходу за ребенком). Доставлена бригадой скорой медицинской помощи в отделение патологии сосудов головного мозга 5-й городской клинической больницы 24 декабря 2016 г. с жалобами на сильную головную боль, преимущественно в правой половине, асимметрию лица, слабость в левых конечностях. Головная боль появилась ночью, вынуждена была принять обезболивающий препарат, боль уменьшилась, но не купирована. К утру развилась гемиплегия слева.
Анамнез жизни и перенесенные заболевания: замужем, имеет 2 здоровых детей (младшему ребенку 2,5 года). Беременности и роды без патологии; абортов и выкидышей не было; гинекологически здорова, контрацептивы не использовала. Ранее ничем, кроме редких простудных заболеваний, не болела. Вредных привычек не имеет. Примерно за 2 недели до поступ–ления в стационар амбулаторно перенесла вирусную инфекцию с очень сильным кашлем («такого раньше никогда не было»). После выздоровления самочувствие обычное.
Объективные данные при поступлении: общее состояние тяжелое. Правильного телосложения, нормального питания. Кожные покровы чистые, эластичность кожи обычная; скелетных аномалий и деформаций, гипермобильности суставов нет; подкожных образований, варикозного расширения периферических вен не выявлено. В сознании, несколько заторможена; в месте, времени и собственной личности ориентирована правильно. Анамнез излагает последовательно, речевых нарушений нет. Когнитивные функции не исследовались в связи с тяжестью состояния. Глазные щели S > D, смыкание век полное, сила круговых мышц глаз достаточная, лоб морщит симметрично, выраженное опущение левого угла рта и асимметрия оскала слева (непостоянно — выливание жидкостей из левого угла рта при питье); язык уклоняется влево, атрофии языка нет. В остальном ЧН без особенностей. Активные движения в левых конечностях отсутствуют, тонус в них низкий, сухожильные и периостальные рефлексы S < D, брюшные рефлексы слева не вызываются, спонтанный симптом Бабинского слева. Гемигипестезия слева с выраженным нарушением глубокой чувствительности в левой стопе и умеренной — в левой кисти. Менингеальные симптомы отрицательные. Пальценосовую и пяточно-коленную пробы правыми конечностями выполняет удовлетворительно.
СКТ головного мозга (при поступлении) — инфаркт мозга в лобно-височной области справа (59 × 46 мм). СКТ головного мозга в динамике и КТ-ангиография (4-е сутки заболевания) — увеличение зоны пониженной плотности в лобно-теменно-височной области справа размером 60 × 65 × 58 мм (рис. 1). КТ-ангиография (церебральная и на шее до уровня CII): патологическая извитость (S-образный ход) в дистальных отделах правой ВСА (субкраниально); выраженное неравномерное пролонгированное сужение ее просвета до 1,1–1,3 мм при расширении общего диаметра артерии до 8,6–9,2 мм; диаметр левой ВСА — 4,9 мм. В интракраниальном отделе правая ВСА сужена на всем протяжении до 1,8–2,6 мм. Окклюзия правой средней мозговой артерии. Заключение: инфаркт мозга в правом каротидном бассейне артерий. Диссекция правой ВСА в шейном отделе с распространением в интрацеребральные отделы; окклюзия правой средней мозговой артерии. КТ-ангиография магистральных сосудов шеи не выполнена по техническим причинам.
/41-1.jpg )
Рентгенография легких, электрокардиография, УЗИ сердца — без патологии. Колебания артериального давления в пределах 100–110/70–80 мм рт.ст.
Общий анализ крови и мочи, биохимический анализ крови с определением общего белка, мочевины, креатинина, общего и прямого/непрямого билирубина, аланинаминотрансферазы, аспартатаминотрансферазы, электролитов (К, Са, Na, Cl); глюкоза крови, коагулограмма (активированное частичное тромбопластиновое время, международное нормализированное отношение, фибриноген, протромбиновое время) — без отклонения от нормы.
Скрининг на сифилис (кровь), реакция микропреципитации, реакция пассивной гемагглютинации, реакция иммунофлуоресценции — отрицательные. Гемостазиограмма на волчаночный антикоагулянт — отрицательная; антитела к кардиолипину IgG и IgM, b2-гликопротеину IgG и IgM — отрицательные; ANCA профиль, антитромбин III — без отклонений от нормы.
Консультирована терапевтом: патологии со стороны внутренних органов не выявлено.
В процессе лечения наблюдалась следующая динамика: головная боль купирована через 2 недели. Уменьшилась асимметрия лица, появились движения в левой ноге в ограниченном объеме, мышечный тонус в левых конечностях повысился по спастическому типу, сухожильные и периостальные рефлексы резко оживлены слева (клонус левой стопы), спонтанный симптом Бабинского слева. Уменьшилась выраженность левосторонней гемигипестезии, стала различать счет и направление движения пальцев на левой кисти и стопе. Сидит самостоятельно, стоит возле кровати с поддержкой.
Через 3 недели стационарного лечения пациентка переведена в реабилитационную клинику, в которой выполнена МРТ головного мозга, МР-ангиография церебральных сосудов и магистральных артерий шеи (24-е сутки заболевания). Выявлен выраженный пролонгированный стеноз правой ВСА в шейном отделе с эксцентричным расположением истинного просвета, увеличением общего диаметра артерии по сравнению с левой ВСА за счет интрамуральной гематомы полулунной формы на аксиальных срезах (рис. 2). Наблюдается распространение диссекции правой ВСА на каменистую часть, выраженное обеднение сосудистого рисунка в бассейне правой средней мозговой артерии.
/42-1.jpg )
После курса реабилитационного лечения пациентка повторно госпитализирована в отделение патологии сосудов головного мозга 5-й городской клинической больницы для выполнения КТ-ангиографии шеи. Объективные данные: общее состояние относительно удовлетворительное. В сознании, ориентирована в месте, времени, собственной личности, критика сохранена. Речь без особенностей. ЧН: умеренный центральный парез лицевого нерва слева, легкий центральный парез подъязычного нерва слева. Сила в левой руке снижена в плече и предплечье — 2 балла, в кисти — 0 баллов. Сила в левом бедре и голени снижена до 3 баллов, в стопе — 2 балла. Мышечный тонус в левых конечностях умеренно повышен по спастическому типу. Сухожильные и периостальные рефлексы высокие слева (клонус левой стопы), справа — средней живости; положительный симптом Бабинского слева. Менингеальные симптомы отрицательные. В позе Ромберга устойчива, динамические координаторные пробы правыми конечностями выполняет удовлетворительно. Легкая гемигипестезия слева, мышечно-суставное чувство сохранено. Ходит в ортопедической обуви в пределах палаты с тростью, походка с элементами Вернике — Манна.
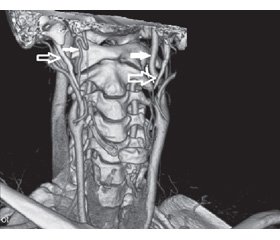
КТ-ангиография шеи (55-е сутки заболевания), корональный срез: патологическая извитость (S-образный ход) в дистальных отделах правой ВСА (субкраниально); конусовидный стеноз проксимальных отделов протяженностью 15,5 мм, переходящий в пролонгированный неравномерный стеноз всей шейной части: диаметр просвета в дистальных отделах артерии (субкраниально) — 2,6 мм; длина правого ШО — 32,1 мм, длина левого ШО — 30,8 мм (рис. 3). Аксиальный срез: расстояние от верхушки правого ШО до стенки ВСА — 1,9 мм (рис. 4); расстояние от левого ШО до стенки ВСА — 0,9 мм (верхушка находится вне проекции ВСА в связи с большим медиальным отклонением левого ШО). Анатомо-топографическое соотношение ШО и обеих ВСА представлено на рис. 5 (3D-реконструкция).
Лабораторные анализы без существенной динамики.
Таким образом, в описанном клиническом случае пациентка была носителем удлиненных ШО. Во время сильного кашля верхушка правого ШО, направленная в сторону сосудистых образований, постоянно травмировала правую ВСА, вызвав ее диссекцию. Следует отметить, что один из основных клинических синдромов каротидной диссекции — болевой — появился у пациентки спустя примерно 2 недели после вирусной инфекции на фоне продолжавшегося кашля значительно меньшей интенсивности. Можно предположить,
что возникновение головной боли связано с распространением диссекции на интрацеребральные отделы ВСА, поскольку уже через несколько часов развилась выраженная очаговая неврологическая симптоматика. Односторонняя головная боль (реже — в сочетании с лицевой), хотя и является патогномоничным симптомом, наблюдается примерно в 64–71 % случаев, следовательно, у каждого четвертого пациента ее может не быть [4, 30, 31]. Особенностью явилась длительность выраженного болевого синдрома более двух недель, что было связано со значительным поражением ВСА, включавшим ее шейную и каменистую части, а также с окклюзией правой средней мозговой артерии. Следует обратить внимание на характерную для артериальной диссекции динамику ангиографических данных в процессе лечения, а именно — увеличение диаметра правой ВСА в дистальных отделах шейной части с 1,3 до 2,6 мм за интервал между проведением КТ-ангиографии, равный 51 дню. Процесс реканализации не наблюдается без патогенетической терапии (системный либо локальный тромболизис) при других стенозирующих и окклюзирующих поражениях артерий. Полное восстановление топографии пораженной артерии либо значительное уменьшение стеноза в течение 3–7 месяцев лечения не является редкостью при диссекции, мы также имеем такие наблюдения [1]. Ранее нами описан клинический случай ШКС и диссекции ВСА с повторными инсультами на фоне сильного кашля [2], в связи с чем после сбора анамнеза у данной пациентки был проведен целенаправленный поиск по установлению этиологии инсульта.
Выводы
1. Во всех случаях экстракраниальной диссекции ВСА необходимо исключать этиологическую роль ШКС, особенно при появлении очаговой церебральной симптоматики после форсированных движений/поворотов головы либо кашля.
2. Нами описан новый триггерный фактор шило-каротидного конфликта при увеличенной длине ШО, каковым явился в обоих наших случаях сильный кашель.
3. Результаты клинических наблюдений последних лет убедительно свидетельствуют о необходимости проведения КТ исследования шеи и ВСА, несмотря на то, что диагностическим средством первой линии для верификации каротидной диссекции является МРТ (+ МР-ангиография).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Барабанова Э.В., Барановский А.Е., Мисникова В.А. и др. Прогноз консервативного лечения диссекции внутренних сонных и позвоночных артерий у пациентов молодого возраста с острыми цереброваскулярными заболеваниями // Лечебное дело. — 2014. — № 4. — С. 37-41.
2. Барабанова Э.В., Сытый Ю.В., Капацевич С.В. Шило-каротидный синдром и экстракраниальная диссекция внутренней сонной артерии: обзор литературы и собственное наблюдение // Здравоохранение. — 2015. — № 11. — С. 30-35.
3. Лебедянцев В.В. Шилоподъязычный синдром (топографо-анатомические основы, клиника, диагностика, принципы лечения): Автореф. дис… д-ра мед. наук. — М., 2004. — 44 с.
4. Baumgartner R.W., Bogousslavsky J. Clinical manifestations of carotid dissection // Front. Neurol. Neurosci. — 2005. — V. 20. — P. 70-76.
5. Buono U., Margone G.M., Michelotti A. et al. Surgical approach to the stylohyoid process in Eagle’ syndrome // J. Oral. Ma–xillofac. Surg. — 2005. — Vol. 63, № 5. — P. 714-716.
6. Cano L.M., Cardona P., Rubio F. Eagle syndrome and carotid dissection // Neurologia. — 2010. — Vol. 25, № 4. — P. 266-267.
7. Chuang W.C., Short J.H., McKinney et al. Reversible left hemispheric ischemia secondary to carotid compression in Eagle syndrome: surgical and CT angiographic correlation // Am. J. Neuradiol. — 2007. — Vol. 28. — P. 143-145.
8. Dao A., Karnezis S., Lane J. et al. Eagle syndrome presenting with external carotid artery pseudoaneurysm // Emerg. Radiol. — 2011. — Vol. 18, № 3. — P. 263-265.
9. Dwight T. Stylo-hyoid ossification // Ann. Surg. — 1907. — Vol. 46. — P. 721-735.
10. Eagle W.W. Elongated styloid processes: report of two cases // Arch. Otolaryngol. — 1937. — Vol. 47. — P. 584-587.
11. Eagle W.W. Elongated styloid processes: further observations and a new syndrome // Arch. Otolaryngol. — 1948. — Vol. 47. — P. 630-640.
12. Faivre A., Abdelfettah Z., Rodriguez S., Nicoli F. Bilateral internal carotid artery dissection due to elongated styloid processes and shaking dancing // J. Neurol. Neurosurg. Psychiatry. — 2009. — Vol. 80. — P. 1154-1155.
13. Fini G., Gasparini F., Filippini F. et al. The long styloid process syndrome or Eagle’s syndrome // J. Cranio-Maxillofacial Surg. — 2000. — Vol. 28, № 2. — P. 123-127.
14. Gossman J.R., Tarsitano J.J. The styloid-stylohyoid syndrome // J. Oral. Surg. — 1977. — Vol. 35. — P. 555.
15. Infante-Cossio P. et al. Compression of the internal carotid artery due to elongated styloid process // Rev. Neurol. — 2004. — Vol. 39, № 4. — P. 339-343.
16. Jung T., Tschernitschek H., Hippen H. et al. Elongated styloid process: when it is really elongated? // Dentomaxillofac. Radiol. — 2004. — Vol. 33. — P. 119-124.
17. Martins W.D. et al. Eagle’s syndrome: treatment by intraoral bilateral resection of the ossified stylohyoid ligament. F review and report of two cases // J. of craniomandibular and sleep practice. — 2013. — Vol. 31, № 3. — P. 226-231.
18. Mortellaro C., Biancucci P., Piccolo G., Vercellino V. Eagle’s syndrome: importance of a corrected diagnosis adequate surgical treatment // J. Craniofac. Surg. — 2002. — Vol. 13, № 6. — P. 755-758.
19. Murtagh R.D., Caracciolo J.T., Fernandez G. CT findings associated with Eagle syndrome // Am. J. Neuroradiol. — 2001. — Vol. 22. — P. 1401-1402.
20. Nayak D.R., Pujary K., Aggarwal M. et al. Role of three-dimensional computed tomography reconstruction in the management of elongated styloid process: a preliminary study // J. Laryngol. Otol. — 2007. — Vol. 121. — P. 349-353.
21. Patijn J. The Eagle pain syndrome: a case report // International musculosketal medicine / Hindawi publishing corporation. — 2012. Article ID 781297, 3 р. — doi: 10.1155/2009/781297.
22. Piagkou M., Fnagnostopoulou S., Kouladouros K., Piagkos G. Eagle’s syndrome: a review of the literature // Clin. Anat. — 2009. — Vol. 22, № 5. — P. 545-548.
23. Politi M., Toro C., Tenani G. A rare cause for cervical pain: Eaglе’s syndrome // International J. of dentistry. — 2009. — Vol. 34, № 2. — P. 68-71.
24. Prasad K.C., Kamath M.P., Reddy K.J.M. et al. Elongated styloid process (Eagle’s syndrome): a clinical study // J. Oral. Maxillofac. Surg. — 2002. — Vol. 60, № 2. — P. 171-175.
25. Quereshy F.A., Gold E.S., Arnold J., Powers M.P. Eagle’s syndrome in 11-year-old patient // J. Oral. Maxillofac. Surg. — 2001. — Vol. 59. — P. 94-97.
26. Raser J.M., Mullen M.T., Kasner S.E. et al. Cervical carotid artery dissection is associated with styloid process length // Neuro–logy. — 2011. — Vol. 77. — P. 2061-2066.
27. Razak A., Short J.L., Hussain S.I. Carotid artery dissection due to elongated styloid process: a self-stabbing phenomenon // J. Neuroimaging. — 2012. — doi: 10.1111/j.1552-6569.2012.00759.x.
28. Rechtweg I.S., Wax M.K. Eagle’s syndrome: a review // Am. J. Otolaryngol. — 1998. — Vol. 19. — P. 316-321.
29. Ruwanpura P.R., Abeygunasekera A.M., Tikiri G.K. Sudden unexpected death probably due to Eagle’s syndrome: a case report // Med. Sci. Law. — 2008. — Vol. 48, № 4. — P. 350-353.
30. Schievink W.I. Spontaneous dissection of the carotid and vertebral arteries // N. Engl. J. Med. — 2001. — Vol. 344. — P. 898-906.
31. Schwartz N.E. et al. Clinical and radiographic natural history of cervical artery dissections // J. Cerebrovas. Dis. — 2009. — Vol. 18, № 6. — P. 416-423.
32. Shankland W.E. Anterior Throat Pain Syndromes: causes for undiagnosed craniofacial pain // The J. of craniomandibular practice. — 2010. — Vol. 28, № 1. — P. 50-59.
33. Soo O.Y., ChanY.L., Wong K.S. Carotid artery dissection after prolonged head tilting while holding a newborn baby to sleep // Neurology. — 2004. — Vol. 62. — P. 1647-1648.
34. Sterling A.W. Bony growths involving the tonsil // J. Am. Med. Assoc. — 1896. — Vol. 27. — P. 734-735.
35. Thigpen C.A. The styloid process // Trans. Am. Laryngol. Rhinol. Otol. Assoc. — 1932. — Vol. 28. — P. 408-412.
36. Tubbs R.S., Loukas M., Dixon J., Cohen-Gadol A.A. Compression of the cervical internal carotid artery by the stylopharyngeus muscle: ananatomical study with potential clinical significance. Laboratory investigation // J. Neurosurg. — 2010. — Vol. 113, № 4. — P. 881-884.
37. Zuber M., Meder J.F., Mas J.L. Carotid artery dissection due to elongated styloid process // Neurology. — 1999. — Vol. 53. — P. 1886-1887.

/41-1.jpg )
/42-1.jpg )
/43-1.jpg )
/43-2.jpg )