Международный неврологический журнал 7 (93) 2017
Вернуться к номеру
Современные подходы к реабилитации больных, перенесших инсульт
Рубрики: Неврология
Разделы: Медицинские форумы
Версия для печати
Инсульт — острое нарушение мозгового кровообращения, являющееся одной из основных причин смертности и инвалидизации населения. Ежегодно в мире у 16 млн человек впервые развивается инсульт, а около 5,7 млн умирают вследствие этого заболевания. Из выживших больных 31 % нуждается в постоянном уходе, 20 % не могут самостоятельно передвигаться и только 8 % возвращаются к прежней деятельности.
Согласно рекомендациям ВОЗ выделяют три уровня последствий заболевания. Первый уровень — неврологические повреждения, к ним относят: двигательные, чувствительные, тонусные, психологические расстройства, которые наблюдаются в клинической картине заболевания. Второй уровень — нарушения функции, к которым могут привести неврологические повреждения, например нарушения ходьбы, самообслуживания. Третий уровень — ограничения, включающие нарушения бытовой и социальной активности, возникающие в результате неврологических повреждений и нарушений функций.
Таким образом, последствия инсульта проявляются на клиническом, функциональном и социальном уровнях. После перенесенного инсульта лишь в 10–15 % случаев происходит восстановление на всех трех перечисленных уровнях. В связи с этим актуальной является задача совершенствования методов восстановительного лечения инсульта, включая как медикаментозные, так и немедикаментозные методы.
12–14 сентября 2017 года в Одессе состоялась IX Международная неврологическая конференция «Нейросимпозиум», в рамках которой рассматривались вопросы, связанные с усовершенствованием медицинской помощи пациентам с инсультом, а также обсуждались аспекты нейрореабилитации как важной составляющей восстановления пациентов после инсульта.
С докладом «Перенос принципов двигательного восстановления в условия реальной жизни» выступил Andreas Winkler, директор и руководитель отделения неврологической реабилитации Clinic Bad Pirawarth (Австрия).
В начале своего выступления Andreas Winkler подчеркнул, что самым частым инвалидизирующим фактором после инсульта является двигательный дефицит, который не только резко ограничивает трудовую деятельность, затрудняет процесс самообслуживания, но и кардинально изменяет качество жизни больного. От двигательной слабости/гемипареза страдают более 80 % пациентов с данной патологией. Среди них 1/3 не может самостоятельно ходить, 1/3 имеет тяжелые ограничения жизнедеятельности и 1/3 страдает от афазии.
Результаты ряда исследований, проведенных Brolks et al. (1999) и Welmer et al. (2008), свидетельствуют о худшем восстановлении двигательных функций верхней конечности в сравнении с нижней. У 3/4 больных, выживших после инсульта, имеют место симптомы двигательного дефицита верхних конечностей. При этом у 60 % пациентов с отсутствием функционирования руки через 1 неделю после инсульта восстановление не наблюдается, а через четыре года только 50 % имеют хорошую или умеренную функцию.
Все это диктует необходимость усовершенствования методов нейрореабилитации пациентов, перенесших инсульт. И одним из ключевых факторов в достижении этого является улучшение точности прогноза исхода восстановления, который на 30–50 % зависит от размеров инфаркта и тяжести первичных расстройств. Также к немаловажным аспектам, определяющим варианты исхода восстановления, относятся: локализация, наличие интервенций в остром периоде инсульта, медикаментозная терапия в восстановительном периоде, объем и виды реабилитации после инсульта, медицинские осложнения, депрессия, генотип, социально-экономический статус пациента, качество ухода.
Кроме того, важная роль в улучшении точности прогноза восстановления принадлежит таким методам нейровизуализации, как магнитно-резонансная томография и компьютерная томография, позволяющим определить распространенность и локализацию поражения по отношению к коре головного мозга, и DTI-трактография, демонстрирующая состоятельность кортикоспинального тракта и дополнительных моторных волокон на пути их следования из моторной коры в мост.
В когортном исследовании H.M. Rinske et al., проведенном в 2010 году, было показано, что способность к разгибанию пальцев кисти и отведению плеча в течение 72 часов после перенесенного инсульта является прогностически важным признаком для функционального восстановления верхней конечности. При этом разгибатели пальцев наиболее четко отражают функцию латерального кортикоспинального тракта. В свою очередь, передний кортикоспинальный тракт ответствен за иннервацию проксимальных мышц, таких как мышцы шеи, туловища и проксимального отдела верхних конечностей (отведение плеча).
В исследовании H.M. Nijland et al. (2010) изучалась вероятность достижения двигательного восстановления верхней конечности у 156 пациентов через 6 месяцев после перенесенного инсульта (средняя оценка по шкале ARAT ≥ 10 баллов). Результаты исследования продемонстрировали, что лучшие перспективы для восстановления двигательного дефицита имеют те пациенты, у которых после инсульта отмечалась сохранность функций разгибания пальцев кисти и отведения плеча.
Далее докладчик рассказал об алгоритме, позволяющем прогнозировать потенциал восстановления верхней конечности после инсульта — PREP (Stinear C.M., 2012). Через 72 часа после инсульта оценивают функции отведения плеча и разгибание пальцев кисти, осуществляют подсчет баллов (от 0 до 5) и суммируют полученные результаты. Если данные функции сохранены, то потенциал восстановления оценивается как полный или заметный. При этом фокус реабилитации должен быть направлен на обеспечение нормального использования данных функций, а оценка по шкале ARAT составляет 51–57 баллов.
По истечении 5–7 дней после инсульта проводят транскраниальную магнитную стимуляцию, позволяющую оценить важный прогностический признак восстановления — электромиографический ответ. Если он присутствует, то прогноз благоприятный, с перспективой заметного потенциала восстановления. Реабилитационные мероприятия должны быть направлены на сохранение и дальнейшее развитие нормального функционирования (баллы по шкале ARAT — 34–50).
Для определения индекса асимметрии в сроки от 10 до 14 дней осуществляют проведение магнитно-резонансной томографии. При показателях менее 0,15 потенциал восстановления оценивают как ограниченный (13–33 балла по шкале ARAT), а реабилитационные меры должны быть направлены на обеспечение движений. При показателях асимметрии более 0,15 потенциал восстановления отсутствует (0–12 баллов по шкале ARAT), а реабилитационные мероприятия призваны компенсировать утраченные функции.
Имплементация шкалы PREP в клиническую практику была осуществлена в исследовании M. Cathy, P.H. Stenear et al. (2012), в котором приняли участие 200 пациентов с двигательным дефицитом верхней конечности после перенесенного инсульта. В ходе исследования было установлено, что применение шкалы PREP значительно повышает эффективность реабилитации после инсульта. Получение прогностической информации позволило терапевтам модифицировать содержание и дозировку воздействия в соответствии с прогнозом, а длительность пребывания в стационаре сократить на 1 неделю. По окончании исследования авторы пришли к выводу, что PREP-прогноз минимальных результатов может быть корректен у 80 % пациентов.
Затем Andreas Winkler рассказал присутствующим о необходимости повышения эффективности двигательной реабилитации. В исследовании, проведенном Winters et al. (2015), изучалось двигательное восстановление у 211 пациентов, перенесших инсульт. Из них 65 пациентов имели тяжелый двигательный дефицит верхней конечности, а 145 — легкий.
После проведенных реабилитационных мероприятий было установлено, что 78 % пациентов (n = 146) демонстрировали пропорциональное восстановление двигательного дефицита верхней конечности; не попавшие в эту группу имели более тяжелые неврологические расстройства через 72 часа после инсульта. На независимой выборке эти результаты подтверждают, что пациенты с легкими и умеренными двигательными расстройствами демонстрируют почти пропорциональное восстановление верхней конечности. Пациенты, которые, вероятнее всего, не достигнут прогнозируемого уровня восстановления, были идентифицированы с использованием клинических детерминант при оценке на протяжении 72 часов после инсульта (рис. 1).
Для улучшения двигательного восстановления верхней конечности необходимо увеличение дозы и частоты повторений направленных движений. Так, у животных изменения синаптической плотности в первичной моторной коре возникают после 400 повторений направленных движений (Remple et al., 2001). У пациентов с инсультом типичное количество повторений в терапевтической сессии около 30 (Lang et al., 2009). По-видимому, существует такой порог восприятия, выше которого использование верхней конечности улучшается, а ниже — ухудшается. Причем этот порог коррелирует как с интеграцией нейроанатомических структур, так и с пластичностью мозга (Sahweighofer et al., 2009). В исследовании J.M. Veerkeek et al. (2014) была выявлена зависимость восстановления верхней конечности от увеличения дозировки физиотерапевтического лечения. В ходе исследования авторы пришли к выводу, что существуют четкие доказательства, поддерживающие интенсивные, функционально-ориентированные вмешательства с большим количеством повторений во всех фазах инсульта. При этом эффекты преимущественно ограничены актуально тренируемыми функциями и активностями. В рандомизированном клиническом исследовании ICARE на протяжении 10 недель изучалась зависимость эффективного двигательного восстановления верхних конечностей от дозы терапии. В нем приняли участие пациенты (n = 361), перенесшие инсульт и имеющие двигательный дефицит верхних конечностей. Результаты исследования продемонстрировали отсутствие преимуществ при увеличении средней дозы терапии более чем в 2 раза (до 27 часов) по сравнению с 11 часами, которые в среднем получали пациенты в группе наблюдения. Однако в другом исследовании (S. McCabe et al., 2015) с участием 39 пациентов с двигательным дефицитом верхних конечностей, наступившим вследствие инсульта, были получены более оптимистичные результаты. Через 3–6 месяцев после инсульта терапия для верхней конечности большой продолжительности (12 недель), высокой интенсивности (300 часов) значительно содействовала двигательному восстановлению, практически на 15 %. В рандомизированном контролированном исследовании AVERT изучалась эффективность и безопасность очень ранней мобилизации пациентов в течение 24 часов после инсульта. Анализ планируемого ответа на дозу продемонстрировал, что краткосрочное, но более интенсивное вмешательство более выгодно в первые недели после инсульта. Но очень ранняя и очень интенсивная мобилизация после инсульта ухудшает прогноз. Также не стоит забывать, что существует и спонтанное двигательное восстановление после инсульта. В промежутке 6–10 недель время после инсульта независимо связано со спонтанным восстановлением функций и активности, что объясняет 16–42 % наблюдаемых улучшений.
Далее Andreas Winkler акцентировал внимание на возможности форсирования пластичности мозга, поскольку ее улучшение обеспечивает хорошее восстановление моторных функций. В настоящее время к одним из перспективных методов двигательного восстановления пациентов после инсульта относится транскраниальная прямая корковая стимуляция (tDCS). Сущность данного метода заключается в том, что слабый электрический ток (1–2 mA) подается на скальп с использованием двух поверхностных электродов для стимуляции зависимого от полярного сдвига потенциала покоя нейрональной мембраны, чтобы вызвать изменение корковой возбудимости (нейромодуляция локальной моторной сети). При этом анодный электрод предназначен для стимуляции, а катодный — для подавления. Последствие tDCS (90´) включает индукцию синаптической пластичности, похожую на длительное потенцирование и являющуюся критичной для обучения, нейропластичности и реабилитации. В рандомизированном контролируемом исследовании, проведенном Allman et al. с участием 24 пациентов с хроническим инсультом (более 1 месяца), было установлено, что применение ипсилатеральной tDCS на протяжении 9 дней значительно увеличивало функциональные успехи пациентов после инсульта в сравнении с группой, получающей плацебо и моторную тренировку GRASP. В работе K. Figlewski et al. было показано, что назначение tDCS на пораженную зону в течение 30 минут ежедневно в дополнение к терапии насильственными движениями у пациентов с хроническим инсультом значительно улучшало моторные возможности паретичной верхней конечности в сравнении с терапией только насильственными движениями. В данном случае для оценки двигательного восстановления применялся тест Вольфа, состоящий из 15 функциональных заданий и 2 заданий на силу. Исследованием первичного исхода была шкала функциональных возможностей, которая оценивала каждое из 15 заданий от 0 (отсутствие попытки движения пораженной рукой) до 5 баллов (нормальное движение). В метаанализе B. Elsner et al. в отношении эффективности tDCS (анодной/катодной/двойной) автором был сделан вывод о существовании доказательств низкого или умеренного качества в сравнении с контролем (плацебо/любое другое вмешательство) для улучшения повседневной активности после инсульта. Однако множество проводимых рандомизированных исследований, по мнению B. Elsner, могут изменить качество доказательств в будущем.
На сегодняшний день известно, что нейропластичность головного мозга у пациентов после инсульта можно стимулировать или модулировать фармакологическими средствами. В качестве фармакологических агентов исследователями рассматривались ингибиторы ацетилхолинэстеразы, амфетамин, допамин, селективные ингибиторы обратного захвата серотонина и нейропептиды (Церебролизин). В исследовании FLAME (Fluoхetine for Motor Recovery after Acute Ischaemic Stroke) (n = 118) оценивали применение флуоксетина в дозе 20 мг в сутки в течение 3 мес. (n = 57) в сравнении с плацебо (n = 56), начиная терапию после 5–10 сут. от развития инсульта. В этом рандомизированном клиническом исследовании было продемонстрировано, что применение флуоксетина в сочетании с физиотерапией способствует ускорению восстановления двигательной функции спустя 3 мес. по сравнению с плацебо.
В настоящее время проводятся три многоцентровых рандомизированных плацебо-контролируемых исследования: AFFINITY, FOCUS и EFFECTS с общим количеством пациентов 6000, имеющие целью выяснить, будет ли рутинное использование флуоксетина в дозе 20 мг/день на протяжении 6 месяцев после острого инсульта улучшать функциональный исход пациентов. Ответ на этот вопрос будет известен в 2018 году, после получения результатов.
В двойном слепом плацебо-контролируемом рандомизированном исследовании TALOS (n = 642) изу–чалось воздействие циталопрама на функциональную активность пациентов с острым ишемическим инсультом. Основные критерии включения: первый ишемический инсульт; сроки инсульта менее 7 дней; отсутствие депрессии. I группа (n = 319) получала циталопрам в стандартной дозировке, II (n = 323) — плацебо. Результаты исследования показали улучшение функциональной активности по модифицированной шкале Рэнкина в группе циталопрама в сравнении с плацебо. Соотношение шансов улучшения составило 1 : 27 (95% ДИ 0,92–1,74, р = 0,14).
Но, по мнению докладчика, особая роль в системе реабилитации больных с инсультом отводится Церебролизину — нейропептидному препарату, улучшающему трофику, нейропластичность и нейрогенез, что способствует моторному восстановлению.
В 2009 году W. Lang исследовал эффективность Церебролизина в комбинации с рекомбинантным тканевым активатором плазминогена (rt-PA) у 119 пациентов в возрасте 18–80 лет с ишемическим полушарным инсультом легкой/умеренно тяжелой степени. Тромболитическая терапия проводилась в первые 3 ч после появления симптомов ишемического инсульта. Лечение Церебролизином 30 мл/день в/в (n = 60) или плацебо (n = 59), длившееся 10 дней, начинали в течение 1 ч после окончания введения тромболитика. Первичной конечной точкой исследования служило значение по модифицированной шкале Рэнкина к 90-му дню после развития инсульта: количество пациентов без симптомов увеличивалось более быстро в группе Церебролизина и было наибольшим на 5-й и 10-й день. Эти результаты были подтверждены при оценке доли пациентов, ответивших на лечение, которая составила 70 %. Более быстрое улучшение в группе Церебролизина было отмечено также по шкале инсульта Национального института здоровья (NIHSS). Среднее значение индекса Бартел к 90-му дню составляло около 76 в обеих терапевтических группах. В группе Церебролизина по этой шкале было больше респондеров (пациенты со значением ≥ 95 баллов из 100 возможных) на 5-й и 10-й день исследования.
Целью исследования CARS (D.F. Muresanu et al., Stroke, 2016) было изучение влияния комбинированного применения Церебролизина в сочетании с ранней реабилитацией на восстановление двигательной функции верхних конечностей. Данное исследование было проспективным, рандомизированным, двойным слепым, плацебо-контролируемым, многоцентровым и проводилось в параллельных группах. Пациенты получали либо Церебролизин (30 мл/сут), либо плацебо (физиологический раствор) один раз в сутки в течение 21 дня, начиная с 24–72 часов после развития инсульта. Также пациенты принимали участие в стандартной программе реабилитации продолжительностью 21 день с первых 48–72 часов после развития инсульта. В качестве первичной конечной точки выступал балл по шкале оценки функционирования верхней конечности (Action Research Arm Test, ARAT) на 90-й день. Непараметрическая оценка величины эффекта на балл по шкале ARAT на 90-й день продемонстрировала выраженное превосходство Церебролизина над плацебо (критерий Манна — Уитни = 0,71, 95% ДИ 0,63–0,79). Церебролизин был безопасным в применении и имел хорошую переносимость. Важно, что выраженное улучшение наблюдалось уже после 14 дней лечения. Результаты исследования CARS подтверждают более ранние клинические результаты применения Церебролизина и являются основанием для назначения мультимодальных лекарственных средств с целью улучшения результатов ранней реабилитации после инсульта.
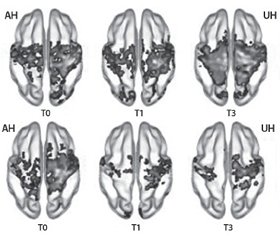
В исследование Н. Сhen et al. (2016) были включены 70 пациентов с умеренным и тяжелым нарушением двигательных функций после инсульта. Все они были рандомизированы на две равные группы: I группа получала Церебролизин и стандартизированную реабилитационную терапию; II — плацебо в дополнение к стандартизированной реабилитационной терапии. Курс лечения составил 21 день.
Пластичность сенсомоторных путей оценивалась с помощью функциональной МРТ (фМРТ) исходно, сразу после завершения терапии, а также через три месяца после развития инсульта. При проведении анализа в подгруппе пациентов с нарушением двигательной функции тяжелой степени (FMA < 50, тест Фугл — Мейера) в точке Т0 были проанализированы данные фМРТ 29 пациентов (Церебролизин n = 13, плацебо n = 16). Динамика в сенсомоторной сети продемонстрировала повышение симметричной функциональной связи между билатеральными первичными сенсомоторными зонами коры головного мозга (SM1), которое было значительно более выраженным в группе препарата Церебролизин.
Стоит отметить, что именно в подгруппе с тяжелым двигательным нарушением была выявлена статистическая разница в восстановлении моторной функции, которая оценивалась по тесту Фугл — Мейера (FMA), в пользу группы, получавшей комбинированную терапию (Церебролизин + реабилитационные мероприятия), в сравнении с группой, которая получала плацебо + реабилитационные мероприятия.
Таким образом, данные нейровизуализации подтверждают положительный эффект комбинированной терапии — ранней реабилитации и Церебролизина на активацию процессов пластичности моторной сети. При этом добавление Церебролизина в комплексную терапию способствует более раннему и полному раскрытию реабилитационного потенциала пациента.
Далее Andreas Winkler представил вниманию слушателей клинический случай из собственной практики: пациент, 69 лет, дважды перенес ишемический инсульт в бассейне правой среднемозговой артерии (10.2016 и 03.2017). Из сопутствующих заболеваний в анамнезе: артериальныя гипертензия, сахарный диабет и гиперлипидемия. При неврологическом осмотре выявлен левосторонний гемипарез, гемианопсия и геминеглект. Может ходить с одним костылем. Левая рука тяжелая, отмечается дистальная слабость (мск 1–2), проксимальная (мск 3–4). Не может манипулировать небольшими предметами (столовые приборы). Жалуется на отсутствие улучшения в течение 3 месяцев после последнего инсульта.
Пациенту была назначена двухнедельная мультимодальная терапия, включающая: интенсивную эрготерапию более 1 часа в день + физическая терапия; Церебролизин 30 мл/день в/в в течение 14 дней и tDCS — 20 мин/день 5 дней/неделю.
В результате проведенной терапии отмечалось сокращение времени выполнения теста «установки 9 колышков в лунки», увеличение мышечной силы в руке, а также выявлена тенденция к улучшению мелкой и крупной моторики рук на 30 % по шкале ARAT.
Подводя итоги, докладчик отметил, что произо–шли глубокие изменения в понимании механизма двигательного восстановления пациентов после инсульта. Понятно, что на сегодняшний день реабилитация таких пациентов требует иного подхода — более эффективного и совершенного. Для достижения этой цели необходим как можно более ранний и точный прогноз исхода восстановления, увеличение потенциала пластичности головного мозга и применение комбинации мультимодальных видов лечения. Все это выглядит многообещающим, но требует дальнейшей оценки.
Подготовила Татьяна Чистик

/83-1.jpg)
/85-1.jpg)