Журнал «» Том 13, №4, 2020
Вернуться к номеру
Основи діагностики та лікування легеневої гіпертензії, асоційованої з захворюванням лівих відділів серця: клінічний випадок
Авторы: Радченко Г.Д., Кушнір С.М., Сіренко Ю.М.
ДУ «ННЦ «Інститут кардіології імені М.Д. Стражеска» НАМН України», м. Київ, Україна
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
В даній статті описується клінічний випадок легеневої гіпертензії, асоційованої з захворюванням лівих відділів серця (ЛГ-ЛВС), на фоні серцевої недостатності зі збереженою фракцією викиду (СНзбФВ) у жінки віком 63 роки. Історія хвороби (артеріальна гіпертензія, фібриляція передсердь, цукровий діабет, тромбоемболія легеневих артерій, ожиріння, хронічне обструктивне захворювання легень) та дані звичайних інструментальних (відсутність тромбів у легеневих артеріях, збільшені розміри правих відділів серця, що значно переважали над лівими, високий рівень розрахованого систолічного тиску в легеневій артерії) та лабораторних методів дослідження (високий рівень мозкового натрійуретичного пептиду) не дозволили класифікувати групу легеневої гіпертензії (ЛГ). Лише застосування катетеризації правих відділів серця допомогло правильно визначитися з типом ЛГ — посткапілярна комбінована ЛГ-ЛВС. В статті також обговорюються останні рекомендації з діагностики та лікування СНзбФВ та ЛГ-ЛВС. Розглядається запропонований на Європейському конгресі кардіологів у Парижі (2019) алгоритм визначення СНзбФВ і можливість його використання в Україні. Окрім того, розбираються питання щодо морфологічних і патогенетичних відмінностей між прекапілярною легеневою артеріальною гіпертензією (ЛАГ) та посткапілярною ЛГ-ЛВС. Наводяться аргументи щодо неможливості застосування специфічної терапії ЛАГ у пацієнтів з посткапілярною ЛГ. Обговорюються дані щодо можливостей терапевтичних втручань у пацієнтів із СНзбФВ. Особливий наголос робиться на корекції факторів ризику та супутніх станів, зокрема за рахунок модифікації способу життя та немедикаментозного лікування.
В данной статье описывается клинический случай легочной гипертензии, ассоциированной с заболеванием левых отделов сердца (ЛГ-ЛОС), на фоне сердечной недостаточности с сохраненной фракцией выброса (СНсФВ) у женщины в возрасте 63 лет. История болезни (артериальная гипертензия, фибрилляция предсердий, сахарный диабет, тромбоэмболия легочных артерий, ожирение, хронические обструктивные заболевания легких) и данные обычных инструментальных (отсутствие тромбов в легочных артериях, увеличенные размеры правых отделов сердца, значительно преобладающие над левыми, высокий уровень рассчитанного систолического давления в легочной артерии) и лабораторных методов исследования (высокий уровень мозгового натрий-уретического пептида) не позволили классифицировать группу легочной гипертензии (ЛГ). Лишь применение катетеризации правых отделов сердца помогло правильно определиться с типом ЛГ — посткапиллярная комбинированная ЛГ-ЛОС. В статье также обсуждаются последние рекомендации по диагностике и лечению СНсФВ и ЛГ-ЛОС. Рассматривается предложенный на Европейском конгрессе кардиологов в Париже (2019) алгоритм определения СНсФВ и возможность его использования в Украине. Кроме того, разбираются вопросы морфологических и патогенетических различий между прекапиллярной легочной артериальной гипертензией (ЛАГ) и посткапиллярной ЛГ-ЛОС. Приводятся аргументы о невозможности применения специфической терапии ЛАГ у пациентов с посткапиллярной ЛГ. Обсуждаются данные о возможностях терапевтических вмешательств у пациентов с СНсФВ. Особый акцент делается на коррекции факторов риска и сопутствующих состояний, в том числе за счет модификации образа жизни и немедикаментозного лечения.
This paper presents a clinical case of pulmonary hypertension associated with left heart disease (PH-LHD) in a 63-year-old woman with heart failure and preserved ejection fraction (HFpEF). The history of disease (arterial hypertension, atrial fibrillation, diabetes mellitus, acute pulmonary embolism, obesity, chronic obstructive pulmonary disease) and results of standard instrumental (no signs of thrombi in pulmonary arteries, significant enlargement of right heart and normal size of left heart, high level of calculated systolic blood pressure in pulmonary artery) and laboratory investigations (high level of B-type natriuretic peptide) did not help to classify the type of pulmonary hypertension. Only after right heart catheterization it was possible to establish the correct diagnosis — post capillary combined PH-LHD. The article also discussed the latest guidelines on the diagnosis and treatment of HFpEF and PH-LHD. Some considerations in favor of new step algorithm for diagnosis of HFpEF that was proposed by European Society of Cardiology Congress in Paris (2019) were done and there was demonstrated its possible use in Ukraine. Some questions of morphological and pathogenic differences between precapillary pulmonary arterial hypertension and post-capillary PH-LHD were discussed. Conclusion about the impossibility of using specific pulmonary arterial hypertension therapy in patients with post-capillary PH was based on some arguments. There are elucidated some drug interventions in patients with HFpEF. Particular emphasis is placed on the correction of risk factors and comorbidities, in particular through lifestyle modifications and non-drug treatment.
легенева гіпертензія; діагностика; лікування; захворювання лівих відділів серця; клінічний випадок; рекомендації
легочная гипертензия; диагностика; лечение; заболевания левых отделов сердца; клинический случай; рекомендации
pulmonary hypertension; diagnosis; treatment; left heart diseases; clinical case; guidelines
Вступ
Найбільш поширеною формою легеневої гіпертензії (ЛГ) є гіпертензія, асоційована з захворюваннями лівих відділів серця. Серед тих пацієнтів, у яких ЛГ визначалася при ехокардіографії (ЕхоКГ), із 936 осіб з підвищеним рівнем систолічного артеріального тиску (САТ) в легеневій артерії 68 % мали захворювання лівих відділів серця, 9 % — ЛГ, асоційовану з захворюванням легень або порушенням дихання під час сну, 2 % — хронічну тромбоемболічну ЛГ, 2,7 % — інші захворювання [1]. Поширеність ЛГ (всі групи) становить 326 випадків на 100 000 населення, а саме ЛГ, асоційованої з захворюванням лівих відділів серця (ЛГ–ЛВС), — 250 осіб на 100 000 населення, або 1 випадок на 400 осіб.
Згідно з останніми рекомендаціями, ЛГ–ЛВС визначається як посткапілярна ЛГ, при якій середній тиск у легеневій артерії (СрТЛА) ≥ 20 мм рт.ст. і тиск заклинювання легеневої артерії (або тиск у лівому передсерді) > 15 мм рт.ст. [2, 3]. Зазвичай ЛГ–ЛВС є наслідком або маркером патологічних процесів, що відбуваються в серці та призводять до пасивного збільшення тиску в лівому передсерді, легеневих венах і потім в артеріях. Також через різні механізми розвиваються структурні та функціональні зміни в малому колі кровообігу, що завершуються ремоделюванням легеневих артерій (артеріол) та венул [2, 4, 5]. При цьому функція правого шлуночка може порушуватися як внаслідок збільшення постнавантаження, так і внаслідок захворювання серця (наприклад, ішемічної хвороби серця).
Усі хвороби, що призводять до виникнення ЛГ–ЛВС, розподіляються на групи: 1) ті, при яких розвивається переважно систолічна дисфункція лівого шлуночка (ЛШ); 2) ті, при яких формується переважно діастолічна дисфункція ЛШ; 3) ті, що характеризуються ураженням клапанів серця (аортального або мітрального) [6]; 4) вроджені/набуті обструкції притоку/відтоку та вроджені кардіоміопатії. В усіх випадках відбувається підвищення тиску в лівому передсерді, що веде до підвищення тиску в легеневих венах і капілярах. У відповідь включається рефлекс Китаєва, і легеневі артеріоли спазмуються. З цього починається ЛГ, а у подальшому приєднується ремоделювання артеріол. Фактично ЛГ є проявом серцевої недостатності зі збереженою фракцією викиду (СНзбФВ) або зниженою фракцією викиду (ФВ) ЛШ. Зазвичай при наявності зниженої фракції викиду встановлення причини ЛГ не становить труднощів, але збережена ФВ часто викликає сумніви, особливо коли ліве передсердя мало страждає на ранніх етапах захворювання. Тоді єдиною можливістю встановити причину ЛГ є вимірювання тиску в лівому передсерді. Для цього пацієнт має бути направлений у спеціалізований центр ЛГ. Визначення гемодинамічної групи ЛГ (пре– або посткапілярна) є дуже важливим, адже від цього залежить призначення специфічної терапії, що чинить позитивну або негативну дію залежно від причини ЛГ.
В даній статті описується клінічний випадок ЛГ–ЛВС на фоні СНзбФВ. Історія хвороби та дані звичайних інструментальних і лабораторних методів дослідження не дозволили встановити причину ЛГ. Лише застосування катетеризації правих відділів серця допомогло правильно визначитися з діагнозом. У статті також обговорюються останні рекомендації з діагностики та лікування СНзбФВ та ЛГ–ЛВС.
Клінічний випадок
Пацієнтка М., 63 роки, звернулась до центру легеневих гіпертензій ДУ «Інститут кардіології імені акад. М.Д. Стражеска» НАМН України в грудні 2019 року зі скаргами на задишку при незначному фізичному навантаженні, перебої в роботі серця, періодичний сухий кашель, набряки гомілок, підвищення систолічного/діастолічного артеріального тиску (АТ) до 180/100 мм рт.ст. (нормальним для себе вважає АТ 120–130/80 мм рт.ст.). Постійно приймала валсартан 80 мг/добу, ривароксабан 20 мг/добу, торасемід 10 мг/добу, небіволол 5 мг/добу, хлорид калію 600 мг 3 р/добу.
Погіршення стану відзначає з лютого 2019 року, коли поступово з’явилась задишка та набряки гомілок. Лікувалась за місцем проживання без поліпшення стану. Потім знаходилась на стаціонарному лікуванні в приватній клініці з вираженими набряками нижніх кінцівок, асцитом і задишкою в спокої. На фоні інтенсивної діуретичної терапії стан значно покращився. Після лікування була направлена на консультацію до центру легеневої гіпертензії ДУ «Інститут кардіології імені акад. М.Д. Стражеска» НАМН України у зв’язку з тим, що при ехокардіографічному дослідженні було виявлено значне підвищення САТ у легеневій артерії (> 70 мм рт.ст.).
В анамнезі у пацієнтки була артеріальна гіпертензія протягом 30 років, для контролю якої вона постійно приймала антигіпертензивну терапію. При прийомі інгібіторів АПФ відзначався виражений кашель. В 2007 році діагностовано тромбоемболію легеневої артерії дрібних гілок, тривалий час приймала варфарин, потім перейшла на ривароксабан. В 2008 році проведено екстирпацію матки та яєчників з приводу фіброміоми. В 2009 році перенесла холецистектомію. В 2007 році діагностовано цукровий діабет ІІ типу, для контролю якого приймала глімепірид 2 мг/добу, емпагліфлозин 10 мг/добу. З січня 2019 року — постійна форма фібриляції передсердь.
При надходженні до центру легеневої гіпертензії відзначалися незначні набряки нижніх кінцівок, АТ 138/80 мм рт.ст., ЧСС — 94, пульс аритмічний, ЧД у спокої — 18, SaPО2 — 87 %, дихання везикулярне, хрипи сухі та вологі з обох сторін, тони серця глухі, м’який систолічний шум на верхівці. Акценту 2–го тону на легеневій артерії немає, печінка +6 см виступає з–під реберної дуги. Індекс маси тіла — 34,9 кг/м2. На ЕКГ фібриляція передсердь з ЧСС 90–110, ознаки гіпертрофії ЛШ.
Результати основних і додаткових лабораторних досліджень подані в табл. 1. Як видно з табл. 1, пацієнтка мала підвищений рівень глюкози та глікованого гемоглобіну, зниження швидкості клубочкової фільтрації, що відповідало ІІІА ст. хронічної хвороби нирок, високий рівень сечової кислоти, значне підвищення рівня N–термінального мозкового натрійуретичного пептиду, що свідчило про перевантаження передсердь, зниження рівня феритину (залізодефіцитний стан). Загальний аналіз сечі, аналіз сечі за Нечипоренко та добової сечі були без значущих відхилень. Не виявлено змін в ревмопробах, скринінгових аналізах на вірусний гепатит В та С, ВІЛ–інфекцію.
Тест з 6–хвилинною ходьбою продемонстрував помірне зниження толерантності до фізичного навантаження: 360 м, задишка за Borg — 5 б. Дані ехокардіографії (розмір, об’єм і площа правого передсердя, індекси ексцентричності в систолу та діастолу) свідчили про переважання правих відділів серця над лівими (табл. 2). Систолічна функція правого та лівого шлуночків була збережена. Розрахований систолічний тиск у легеневій артерії був надто високий для ЛГ–ЛВС — 120 мм рт.ст. При дуплексному скануванні артерій і вен нижніх кінцівок виявлена лише варикозна хвороба вен нижніх кінцівок. З огляду на наявність ожиріння, зниження сатурації кисню, порушення сну пацієнтка була обстежена на наявність синдрому обструктивного апное сну за допомогою скринінгового приладу SOMNOcheck micro. Виявлено, що індекс апное/гіпопное становив 6,5/год (м’який ступінь), але при цьому мінімальна сатурація кисню в нічний час становила 74 %.
За даними комп’ютерної томографії органів грудної клітки з контрастуванням легеневої артерії, що була зроблена ще під час лікування пацієнтки в приватній клініці, ознак тромбоемболії легеневої артерії не виявлено, праві відділи значно збільшені порівняно з лівими (рис. 1). Легені без інфільтративно–вогнищевих змін, справа в S3, зліва в S5 ділянки лінійного пневмофіброзу. Справа в плевральній порожнині виявлялася невелика кількість вільної рідини з товщиною шару до 13,4 мм. Потовщення плеври не виявлено. Корені легень розширені за рахунок судинного компонента, головні бронхи без особливостей. Права легенева артерія діаметром 35,3 мм, ліва — 35 мм, легеневий ствол — 46 мм (дуже дилатований). Дуга і грудний відділ аорти, основні артеріальні стволи — з поодинокими кальцинатами у стінках.
Додатково була визначена функція зовнішнього дихання за допомогою бодіплетизмографії: TLC — 91,8 %, FVC — 64,5 %, FEV1 — 62,5 %. Пацієнтка консультована пульмонологом: хронічне обструктивне захворювання легень ІІ ст., група А. Легенева недостатність ІІ ст. Застійна пневмопатія. Для лікування рекомендовано призначити комбінований інгаляційний препарат спіолто респімат (олодатерол/тіотропій 2,5/2,5 мкг на інгаляцію) по 2 вдихи вранці постійно.
Враховуючи дані — явні ознаки збільшення та перевантаження правих відділів серця, що превалювали над лівими; відсутність виражених змін лівих відділів серця; наявність захворювання легень і значний розрахований САТ у легеневій артерії за даними ЕхоКГ, що не відповідав тяжкості ураження легень, було вирішено провести катетеризацію правих відділів серця. Результати надані у табл. 3.
Як видно з табл. 3, при прямому вимірюванні рівень САТ у легеневій артерії був значно меншим, ніж визначено при ЕхоКГ (різниця становила майже 40 мм рт.ст.), СрАТЛА становив 52 мм рт.ст. Хвилинний об’єм крові та серцевий індекс відповідали нормальним значенням — 5 л/хв і 2,32 л/хв/м2. Тиск у правому передсерді був значно підвищеним, що є показником високого ризику несприятливих подій. Тиск заклинювання легеневої артерії (17 мм рт.ст.), що відображає тиск у лівому передсерді, вказував на те, що ЛГ пов’язана з захворюванням лівих відділів серця, тобто є посткапілярною. При цьому підвищений рівень опору легеневих судин (560 дин ´ с/с – 5 = = 7 од. Вуда) свідчив по наявність прекапілярного компонента, що відповідає визначенню комбінованої посткапілярної ЛГ.
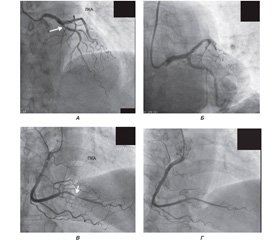
Після встановлення характеру ЛГ потрібно було визначитися з причиною, а для цього нам обов’язково необхідно було виключити ішемічну хворобу серця. У зв’язку з наявністю симптомів СН єдиним методом діагностики було проведення коронаровентрикулографії, результати якої подані на рис. 2. Як видно з рис. 2, у пацієнтки спостерігався критичний стеноз (~ 90 %) у дистальній частині правої коронарної артерії та в гирлі передньої міжшлуночкової гілки (99 %) лівої коронарної артерії (бляшка з ознаками руйнування). Проведено ангіопластику та встановлено, відповідно, два елютинг–стенти (DES) з відновленням кровотоку в обох судинах (рис. 2).
Діагноз був сформульований таким чином: ішемічна хвороба серця: атеросклеротичний кардіосклероз. Коронаровентрикулографія: критичні стенози дистальної частини правої коронарної артерії (90 %): 1 DES та гирла передньої міжшлуночкової гілки лівої коронарної артерії (99 %): 1 DES. Гіпертонічна хвороба ІІ ст., 3–го ст. Гіпертензивне серце. Постійна форма фібриляції передсердь. CHADS–VASc 6б. Легенева гіпертензія, асоційована з захворюванням лівих відділів серця (група 2). Стан після ТЕЛА дрібних гілок (2007). Недостатність тристулкового клапана ІІІ ст. СН ІІБ зі збереженою фракцією викиду, ІІІ функціональний клас ВООЗ. Асцит, гідроторакс. Ризик 4. Цукровий діабет ІІ типу, середнього ступеня тяжкості, стадія субкомпенсації. Ожиріння І ст. Гіперурикемія. Хронічне обструктивне захворювання легень ІІ ст., група А. Легенева недостатність ІІ ст. Варикозна хвороба вен нижніх кінцівок. Залізодефіцитний стан.
Призначено лікування: діуретики, клопідогрель, аспірин, ривароксабан, валсартан 80 мг 2 р/добу, спіронолактон, бісопролол, препарат заліза. Окрім того, пацієнтка продовжила антидіабетичну терапію та терапію, призначену пульмонологом. Надано рекомендації щодо модифікації способу життя. В задовільному стані пацієнтка була виписана.
Обговорення випадку
Згідно з останніми рекомендаціями з діагностики та лікування ЛГ, що базуються на матеріалах VI Всесвітнього конгресу з легеневої гіпертензії (NICE 2018), ЛГ–ЛВС визначається як гемодинамічний стан, при якому спостерігається підвищення СрАТЛА > 20 мм рт.ст. та тиску заклинювання легеневої артерії (тиск у лівому передсерді) > 15 мм рт.ст. [3]. Якщо при цьому опір легеневих судин становить < 3 од. Вуда, то йдеться про ізольовану посткапілярну ЛГ, якщо він становить > 3 од. Вуда — про комбіновану посткапілярну ЛГ. Інші маркери несприятливого прогнозу також можуть враховуватися, а саме діастолічний пульмональний градієнт, тиск у правому передсерді, результати кардіопульмонального тесту, дифузійна здатність легень, функція правого шлуночка та біомаркери, серед яких велику увагу приділяють новому — ST2 родини рецепторів інтерлейкіна–1 [7]. Наразі проходять дослідження, що мають за мету провести диференційну діагностику між ізольованою та комбінованою посткапілярною ЛГ за допомогою так званих негемодинамічних маркерів.
Патогенез ЛГ–ЛВС тісно пов’язаний із роз–витком серцевої недостатності (СН). При систолічній дисфункції ЛШ, коли не вся кров викидається, та при діастолічній дисфункції, коли ЛШ недостатньо розслабляється, спостерігається підвищення кінцево–діастолічного тиску ЛШ. Це спонукає ліве передсердя працювати з більшим навантаженням, адже в діастолу кров має рухатися з передсердя в ЛШ. В кінцевому результаті це закінчується ремоделюванням, систолічною та діастолічною дисфункцією лівого передсердя, підвищенням тиску в лівому передсерді (рис. 3).
При ураженні мітрального клапана, особливо стенозі, ці процеси в лівому передсерді відбуваються дуже рано.
Причиною діастолічної дисфункції ЛШ найчастіше є його гіпертрофія на фоні артеріальної гіпертензії. Але вона може розвиватися і за так званим нетиповим механізмом на фоні інших прозапальних захворювань (наприклад, ожиріння, хронічна хвороба нирок, анемія, цукровий діабет, хронічні обструктивні захворювання легень). Ця нетипова модель виникнення СНзбФВ наведена на рис. 4 [8, 9]. В даному випадку ключовими моментами розвитку СНзбФВ є такі:
1) наявність кардіоваскулярного або некардіоваскулярного захворювання, що індукує прозапальні процеси. Так, вісцеральне ожиріння є маркером несприятливого прогнозу у пацієнтів із СНзбФВ [10], при якому відбувається інфільтрація макрофагів у жирову тканину та збільшення продукції ними прозапальних цитокінів [11]. При захворюваннях нирок, особливо на фоні артеріальної гіпертензії і збільшення вживання солі, порушується секреція прозапальних цитокінів, що збільшує оксидативний стрес [12]. При анемії та залізодефіцитному стані активується імунна відповідь та знову ж таки оксидативний стрес [13, 14];
2) прозапальні фактори порушують функцію ендотелію, що призводить до субендотеліальної міграції циркулюючих лейкоцитів та порушення біодо–ступності оксиду азоту;
3) обмеження біодоступності NO стають причиною зниження активності протеїнкінази G в кардіоміоцитах;
4) зниження активності протеїнкінази інгібує гіпертрофію кардіоміоцитів, індукуючи концентричне ремоделювання та підвищуючи їх жорсткість через порушення фосфорилювання гігантського протеїну титину. Титин — це цитоскелетний білок, що обмежує розтягування (при розслабленні) та стискання (при скороченні) кардіоміоцита. При порушенні його фосфорилювання збільшується жорсткість міокарда [15]. Окрім того, збільшенню жорсткості сприяє накопичення колагену через міграцію фібробластів;
5) збільшена жорсткість стінок призводить до дисфункції ЛШ.
Якщо говорити про ожиріння, то в літературі можна знайти також термін «жирова кардіоміопатія», що означає клінічний синдром, який характеризується розвитком ексцентричної гіпертрофії ЛШ (дилатація без потовщення стінок) та діастолічної дисфункції ЛШ [16–18]. Вважається, що велика кількість тригліцеридів відкладається в кардіоміоцитах (стеатоз кардіоміцитів) з подальшою стимуляцією апоптозу та фіброзу [19, 20]. Міокардіальний стеатоз візуалізується при магнітно–резонансному дослідженні серця [19] і є пре–диктором діастолічної дисфункції ЛШ. Фактично стеатоз міокарда схожий на стеатоз печінкових клітин, про який існує вже досить інформації, і лікарі звикли до існування такого терміну. Окрім того, при ожирінні зазвичай відбувається перенавантаження ЛШ об’ємом, адже для підтримання існування великої маси тіла необхідно мати високий хвилинний об’єм крові. Збільшення навантаження додатково сприяє розвитку ексцентричної гіпертрофії та дисфункції ЛШ із часом.
З огляду на те, що кров — це рідина, яка не стискається, підвищення тиску в лівому передсерді призводить до його підвищення в легеневих венах та капілярах (рис. 3). У відповідь включається захисний рефлекс Китаєва, який обме– жує притік крові в легеневі капіляри через спазм артеріол і таким чином зменшує тиск у капілярах, що попереджує виникнення набряку легень. Спазм легеневих артеріол призводить до підвищення тиску в легеневих артеріях. Згодом до функціональних змін приєднуються органічні — відбувається ремоделювання артерій (переважно дистальних діаметром < 500 мкм): потовщення інтими, гіпертрофія медії, розростання сполучної тканини [4, 21]. Ці зміни схожі на ті, що відбуваються в пацієнтів із ЛАГ.
Проте не можна стверджувати, що ЛАГ та ЛГ–ЛВС мають однакові патогенетичні механізми і мають лікуватися однаково. Відмінності між цими формами ЛГ подані на рис. 5.
По–перше, при цих формах є різниця в морфологічних змінах: при ЛГ–ЛВС найбільшого ураження та ремоделювання зазнають саме венозні судини (розширення та потовщення), капіляри (дилатація, інтерстиціальний набряк, альвеолярна геморрагія) та лімфатичні судини і вузли, чого ніколи не відбувається у пацієнтів першої групи (ЛАГ) (рис. 5) [22]. При ізольованій ЛГ–ЛВС зміни артерій є зовсім мінімальними, при комбінованій — більш вираженими (гемодинамічно легеневий опір > 3 од. Вуда), але вони ніколи не досягають такого ступеня, як у пацієнтів з ЛАГ [23, 24]. Специфічні препарати, схвалені для лікування ЛАГ (група 1), діють саме на дистальні легеневі артерії і ніяк не можуть вплинути на вени. Саме тому у пацієнтів з ЛГ–ЛВС, у яких ураження артерій є мінімальними, призначення специфічної терапії не є виправданим, адже в них немає мішені, на яку треба впливати. У пацієнтів з ЛГ–ЛВС все починається з підвищення тиску в лівому передсерді на фоні його систолічної та/або діастолічної дисфункції. Ударний об’єм може бути знижений через систолічну (при зниженій фракції викиду) або діастолічну (збережена фракція викиду) дисфункцію лівого шлуночка або через клапанні ураження. Призначення специфічної терапії не призводить до покращення функції лівих відділів серця. Навпаки, дилатація дистальних легеневих артерій буде збільшувати притік крові в ліві відділи, що не спроможні перегнати цю збільшену кількість крові, і це може призводити до ще більшої дилатації лівих відділів та збільшення (а не зменшення) тиску в легеневій артерії.
По–друге, при ЛАГ тиск у лівому передсерді та лівому шлуночку є нормальним (рис. 5). Найбільше страждає правий шлуночок через значне збільшення постнавантаження (опору легеневих артерій). При цьому його дилатація — це компенсація, спрямована на збільшення скоротливості (за механізмом Франка — Старлінга) для проштовхування крові в легеневі артерії, а не результат зниження скоротливості міокарда, як це буває при захворюваннях лівих відділів серця. Затримка рідини при ЛАГ в венах великого кола кровообігу (підвищення центрального венозного тиску) відбувається не через ураження кардіоміоцитів правого шлуночка, а через значне збільшення саме опору легеневих артерій, коли потужність правого шлуночка є недостатньою. Доказами цього є швидке зменшення розмірів правого шлуночка після проведення трансплантації легень, що зменшує опір легеневих артерій. Якщо б скоротливість правого шлуночка страждала саме через ураження кардіоміоциту, то такого швидкого повернення (за 2 тижні) до нормальних розмірів ніколи б не відбулося. Тому препарати (інгібітори ангіотензинперетворюючого ферменту, бета–блокатори), що застосовують для лікування серцевої недостатності, викликаної ураженням лівих відділів серця, не можуть застосовуватися для лікування ЛАГ, адже немає місця дії — уражених кардіоміоцитів. Ці препарати зазвичай призводять до зниження системного артеріального тиску, що негативно відображається на клінічному перебігу ЛАГ. І більше того, зменшення частоти серцевих скорочень при призначенні бета–блокаторів може зменшувати хвилинний об’єм крові (ХОК), що визначається як ударний об’єм ´ ЧСС. Ударний об’єм у пацієнтів з ЛАГ часто є зниженим, і ХОК підтримується лише за рахунок ЧСС. Зниження ЧСС призводить до зниження ХОК, і якщо до цього в пацієнта не було синкопальних станів, то вони можуть з’явитися на фоні бета–блокаторів.
Таким чином, збільшення опору легеневих артерій — це єдина спільна риса ЛАГ та комбінованої ЛГ–ЛВС, але все інше є різним, і тому не можна говорити про спільні патогенетичні механізми виникнення і, відповідно, про однакове лікування. В іншому випадку всі інші форми ЛГ, що супроводжуються підвищенням опору легеневих судин (захворювання легень, хронічна тромбоемболічна ЛГ), слід було б також об’єднати в одну групу (за спільним патогенезом).
Діагностика. Хоча катетеризація правих відділів серця є золотим стандартом діагностики ЛГ, її неможливо проводити всім підряд пацієнтам. Тому останніми рекомендаціями запропоновано алгоритм діагностики (рис. 6), що включає три етапи: 1) визначення клінічного фенотипу пацієнта за показниками, які характерні для пацієнтів з ЛГ–ЛВС (група 2), та проведення інструментальних і лабораторних методів дослідження; 2) визначення за результатами обстежень ймовірності наявності ураження лівих відділів серця та необхідності проведення інвазивної діагностики; 3) проведення оцінки гемодинамічних показників, включаючи провокативні тести в певних випадках [3].
При визначенні фенотипу враховують наявність факторів ризику виникнення дисфункції ЛШ (вік, ожиріння, артеріальна гіпертензія, цукровий діабет, дисліпідемія, ішемічна хвороба серця, фібриляція передсердь). Важливо, що фібриляція передсердь діагностується лише у 10 % пацієнтів з ідіопатичною ЛАГ та у 42 і 54 % при так званій атиповій ЛАГ та ЛГ, асоційованій з СНзбФВ. Окрім того, оцінюють показники ехокардіографії (фракція викиду, діастолічна дисфункція, збільшення лівого передсердя, ознаки наявності ЛГ та вад серця), візуалізуючих методів (компьютерної томографії, магнітно–резонансної томографії) та рівень біомаркерів. Виключаються інші причини ЛГ, а саме системні захворювання сполучної тканини та тромбоемболія легеневої артерії. При цьому інколи важко без катетеризації визначитися з причиною ЛГ. Так, при системній склеродермії може спостерігатися ураження лівих відділів серця. Хронічна тромбоемболічна ЛГ часто виникає у пацієнтів похилого віку з супутніми серцевими проблемами, в тому числі фібриляцією передсердь та ішемічною хворобою серця [25].
Різні системи оцінки ймовірності наявності ураження лівих відділів серця при збереженій фракції викиду були запропоновані в декількох роботах [26–30], але останніми в 2019 році на Європейському конгресі кардіологів у Парижі були надані рекомендації з діагностики СНзбФВ [31]. Згідно з цими рекомендаціями пропонується оцінювати ймовірність СНзбФВ за критеріями, наведеними у табл. 4. Якщо пацієнт набирає 5 та більше балів, ймовірність є дуже високою й інвазивні втручання не проводяться (рис. 7). Якщо менше 2 балів, то ймовірність є низькою, і пацієнту при наявності ехокардіографічних ознак легеневої гіпертензії треба проводити визначення гемодинамічних показників (рис. 7). Якщо кількість балів становить 2–4, то потрібно проводити або неівазивний діастолічний стрес–тест (за допомогою ехокардіографії), або катетеризацію правих відділів серця (особливо у випадках збільшеного розміру правого шлуночка), яку бажано виконувати в спеціалізованих центрах [2].
При проведенні КПС особливу увагу звертають на величину тиску заклинювання легеневої артерії (ТЗЛА): якщо вона перевищує 15 мм рт.ст., діагноз посткапілярної ЛГ вважається встановленим, якщо вона менше за 12 мм рт.ст., то вона є прекапілярною, якщо вона становить 13–15 мм рт.ст., необхідно проводити провокативні тести, особливо якщо пацієнти мають багато факторів ризику виникнення СНзбФВ (рис. 7). Із провокативних тестів зазвичай використовують тест з фізичним навантаженням або перенавантаження рідиною. При його проведенні збільшення ТЗЛА вище від певної величини дозволяє діагностувати приховану посткапілярну ЛГ.
Досвід деяких спеціалізованих центрів показує, що серед пацієнтів з ідіопатичною прекапілярною ЛГ збільшується кількість тих, хто має так звану нетипову ідіопатичну ЛГ. Цей термін вперше було застосовано в дослідженні AMBITION, і він включає пацієнтів з прекапілярною ЛГ та багатьма (> 3) факторами ризику розвитку СНзбФВ (артеріальна гіпертензія, ожиріння, фібриляція передсердь, цукровий діабет, ішемічна хвороба серця, похилий вік) та/або з ТЗЛА 13–15 мм рт.ст. при опорі легеневих судин < 500 дин ´ с/см–5 [32]. Припускається, що такі пацієнти знаходяться в перехідній стадії до розвитку серцевої недостатності зі збереженою фракцією викиду. Принаймі чітко встановлено, що при ТЗЛА 13–15 мм рт.ст. є в 4,5 раза більшими шанси отримати значне підвищення ТЗЛА при фізичному навантаженні (стрес–індуковане), що є характерним для діастолічної дисфункції лівого шлуночка [34, 35]. У дослідженні LeVarge показано, що точність вимірювання ТЗЛА залежить від дихального циклу, і якщо його вимірювати при звичайному диханні, то у 44 % когорти з посткапілярним фенотипом та ТЗЛА < 15 мм рт.ст. після повторного вимірювання в кінці видиху виявляється ТЗЛА > 15 [36]. Окрім того, зроблено припущення, що ТЗЛА на початкових стадіях, можливо, ще не відображає реальний кінцево–діастолічний тиск у лівому шлуночку, і більш точно можна говорити про ураження лівих відділів серця лише після вимірювання кінцево–діастолічного тиску напряму при катетеризації лівих відділів. Саме тому під час дослідження AMBITION, коли експертний комітет побачив зростаючу кількість включених хворих з атиповою ЛАГ, були змінені критерії включення/виключення для того, щоб бути впевненими в результатах специфічного лікування саме для групи 1 (ЛАГ) при довготривалому спостереженні [37]. Адже відомо, що у пацієнтів з атиповою ЛАГ вплив специфічної терапії на функціональні можливості (толерантність до фізичного навантаження, ступінь задишки, динаміка рівня біомаркерів) є меншим, ніж у пацієнтів з типовою ЛАГ, хоча вплив на прогноз вірогідно не відрізняється [33]. Частота відміни специфічної монотерапії була більшою в пацієнтів з атиповою ЛАГ.
У нашої пацієнтки було багато факторів ризику виникнення СНзбФВ: ожиріння, артеріальна гіпертензія, цукровий діабет, дисліпідемія, фібриляція передсердь. Але, за даними візуалізуючих методів дослідження, праві відділи серця переважали над лівими, та розрахований тиск у легеневій артерії був дуже високим. Тому, незважаючи на те, що вірогідність наявності СНзбФВ становила 5 балів, КПС все ж таки була проведена, але вона підтвердила, що ЛГ пов’язана з лівими відділами серця і що запропоновані Європейським товариством покроковий алгоритм і система оцінки наявності СНзбФВ працюють на практиці. Додатково при проведенні коронарографії встановлено діагноз ішемічної хвороби серця з гемодинамічно значущими стенозами коронарних артерій, що сприяло дисфункції лівого шлуночка та потребувало лікування.
Лікування. В рекомендаціях Європейського товариства кардіологів 2015 р. з діагностики та лікування ЛГ міститься алгоритм призначення специфічних препаратів для пацієнтів з ЛАГ, що базується на результатах багатоцентрових рандомізованих клінічних досліджень. Завдяки цим дослідженням регуляторні органи схвалили наступні групи препаратів для поліпшення симптомів, толерантності до фізичного навантаження, гемодинаміки та прогнозу: блокатори ендотелінових рецепторів, блокатори фосфодіестерази–5, стимулятори гуанілатциклази, аналоги простацикліну та агоністи простациклінових рецепторів. Але спроби застосування цих препаратів у пацієнтів з ЛГ–ЛВС не мали позитивних результатів, за виключенням декількох одноцентрових досліджень. Більше того, дослідження SIOVAC вперше наочно продемонструвало негативний вплив специфічного препарату сілденафіл на частоту виникнення несприятливих подій у пацієнтів з резидуальною ЛГ–ЛВС, які перенесли оперативні втручання з приводу клапанних уражень [38]. У табл. 5 наведені дані 12 рандомізованих клінічних досліджень (11 з яких є багатоцентровими), в яких використовували блокатори ендотелінових рецепторів, простацикліни, блокатори фосфодіестерази–5 та стимулятори гуанілатциклази у хворих з серцевою недостатністю зі збереженою та зниженою фракцією викиду (СНЗФВ) або при клапанних ураженнях. В 6 спостереженнях пацієнти частково або виключно всі мали ЛГ. Цікаво, що смертність була вищою в групі активного лікування в 9 із 12 досліджень, зокрема в 5 із 6 спостережень, що точно включали пацієнтів з ЛГ. Це викликає певне занепокоєння щодо безпечності застосування специфічних препаратів для лікування ЛГ у пацієнтів з ураженням лівих відділів серця. За твердженням провідного фахівця в галузі ЛГ професора N. Galie, враховуючи результати цих досліджень, необхідно рівень доказовості щодо рекомендації не застосовувати ЛАГ–специфічні препарати в пацієнтів з ЛГ–ЛВС підняти з С до В [39].
Причинами негативного впливу ЛАГ–специфічних препаратів у пацієнтів з ЛГ–ЛВС, як вказувалося вище, може бути зниження системного артеріального тиску, затримка рідини, збільшення навантаження на ліві відділи через прекапілярну вазодилатацію і посилиння притоку крові, як це спостерігається на фоні гострого призначення оксиду азоту при вазореактивному тесті [40]. У дослідженні SIOVAC гостре призначення сілденафілу супроводжувалося зниженням тиску в легеневій артерії та збільшенням ХОК, але при довготривалому використанні призводило до дилатації лівого та правого шлуночків, що свідчило про можливий негативний інотропний ефект. Цікаво, що застосування пристроїв для підтримки функції лівого шлуночка у пацієнтів зі зниженою фракцією викиду та комбінованою ЛГ–ЛВС знижувало тиск заклинювання легеневої артерії, тиск у легеневій артерії та опір легеневих судин вже через 3 дні, призводячи до їх повної нормалізації після 6–го тижня використання [41]. Цей феномен можна пояснити зворотністю ремоделювання дистальних легеневих артерій у відповідь на тривалу нормалізацію тиску заклинювання при застосуванні пристроїв. Таким чином, вплив на першопричину (зниження тиску в лівому передсерді) є основною стратегією лікування пацієнтів з ізольованою та комбінованою ЛГ–ЛВС, а вплив лише на дистальні легеневі артерії є не ефективним, а, можливо, шкідливим.
Проте слід зазначити, що для пацієнтів зі зниженою фракцією викиду та клапанними ураженнями існують ефективні схеми лікування, тоді як для пацієнтів зі збереженою фракцією викиду недостатньо препаратів з доведеним позитивним впливом [7, 42]. Потрібно проводити більше досліджень щодо оцінки впливу терапії на прогноз для цієї категорії хворих. Наразі можна виділити лише окремі препарати (табл. 6), що в більшому або меншому ступені показали ефективність у пацієнтів із СНзбФВ [8]. При цьому, якщо розділити їх ефективність залежно від фракції викиду, позитивні результати стосуються лише хворих з помірно зниженою фракцією викиду (40–49 %), при фракції викиду > 50 % зазначені препарати не показали суттєвого позитивного впливу.
Окрім медикаментозного лікування, велику роль у поліпшенні стану хворих і прогнозу відіграє немедикаментозне лікування та модифікація способу життя. Як вказувалося вище, ожиріння часто супроводжує СНзбФВ. Навіть при атиповій ЛАГ воно зустрічається в 30–40 % пацієнтів [45–47]. Підвищена смертність спостерігається в пацієнтів з індексом маси тіла > 40 кг/м2 та віком до 65 років (співвідношення шансів — 3,01). Гірші функціональний клас і результати 6–хвилинного тесту були у хворих з індексом маси тіла > 30 кг/м2 [48, 49]. Все це вказує на необхідність контролю ваги тіла у пацієнтів з будь–якою ЛГ. Баріатричні операції для пацієнтів можуть обговорюватися для зменшення ступеня тяжкості ЛГ, адже в дослідженнях продемонстровано зниження тиску в правому шлуночку та легеневій артерії після проведених оперативних утручань [50, 51]. При цьому баріатричні операції переносилися добре і 30–денна смертність була низькою. При жировій кардіоміопатії зниження маси на 2,5 кг покращувало скоротливість ЛШ, його діастолічну функцію та функцію ендотелію [52, 53]. Причому найкращі результати досягалися при застосуванні дієт та збільшенні фізичної активності порівняно з використанням лише дієт. Вплив фармакологічних препаратів для схуднення на серце залишається недостатньо вивченим.
Ожиріння часто супроводжується іншими патологічними станами, як, наприклад, синдром нічного апное та синдром альвеолярної гіповентиляції, що супроводжуються розвитком гіпоксії, яка сама по собі пов’язана із розвитком ЛГ [54]. У цьому випадку зниження маси тіла сприяє не тільки покращенню функції ЛШ, але й зменшенню гіпоксії та, відповідно, ЛГ. Окрім того, лікування апное за допомогою СРАР (постійний позитивний тиск на видиху) також асоціюється зі зменшенням тиску в легеневій артерії.
Цукровий діабет та інсулінорезистентність чинять вплив на прогноз у пацієнтів з ЛАГ та функцію правого шлуночка [55, 56]. Тому контроль глюкози може асоціюватися з поліпшенням прогнозу. Гіпер–урикемія часто спостерігається в пацієнтів з ЛГ, і деякі автори вважають, що вона може відігравати певну роль у виникненні ЛГ або збільшенні її ступеня [57, 58]. Хронічна гіперурикемія може асоціюватися з підвищенням рівня ендотеліну, зниженням продукції оксиду азоту та зменшенням дилатації судин у відповідь на збільшення кровотоку (ознаки ендотеліальної дисфункції).
Таким чином, лікування ЛГ–ЛВС повинно базуватися на контролі факторів ризику та супутніх станів, а не на призначенні специфічної терапії. Наша пацієнтка отримувала стандартну терапію гіпертонічної хвороби, ішемічної хвороби серця та цукрового діабету, яка може застосовуватися зокрема при СНзбФВ. Окрім того, використовувалися петльові діуретики для зменшення проявів затримки рідини, стентування для покращення коронарного кровотоку та антикоагулянтна терапія для попередження тромбоемболічних ускладнень. У подальшому обов’язково має бути рекомендованою модифікація способу життя, спрямована на зниження маси тіла. Спостереження та, можливо, лікування потребує збільшений рівень сечової кислоти.
Особливості даного випадку:
— незважаючи на велику кількість факторів ризику виникнення серцевої недостатності, проведені стандартні методи дослідження не дозволили однозначно стверджувати, що причиною ЛГ є ураження лівих відділів серця;
— застосування інвазивних методів дослідження дозволило класифікувати групу ЛГ (катетеризація правих відділів серця) та визначитися з причинами (коронаровентрикулографія);
— запропонована Європейським товариством кардіологів (2019) схема оцінки ймовірності СНзбФВ може застосовуватися на практиці для пацієнтів нашої країни, що дозволить уникнути дорогих інвазивних методів діагностики (катетеризація правих відділів серця) та лікування (специфічна терапія ЛАГ).
Конфлікт інтересів. Не заявлений.
1. Strange G., Playford D., Stewart S. et al. Pulmonary hypertension: prevalence and mortality in the Armadale echocardiography cohort. Heart. 2012. № 98(24). Р. 1805–1811. doi: 10.1136/heartjnl–2012–301992.
2. Galiи N., Humbert M., Vachiery J.L. et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur. Respir. J. 2015. № 46. Р. 903–975. doi: 10.1183/13993003.01032–2015.
3. Vachiйry J., Tedford R., Rosenkranz S. et al. Number 9 in the series “Proceedings of the 6th World Symposium on Pulmonary Hypertension”. Ed. by N. Galiи, V.V. McLaughlin, L.J. Rubin, G. Simonneau. ERJ Express. 2018; in press [https://doi.org/10.1183/13993003.01897–2018].
4. Vachiery J.L., Adir Y., Barbera J.A. et al. Pulmonary hypertension due to left heart disease. J. Am. Coll. Cardiol. 2013. № 62. D100–D108.
5. Fayyaz A.U., Edwards W.D., Maleszewski J.J. et al. Global pulmonary vascular remodeling in pulmonary hypertension associated with heart failure and preserved or reduced ejection fraction. Circulation. 2018. № 137. Р. 1796–1810.
6. Baumgartner H., Falk V., Bax J.J. et al.; ESC Scientific Document Group. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eu Heart J. 2017. № 38. Р. 2739–2791.
7. Ponikowski P., Voors A.A., Anker S.D. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2016. № 37. Р. 2129–2200. doi: 10.1093/eurheartj/ehw128.
8. Albakri A. Heart failure with preserved ejection fraction: A review of clinical status and meta–analysis of diagnosis by myocardial strain and effect of medication on mortality and hospita–lization. Int. Med. Care. 2018. № 2(2). Р. 1–12. doi: 10.15761/IMC.1000120.
9. Lund L.H., Donal E., Oger E. et al.; KaRen Investigators. Association between cardiovascular vs. non–cardiovascular co-morbidities and outcomes in heart failure with preserved ejection fraction. Eur. J. Heart Fail. 2014. № 16. Р. 992–1001. doi: 10.1002/ejhf.137.
10. Haass M., Kitzman D.W., Anand I.S. et al. Body mass index and adverse cardiovascular outcomes in heart failure patients with preserved ejection fraction: results from the Irbesartan in Heart Failure with Preserved Ejection Fraction (I–PRESERVE) trial. Circ. Heart Fail. 2011. № 4(3). Р. 324–31. doi: 10.1161/CIRCHEARTFAILURE.110.959890.
11. Lam C.S., Lyass A., Kraigher–Krainer E. et al. Cardiac dysfunction and non–cardiac dysfunction as precursors of heart failure with reduced and preserved ejection fraction in the community. Circulation. 2011. № 124(1). Р. 24–30. https://doi.org/10.1161/CIRCULATIONAHA. 110.979203
12. Hummel S.L., Seymour E.M., Brook R.D. et al. Low–sodium dietary approaches to stop hypertension diet reduces blood pressure, arterial stiffness, and oxidative stress in hypertensive heart failure with preserved ejection fraction. Hypertension. 2012. № 60(5). Р. 1200–6. doi: 10.1161/HYPERTENSIONAHA.112.202705.
13. Tian N., Moore R.S., Braddy S. et al. Interactions between oxidative stress and inflammation in salt–sensitive hypertension. Am. J. Physiol. Heart Circ. Physiol. 2007. № 293. H3388–H3395. https://doi.org/10.1152/ajpheart.00981.200
14. Macdougall I.C., Canaud B., de Francisco A.L. et al. Beyond the cardiorenal anaemia syndrome: recognizing the role of iron deficiency. Eur. J. Heart Fail. 2012. № 14. Р. 882–886. https://doi.org/10.1093/eurjhf/hfs056
15. Borbйly A., Falcao–Pires I., van Heerebeek L. et al. Circulation Research. 2009. № 104. Р. 780–786. https://doi.org/10.1161/CIRCRESAHA.108.193326
16. Hunt S.A.; American College of Cardiology, American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American college of Cardiology/American heart association task force on practice guidelines (writing committee to update the 2001 guidelines for the evaluation and management of heart failure). Journal of the American College of Cardiology. 2005. № 46(6). e1–e82. doi: 10.1016/j.jacc.2005.08.022.
17. Kenchaiah S., Evans J.C., Levy D. et al. Obesity and the risk of heart failure. The New England Journal of Medicine. 2002. № 347(5). Р. 305–313. doi: 10.1056/NEJMoa020245.
18. Wong C.Y., Moore–Sullivan T.O., Leano R. et al. Alterations of left ventricular myocardial characteristics associated with obesity. Circulation. 2004. № 110(19). Р. 3081–3087. doi: 10.1161/01.CIR.0000147184.13872.0F.
19. Rijzewijk L.J., van der Meer R.W., Smit J.W. et al. Myocardial steatosis is an independent predictor of diastolic dysfunction in type 2 diabetes mellitus. Journal of the American College of Cardiology. 2008. № 52(22). Р. 1793–1799. doi: 10.1016/j.jacc.2008.07.062.
20. Wong C., Marwick T. Obesity cardiomyopathy: pathoge–nesis and pathophysiology. Nature Clinical Practice Cardiovascular Medicine. 2007. № 4(8). Р. 436–443. doi: 10.1038/ncpcardio0943.
21. Gerges M., Gerges C., Lang I.M. How to define pulmonary hypertension due to left heart disease. Eur. Respir. J. 2016. № 48. Р. 553–555. doi: 10.1183/13993003.00432–2016.
22. Delgado J.F., Conde E., Sanchez V. et al. Pulmonary vascular remodeling in pulmonary hypertension due to chronic heart failure. Eur. Heart Fail. 2005. № 7. Р. 1011–1016. doi: 10.1016/j.ejheart.2004.10.021.
23. Charalampopoulos A., Lewis R., Hickey P. et al. Pathophysiology and Diagnosis of Pulmonary Hypertension Due to Left Heart Disease. Front. Med. (Lausanne). 2018. № 5. Р. 174. doi: 10.3389/fmed.2018.00174.
24. Galie N., Manes A., Palazzini M. The difficult diagnosis of pulmonary vascular disease in heart failure. Eur. Respir. J. 2016. № 48. Р. 311–314. doi: 10.1183/13993003.00854–2016.
25. Reddy Y.N.V., Carter R.E., Obokata M., Redfield M.M., Borlaug B.A. A simple, evidence–based approach to help guide diagnosis of heart failure with preserved ejection fraction. Circulation. 2018. № 138: Р. 861–870. doi: 10.1161/CIRCULATIONAHA.118.034646.
26. Bonderman D., Wexberg P., Martischnig A.M. et al. A noninvasive algorithm to exclude pre–capillary pulmonary hypertension. Eur. Respir. J. 2011. № 37. Р. 1096–1103. doi: 10.1183/09031936.00089610.
27. Opotowsky A.R., Ojeda J., Rogers F. et al. A simple echocardiographic prediction rule for hemodynamics in pulmonary hypertension. Circ. Cardiovasc. Imaging. 2012. № 5. Р. 765–775. doi: 10.1161/CIRCIMAGING.112.976654.
28. D’Alto M., Romeo E., Argiento P. et al. Echocardiographic prediction of pre– versus postcapillary pulmonary hypertension. J. Am. Soc. Echocardiogr. 2015. № 28. Р. 108–115. doi: 10.1016/j.echo.2014.09.004.
29. Jacobs W., Konings T.C., Heymans M.W. et al. Noninvasive identification of left–sided heart failure in a population suspected of pulmonary arterial hypertension. Eur. Respir. J. 2015. № 46. Р. 299–302. doi: 10.1183/09031936.00202814.
30. Berthelot E., Montani D., Algalarrondo V. et al. A clinical and echocardiographic score to identify pulmonary hypertension due to HFpEF. J. Card. Fail. 2017. № 23. Р. 29–35. doi: 10.1016/j.cardfail.2016.10.002.
31. Pieske B., Tschцpe C., de Boer R.A. et al. How to diagnose heart failure with preserved ejection fraction: the HFA–PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur. Heart J. 2019 Oct 21. № 40(40). Р. 3297–3317. doi: 10.1093/eurheartj/ehz641.
32. Mclaughlin V., Galie N., Barbera J. et al. A Comparison of Characteristics and Outcomes of Patients with Atypical and Classical Pulmonary Arterial Hypertension from the AMBITION Trial. American Journal of Respiratory and Critical Care Medicine. 2015. № 191. A2196. https://www.atsjournals.org/doi/abs/10.1164/ajrccm–conference.2015.191.1_Meeting Abstracts. A2196
33. Opitz C., Hoeper M., Gibbs J.S. et al. Pre–Capillary, Combined, and Post–Capillary Pulmonary Hypertension A Pathophysiological Continuum. Journal of the American College of Cardiology. 2016. № 68. Р. 368–378. doi: 10.1016/j.jacc.2016.05.047.
34. Franssen C., Paulus W. Normal resting pulmonary artery wedge pressure: a diagnostic trap for heart failure with preserved ejection fraction. European Journal of Heart Failure. 2015. № 17. Р. 132–134. doi: 10.1002/ejhf.225.
35. Paulus W.J., Tschцpe C., Sanderson J.E. et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur. Heart J. 2007. № 28. Р. 2539–2550. doi: 10.1093/eurheartj/ehm037.
36. LeVarge B., Pomerantsev E., Channick R. Reliance on end–expiratory wedge pressure leads to misclassification of pulmonary hypertension. European Respiratory Journal. 2014. № 44. Р. 425–434. doi: 10.1183/09031936.00209313.
37. Galiи N., Barberа J.A., Frost A.E. et al., for the AMBITION Investigators Initial Use of Ambrisentan plus Tadalafil in Pulmonary Arterial Hypertension. N. Engl. J. Med. 2015. № 373. Р. 834–44. doi: 10.1056/NEJMoa1413687.
38. Bermejo J., Yotti R., Garcнa–Orta R. et al. Sildenafil for improving outcomes in patients with corrected valvular heart disease and persistent pulmonary hypertension: a multicenter, double–blind, randomized clinical trial. Eur. Heart J. 2018. № 39. Р. 1255–1264. doi: 10.1093/eurheartj/ehx700.
39. Galie N., Manes A., Dardi F., Palazzini M. Aiming at the appropriate target for the treatment of pulmonary hypertension due to left heart disease European Heart Journal. 2018. № 39. Р. 1265–1268. https://doi.org/10.1093/eurheartj/ehx751
40. Loh E., Stamler J.S., Hare J.M., Loscalzo J., Coluc– ci W.S. Cardiovascular effects of inhaled nitric oxide in patients with left ventricular dysfunction. Circulation. 1994. № 90. Р. 2780–2785. doi: 10.1161/01.cir.90.6.2780.
41. Zimpfer D., Zrunek P., Roethy W. et al. Left ventricular assist devices decrease fixed pulmonary hypertension in cardiac transplant candidates. J. Thorac. Cardiovasc. Surg. 2007. № 133. Р. 689–695. DOI: 10.1016/j.jtcvs.2006.08.104.
42. Baumgartner H., Falk V., Bax J.J. et al.; ESC Scientific Document Group. 2017 ESC/EACTS Guidelines for the ma–nagement of valvular heart disease. Eur. Heart J. 2017. № 38. Р. 2739–2791. doi: 10.1093/eurheartj/ehx391.
43. Lund L., Claggett B., Liu J. et al. Heart failure with mid-range ejection fraction in CHARM: characteristics, outcomes and effect of candesartan across the entire ejection fraction spectrum. European Journal of Heart Failure. 2018. № 20. Р. 1230–1239. doi: 10.1002/ejhf.1149.
44. Cleland J.G.F., Bunting K.V., Flather M.D. et al.; Beta–blockers in Heart Failure Collaborative Group. Beta–blockers for heart failure with reduced, mid–range, and preserved ejection fraction: an individual patient–level analysis of double–blind randomized trials. Eur. Heart J. 2018. № 39. Р. 26–35. doi: 10.1093/eurheartj/ehx564.
45. Badesch D.B., Raskob G.E., Elliott C.G. et al. Pulmonary arterial hypertension: baseline characteristics from the REVEAL Registry. Chest. 2010. № 137. Р. 376–387. doi: 10.1007/s12471–017–0970–7.
46. Lang I., Palazzini M. The burden of comorbidities in pulmonary arterial hypertension. Eur. Heart J. Suppl. 2019 Dec. 21(suppl. K). K21–K28. doi: 10.1093/eurheartj/suz205.
47. Weatherald J., Huertas A., Boucly A. et al. Association between BMI and obesity with survival in pulmonary arterial hypertension. Chest. 2018. № 154. Р. 872–881. doi: 10.1016/j.chest.2018.05.006.
48. Poms A.D., Turner M., Farber H.W., Meltzer L.A., McGoon M.D. Comorbid conditions and outcomes in patients with pulmonary arterial hypertension: a REVEAL registry analysis. Chest. 2013. № 144. Р. 169–176. doi: 10.1378/chest.11–3241.
49. Weatherald J., Huertas A., Boucly A. et al. Is there an obesity paradox in pulmonary arterial hypertension? Eur. Respir. J. 2017. № 50. PA3521. doi: 10.1183/1393003.congress–2017.PA3521.
50. Hanipah Z.N., Mulcahy M.J., Sharma G. et al. Ba–riatric surgery in patients with pulmonary hypertension. Surg. Obes. Relat. Dis. 2018. № 14. Р. 1581–1586. doi: 10.1016/j.soard.2018.07.015.
51. Sheu E.G., Channick R., Gee D.W. Improvement in severe pulmonary hypertension in obese patients after laparoscopic gastric bypass or sleeve gastrectomy. Surg. Endosc. 2016. № 30. Р. 633–637. doi: 10.1007/s00464–015–4251–5.
52. Wirth A., Kroger H. Improvement of left ventricular morphology and function in obese subjects following a diet and exercise program. International Journal of Obesity. 1995. № 19(1). Р. 61–66. PMID: 7719394.
53. Wong C.Y., Byrne N.M., O’Moore–Sullivan T. et al. Effect of weight loss due to lifestyle intervention on subclinical cardiovascular dysfunction in obesity (body mass index >30 kg/m2). American Journal of Cardiology. 2006. № 98(12). Р. 1593–1598. doi: 10.1016/j.amjcard.2006.07.037.
54. Friedman S.E., Andrus B.W. Obesity and pulmonary hypertension: a review of pathophysiologic mechanisms. J. Obes. 2012. № 2012. Р. 505274. doi: 10.1155/2012/505274.
55. Whitaker M.E., Nair V., Sinari S. et al. Diabetes mellitus associates with increased right ventricular afterload and remode–ling in pulmonary arterial hypertension. Am. J. Med. 2018. № 131. Р. 702. e7–702.e13. doi: 10.1016/j.ajmed.2017.12.046.
56. Benson L., Brittain E.L., Pugh M.E. et al. Impact of diabetes on survival and right ventricular compensation in pulmonary arterial hypertension. Pulm. Circ. 2014. № 4. Р. 311–318. doi: 10.1086/675994.
57. Voelkel M.A., Wynne K.M., Badesch D.B. et al. Hyperuricemia in severe pulmonary hypertension. Chest. 2000. № 117(1). Р. 19–24. doi: 10.1378/chest.117.1.19.
58. Zharikov S.I., Swenson E.R., Lanaspa M. et al. Could uric acid be a modifiable risk factor in subjects with pulmonary hypertension? Medical Hypotheses. 2010. № 74(6). Р. 1069–1074. doi: 10.1016/j.mehy.2009.12.023.

/58-1.jpg)
/59-1.jpg)
/61-1.jpg)
/60-1.jpg)
/62-1.jpg)
/63-1.jpg)
/65-1.jpg)
/66-1.jpg)
/68-1.jpg)