Введение
Среди причин ранней заболеваемости и высокой инвалидизации среди недоношенных новорожденных преобладают геморрагические расстройства и внутрижелудочковые кровоизлияния. По данным разных авторов, геморрагические нарушения у недоношенных младенцев встречаются в 60–90 % случаев. Степень тяжести внутричерепных геморрагий и, в соответствии с ней, частота инвалидности и смерти у недоношенных возрастает по мере снижения срока гестации и массы тела. Так, если среди детей с очень низкой массой тела при рождении при отсутствии внутрижелудочковых кровоизлияний (ВЖК) летальность составляет 6,5 %, то при тяжелых кровоизлияниях — 70 % [1–4].
Цель исследования: выявить особенности клинических проявлений нарушения гемостаза и показателей коагулограммы у недоношенных новорожденных с врожденной пневмонией и различной массой тела в неонатальном периоде.
Материалы и методы
Проведено обследование 227 новорожденных, находившихся в родильном физиологическом отделении, отделении анестезиологии и реанимации (с палатами для новорожденных детей) и педиатрическом отделении для недоношенных новорожденных ГУ «РНПЦ «Мать и дитя». Дети поступали на лечение и выхаживание из 22 роддомов и отделений анестезиологии и реанимации учреждений здравоохранения Республики Беларусь в период с 2017 по 2019 г.
Метод исследования — проспективное клиническое исследование.
Критерии постановки диагноза «врожденная пневмония»: клинические и лабораторные данные, наличие инфильтративных теней на рентгенограмме легких в первые 72 часа жизни. Критериями исключения являлись: антенатально выявленные пороки развития, наличие генетических заболеваний и хромосомной патологии, рождение в результате применения вспомогательных репродуктивных технологий.
Проведено исследование системы гемостаза в пробах венозной крови на 1–2, 5–7 и 19–21-е сутки жизни.
Все новорожденные были разделены на четыре группы.
Первую исследуемую группу составили 55 новорожденных с низкой массой тела (1500–2499 г) при рождении, синдромом дыхательных расстройств и врожденной пневмонией, родившиеся в сроке гестации Ме (медиана) = 35,0 (33,0–36,0) недели, с массой тела Ме = 2080,0 (1870,0–2420,0) г, длиной тела Ме = 45,0 (42,0–46,0) см, окружностью головы Ме = 31,0 (31,0–33,0) см, окружностью груди Ме = 30,0 (28,0–31,0) см.
В группу сравнения вошли 53 условно здоровых недоношенных с низкой массой тела (1500–2499 г) при рождении и синдромом дыхательных расстройств, родившиеся в сроке гестации Ме = 35,0 (35,0–36,0) недели, с массой тела Ме = 2300,0 (2140,0–2400,0) г, длиной тела Ме = 45,0 (45,0–47,0) см, окружностью головы Ме = 32,0 (31,0–33,0) см, окружностью груди Ме = 30,0 (29,0–32,0) см.
При оценке показателей физического развития и срока гестации недоношенных новорожденных обеих групп с низкой массой тела — 1500–2499 г статистически значимых различий не выявлено.
Во второй исследуемой группе наблюдались 56 новорожденных с массой тела 500–1499 г, синдромом дыхательных расстройств и врожденной пневмонией, родившиеся в сроке гестации Ме = 28,0 (27,0–30,5) недели, с массой тела Ме = 1115,0 (945,0–1400,0) г, длиной тела Ме = 37,0 (34,0–40,0) см, окружностью головы Ме = 26,0 (25,0–28,0) см, окружностью груди Ме = 23,0 (21,5–25,5) см.
Контрольную группу составили 63 здоровых доношенных новорожденных, родившиеся в сроке гестации Ме = 39,0 (39,0–40,0) недели, с массой тела Ме = 3370,0 (3250,0–3620,0) г, длиной тела Ме = 52,0 (52,0–53,0) см, окружностью головы Ме = 35,0 (34,0–36,0) см, окружностью груди Ме = 34,0 (33,0–34,0) см.
Гемостазиограмма выполнялась на четырехканальном автоматическом коагулометре ACL-10000, Instrumentation Laboratory (США). Исследование показателей гемостаза в плазме крови проводилось реагентами Hemosil Normal Control Assayed (США). Для определения D-димера в сыворотке крови использовался полуавтоматический биохимический анализатор Clima MC-15 (Испания) турбидиметрическим методом реагентами производителя «P.Z. Cormay S.A.» (Польша). В гемостазиограмме оценивались показатели активированного частичного тромбопластинового времени (АЧТВ), коэффициента АЧТВ (R), протромбинового времени (ПВ), протромбинового индекса по Квику (ПИ), международного нормализованного отношения (МНО), тромбинового времени (ТВ), фибриногена и D-димера.
Карта обследования новорожденных детей и форма информированного согласия для выполнения исследований утверждены на заседании комиссии по медицинской этике государственного учреждения «Республиканский научно-практический центр «Мать и дитя».
Для каждого из обследованных новорожденных получено информированное согласие законных представителей на участие в исследовании.
Статистическая обработка данных выполнялась с помощью пакета программ Statistica 10 и Microsoft Excel. Нормальность распределения количественных признаков оценивалась тестами Колмогорова — Смирнова и Лиллиефорса. При нормальном распределении величин рассчитывалось среднее и его среднеквадратичное отклонение (М ± SD) с указанием доверительного интервала (± 95,5 ДИ), критерий Стъюдента (t). При отличном от нормального — Ме и интерквартильный размах (25–75 %), критерий Манна — Уитни (U). При сравнении показателя в нескольких независимых группах использовался непараметрический критерий Краскела — Уоллиса (Н) и для множественности сравнения критерий z. Для сравнения показателя в динамике применялся критерий Фридмана (χ2F) и критерий Вилкоксона (Т). Для определения статистически значимых различий качественных величин использовался хи-квадрат Пирсона (χ2), уточняющий критерий с поправкой Йетса (χ2Й) или точный критерий Фишера (F), уточняющий критерий — тест Фишера двусторонний (Fдв). При статистически значимых различиях проводился расчет отношения шансов (ОR) с доверительным интервалом (± 95,5% ДИ). Различия считали статистически значимыми при р < 0,05.
Результаты и обсуждение
Основными заболеваниями в группе условно здоровых недоношенных новорожденных являлись: дыхательное расстройство у новорожденного (код МКБ 10: Р22) — у 37 (69,8 %), неонатальная желтуха (код МКБ 10: Р59) — у 16 (30,2 %) младенцев. В первой исследуемой группе новорожденных с низкой массой тела при рождении наблюдались: врожденная пневмония (код МКБ 10: Р23) — у 55 (100,0 %), инфекционные болезни, специфичные для перинатального периода (код МКБ 10: Р37, Р39), — у 29 (52,7 %), бронхолегочная дисплазия (БЛД) (код МКБ 10: Р27.1) — у 1 (1,8 %) младенца. Во второй исследуемой группе у недоношенных с очень низкой и экстремально низкой массой тела при рождении врожденная пневмония регистрировалась у 56 (100,0 %), инфекционные болезни, специфичные для перинатального периода, — у 20 (35,7 %), БЛД — у 24 (42,9 %), врожденный сепсис (код МКБ 10: Р36) — у 4 (7,1 %) младенцев.
В группе условно здоровых новорожденных регистрировались следующие виды геморрагических расстройств: ВЖК I степени — у 3 (5,7 %) новорожденных, геморрагический синдром — у 3 (5,7 %). В первой исследуемой группе ВЖК I степени наблюдались у 11 (20,0 %), III степени — у 3 (5,5 %) новорожденных, геморрагический синдром — у 10 (18,2 %) младенцев. Во второй исследуемой группе ВЖК I степени регистрировались у 11 (19,6 %), II степени — у 9 (16,1 %), III степени — у 9 (16,1 %) и IV степени — у 4 (7,1 %) новорожденных, геморрагический синдром — у 18 (32,1 %) младенцев.
Проведен анализ показателей свертываемости крови у недоношенных новорожденных на 1–2-е сутки жизни (табл. 1).
В первые двое суток жизни статистически значимо более высокие показатели АЧТВ (р < 0,001), коэффициента R (р < 0,001), ПВ (р < 0,001), МНО (р < 0,001), ТВ (р < 0,001), D-димера (р < 0,001) на фоне низких значений ПИ (р < 0,001) и фибриногена (р < 0,001) регистрировались у условно здоровых недоношенных по сравнению со здоровыми доношенными.
Похожая картина, но с более высокими значениями АЧТВ (р = 0,004, р < 0,001), коэффициента R (р = 0,007, р < 0,001), ПВ (р = 0,004, р < 0,001), МНО (р = 0,002, р < 0,001), ТВ (р < 0,001, р < 0,001), D-димера (р = 0,002, р < 0,001) на фоне низких значений ПИ (р < 0,001) и фибриногена (р < 0,001) соответственно отмечалась у недоношенных новорожденных с низкой массой тела и врожденной пневмонией по сравнению с данными коагулограмм условно здоровых недоношенных и новорожденными группы контроля.
Наиболее статистически значимые различия высоких значений АЧТВ (р < 0,001, р < 0,001), коэффициента R (р < 0,001, р < 0,001), ПВ (р < 0,001, р < 0,001), МНО (р < 0,001, р < 0,001), ТВ (р < 0,001, р < 0,001), D-димера (р < 0,001, р < 0,001) на фоне низких значений ПИ (р < 0,001, р < 0,001) и фибриногена (р < 0,001, р < 0,001) соответственно отмечались у недоношенных новорожденных с очень низкой и экстремально низкой массой тела и врожденной пневмонией по сравнению с данными группы сравнения и группы контроля.
Вышеперечисленное свидетельствует о различной степени выраженности (в зависимости от срока гестации, массы тела и сопутствующей патологии) гипокоагуляции во всех фазах свертывания крови и повышенном фибринолизе у недоношенных новорожденных с различной массой тела всех групп в первые сутки жизни [5–8].
Проведен анализ показателей свертываемости крови у недоношенных новорожденных исследуемых групп на 5–7-е сутки жизни (табл. 2).
К концу раннего неонатального периода статистически значимо более высокие значения АЧТВ (р < 0,001), коэффициента R (р < 0,001), ПВ (р < 0,001), МНО (р = 0,003), ТВ (р < 0,001), D-димера (р < 0,001) на фоне низких ПИ (р < 0,001) и фибриногена (р < 0,001) выявлены у условно здоровых недоношенных по сравнению со здоровыми доношенными новорожденными.
Аналогичная картина, но с более высокой статистически значимой разницей между показателями АЧТВ (р = 0,003, р < 0,001), коэффициента R (р = 0,004, р < 0,001), ПВ (р = 0,001, р < 0,001), МНО (р < 0,001, р < 0,001), ТВ (р < 0,001, р < 0,001), D-димера (р < 0,001) на фоне низких значений ПИ (р = 0,003, р < 0,001) и фибриногена (р < 0,001) соответственно наблюдалась у недоношенных новорожденных с низкой массой тела и врожденной пневмонией по сравнению с данными коагулограмм условно здоровых недоношенных и группы контроля.
Похожая картина, но с наибольшей статистически значимой разницей между показателями АЧТВ (р < 0,001, р < 0,001), коэффициента R (р < 0,001, р < 0,001), ПВ (р < 0,001, р < 0,001), МНО (р < 0,001, р < 0,001), ТВ (р < 0,001, р < 0,001), D-димера (р < 0,001, р < 0,001) на фоне низких значений ПИ (р < 0,001, р < 0,001) и фибриногена (р < 0,001, р < 0,001) соответственно наблюдалась у недоношенных новорожденных с очень низкой и экстремально низкой массой тела и врожденной пневмонией по сравнению с данными группы сравнения и младенцами группы контроля.
Все изложенное свидетельствует о гипокоагуляции во всех фазах свертывания крови и повышенном фибринолизе (различной степени выраженности в зависимости от срока гестации, массы тела и сопутствующей патологии) у недоношенных новорожденных всех трех групп к концу раннего неонатального периода [5–8].
Проведен анализ показателей свертываемости крови у недоношенных новорожденных на 19–21-е сутки жизни (табл. 3).
Отсутствие статистически значимых различий между показателями АЧТВ, коэффициента R, ПВ, ПИ, МНО, ТВ у условно здоровых недоношенных по сравнению со здоровыми доношенными свидетельствует о восстановлении свертывающей и противосвертывающей систем гемостаза к концу неонатального периода.
/26.jpg)
При сравнении показателей коагулограммы у недоношенных новорожденных с низкой массой тела и врожденной пневмонией с данными условно здоровых недоношенных наблюдается отсутствие статистических различий между показателями АЧТВ, коэффициента R, МНО, фибриногена и D-димера и статистически значимых различий более высокого значения ПВ (р = 0,003), ТВ (р < 0,001) на фоне более низкого значения ПИ (р = 0,002). По сравнению с данными новорожденных группы контроля отмечаются более высокие значения АЧТВ (р < 0,001), коэффициента R (р < 0,001), ПВ (р < 0,001), МНО (р = 0,002), ТВ (р < 0,001) и D-димера (р < 0,001) на фоне низких значений ПИ (р < 0,001) и фибриногена (р < 0,001), что указывает на неполное восстановление функций системы гемостаза со склонностью к гипокоагуляции во второй и третьей фазах свертывания крови к концу неонатального периода.
К концу первого месяца жизни статистически значимо более высокие значения АЧТВ (р < 0,001, р < 0,001), коэффициента R (р < 0,001, р < 0,001), ПВ (р < 0,001, р < 0,001), МНО (р < 0,001, р < 0,001), ТВ (р < 0,001, р < 0,001), D-димера (р < 0,001, р < 0,001) на фоне низких значений ПИ (р < 0,001, р < 0,001) и фибриногена (р < 0,001, р < 0,001) соответственно отмечались у недоношенных новорожденных с очень низкой и экстремально низкой массой тела и врожденной пневмонией по сравнению с данными группы сравнения и группы контроля, что указывает на сохраняющуюся гипокоагуляцию во всех фазах свертывания крови и повышенный фибринолиз [5–8].
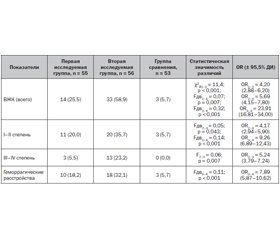
Проведен сравнительный анализ частоты развития геморрагических осложнений у недоношенных новорожденных (табл. 4).
По данным отношения шансов, доля внутрижелудочковых кровоизлияний у недоношенных новорожденных первой и второй исследуемых групп как в общем количестве (ОR = 5,69 (4,15–7,80), ОR = 23,91 (16,81–34,00)), так и I–II степени (ОR = 4,17 (2,94–5,90), ОR = 9,26 (6,89–12,43)) соответственно, была статистически значимо больше, чем в группе условно здоровых недоношенных детей. Частота ВЖК III–IV степени у недоношенных новорожденных с очень низкой и экстремально низкой массой тела и врожденной пневмонией была статистически значимо выше (ОR = 5,24 (3,79–7,24)), чем у младенцев с низкой массой тела и врожденной пневмонией. ВЖК III–IV степени у условно здоровых новорожденных не регистрировались.
Геморрагические расстройства у недоношенных новорожденных второй исследуемой группы встречались статистически значимо чаще (ОR = 7,89 (5,87–10,62)), чем у новорожденных группы сравнения, без значимых различий между первой и второй исследуемыми группами.
Выводы
1. По результатам коагулограммы, у недоношенных новорожденных всех групп с 1-х суток и до конца 1-й недели жизни регистрировалась гипокоагуляция во всех фазах свертывания крови и повышенный фибринолиз с увеличением степени выраженности нарушений по мере снижения гестационного возраста, массы тела и присоединения инфекционной патологии. Полученные данные свидетельствуют о необходимости проведения у недоношенных младенцев профилактики геморрагических расстройств с 1-х суток жизни.
2. К концу неонатального периода у недоношенных новорожденных группы сравнения наблюдалась нормализация показателей гемостаза. У недоношенных младенцев с низкой массой тела и врожденной пневмонией отмечалось неполное восстановление функций системы гемостаза со склонностью к гипокоагуляции во второй и третьей фазах свертывания крови. У недоношенных новорожденных с очень низкой и экстремально низкой массой тела и врожденной пневмонией сохранялась гипокоагуляция во всех фазах свертывания крови и повышенный фибринолиз.
3. По данным отношения шансов, доля внутрижелудочковых кровоизлияний и геморрагических расстройств у недоношенных новорожденных с врожденной пневмонией была статистически значимо больше, чем в группе условно здоровых недоношенных детей. Частота ВЖК III–IV степени у недоношенных новорожденных с очень низкой и экстремально низкой массой тела и врожденной пневмонией была статистически значимо выше, чем у младенцев с низкой массой тела и врожденной пневмонией. Полученные данные свидетельствуют о необходимости контроля гемостаза и профилактической антигеморрагической терапии в течение неонатального периода у недоношенных новорожденных с врожденной пневмонией.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Информация о вкладе авторов в работу над статьей: Горячко А.Н. — сбор, обработка, анализ полученных результатов и написание текста; Сукало А.В. — концепция и дизайн исследования.

/23.jpg)
/24.jpg)
/24_2.jpg)
/25.jpg)
/26.jpg)
/27.jpg)