Журнал «Почки» Том 10, №2, 2021
Вернуться к номеру
Оновлення керівництв KDIGO з гломерулярних захворювань (за матеріалами «The updated KDIGO Practice Guideline on Glomerular Diseases», 13 травня 2021 р., ERA-EDTA e-seminars)
Авторы: Floege J.
Div. Nephrology and Clinical Immunology University Hospital, Aachen, Germany
Рубрики: Нефрология
Разделы: Официальная информация
Версия для печати
На думку робочої групи KDIGO, на сьогодні майже всі рекомендації KDIGO 2012 року потребують оновлення.
Незмінною залишається система градації (табл. 1, 2).
Нова риса майбутніх рекомендацій — практичний пункт (Practice Point). Рубрика не є рекомендацією, її покликання — поліпшення норм якості надання медичної допомоги, що базується на здоровому глузді та досвіді експертів. Так, наприклад, оцінка ниркових біоптатів повинна мати певну стандартизацію, що не завжди дотримується.
Практичний пункт 1.1.1. Біопсія нирки є золотим стандартом діагностики гломерулярних захворювань. Разом із тим, за деяких обставин, лікування може бути призначене без підтвердження діагнозу біопсією.
Практичний пункт 1.1.2. Оцінка тканини нирки повинна слідувати за стандартизацією адекватності біопсії.
Практичний пункт 1.1.3. Повторна біопсія нирки повинна бути проведена, якщо отримана інформація може потенційно змінити план лікування.
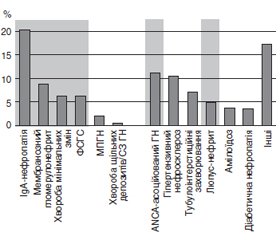
Нові рекомендації мають на меті переглянути рекомендації з ведення найбільш поширених у Європі гломерулярних уражень (рис. 1).
/77.jpg)
Зміни торкнулися ведення пацієнтів з IgA-нефропатією (IgAН). Запропоновано безкоштовний інструмент-предиктор QxMD, що дозволяє оцінити ризик для пацієнта. Важливо зазначити, що використання інструменту можливе лише за умови виконання ниркової біопсії, оскільки до компонентів оцінки входить гістологічна градація IgA-нефропатії (MEST-score) на момент прогнозу [1].
2.2. Прогностичний практичний пункт 2.2.1. Пропозиції для прогнозування наслідків первинної IgA-нефропатії:
— Клінічні та гістологічні дані, отримані на час біопсії, можуть бути використані для оцінки ризику пацієнтів, із застосуванням міжнародного IgAН-предикторного інструменту, доступного на QxMD.
— Міжнародний IgAН-предикторний інструмент не може бути використаний для визначення ймовірного ефекту певного терапевтичного режиму.
— Не існує перевірених (валідних) прогностичних біомаркерів сироватки/сечі для IgAН (крім рШКФ та протеїнурії).
Практичний пункт 2.3.1. Пропозиції щодо лікування пацієнтів з IgAН:
— У першу чергу важливо оптимізувати підтримуючу терапію.
— Оцініть кардіоваскулярні ризики та розпочніть необхідні втручання за необхідності.
— Давайте поради щодо способу життя, у тому числі щодо обмеження вживання солі, припинення паління, контролю ваги та фізичних вправ.
Рекомендації рівня 1 (використовуйте всі):
— контролюйте артеріальний тиск;
— ІАПФ/БРА (титрувати, можливо комбінувати);
— уникайте дигідропіридинових блокаторів кальцієвих каналів;
— контролюйте вживання білка.
Рекомендації рівня 2 (використовуйте в найбільшій можливій кількості):
— обмежити вживання солі, рідини та діуретиків;
— використовуйте недигідропіридинові блокатори кальцієвих каналів;
— контролюйте всі компоненти метаболічного синдрому;
— використовуйте антагоністи альдостерону, бета-блокатори;
— припиніть палити;
— низька доказовість: терапія NaHCO3 (гідрокарбонат натрію) незалежно від метаболічного ацидозу.
Рекомендація 2.3.2. Ми рекомендуємо, щоб усі пацієнти з рівнем протеїнурії > 0,5 г/добу були ліковані іАПФ або БРА незалежно від наявності гіпертензії (1В).
Рекомендація 2.3.3. Ми пропонуємо, щоб для пацієнтів, які залишаються у зоні високого ризику прогресування ХХН, незважаючи на максимальну підтримуючу терапію, був розглянутий шестимісячний курс терапії кортикостероїдами.
Ризик терапевтичної токсичності повинен бути обговорений із пацієнтами, особливо якщо їх рШКФ нижче від 50 мл/хв/1,73 м2 (2В).
Використовуйте кортикостероїди з великою обережністю або уникайте взагалі:
— при рШКФ нижче від 30 мл/хв/1,73 м2;
— діабеті;
— надмірній масі тіла (ІМТ > 30 кг/м2);
— латентній інфекції (наприклад, гепатит, туберкульоз);
— наявності вторинного захворювання (наприклад, цироз);
— наявності активної пептичної виразки;
— наявності неконтрольованого психічного захворювання.
Був також наданий коментар із продовження дослідження IgAН STOP IgAN trial (Rauen T., Floege J. Kidney Int. 2020).
Оригінальне рандомізоване дослідження тривало три роки, порівнювали дві когорти пацієнтів (n = 162). Одна група пацієнтів (n = 80) отримувала лише підтримуючу терапію, а інша (n = 82) — підтримуючу та імуносупресивну терапію. За три роки обидві групи пацієнтів мали рівнозначну втрату ниркової функції та рШКФ [2].
Дослідження було піддано критиці через тривалість, що вважалася недостатньою для оцінки віддалених ефектів терапії, тому дослідження було вирішено продовжити.
За середній період 7,4 року вдалось віднайти та проаналізувати 92 % пацієнтів з оригінальної когорти. Результати довготривалих наслідків були невтішними для обох груп: 70 % пацієнтів мали «небажаний ефект» (смерть, термінальна ХХН, втрата рШКФ > 40 %). Усі пацієнти були з групи високого ризику; пропонується до дискусії пошук кращої та більш надійної терапії [3].
Наступний огляд змін торкнувся мембранозної нефропатії (МН).
Мембранозна нефропатія
Практичний пункт 3.2.1. У пацієнтів із МН використовуйте клінічні та лабораторні критерії для оцінки ризику прогресивної втрати ниркової функції (табл. 3).
Рекомендація 3.3.1. У пацієнтів із МН та щонайменше одним фактором ризику прогресування захворювання ми рекомендуємо використовувати ритуксимаб, або циклофосфамід та стероїди протягом 6 місяців, або терапію на базі такролімусу протягом щонайменше 6 місяців, із вибором лікування залежно від оцінки ризиків (1В) (рис. 2).
Наголошується, що для пацієнтів із МН із групи високого ризику лише циклофосфамід має доказову базу з уповільнення втрати функції нирки та запобігання діалізу.
Щодо ритуксимабу при МН, рекомендована доза на сьогодні становить 2 г за схемою: 1 г у перший день та 1 г на 14-й день. Не рекомендовано зменшувати дозу, як при нефротичному синдромі, тому що багато препарату втрачається із сечею [4].
Дослідження MENTOR порівнювало ефект ритуксимабу та циклоспорину А у двох групах пацієнтів. Часткова або повна ремісія досягалась протягом одного року однаково успішно з використанням того чи іншого препарату. Однак підтримання ремісії протягом двох років було набагато більш успішним у групі ритуксимабу [4] (рис. 3).
Практичний пункт 3.3.3. У пацієнтів із МН динаміка визначення рівнів антитіл до PLA2R на третьому та шостому місяцях після початку терапії може бути корисною для оцінки відповіді на лікування та може бути використана для корекції терапії (рис. 4).
Хвороба мінімальних змін (ХМЗ)
Рекомендація 5.3.1. Ми рекомендуємо пероральні кортикостероїди у високій дозі для початкового лікування ХМЗ (1С).
Рекомендація 5.3.1.1. Ми пропонуємо циклофосфамід, ритуксимаб, інгібітори кальциневрину або аналоги мікофенолової кислоти для лікування часто рецидивуючої/стероїдзалежної ХМЗ на противагу самому преднізолону або відсутності лікування (1С) (рис. 5).
Зазначається, що преднізолон і такролімус були однаково ефективні при досягненні ремісії ХМЗ за 8 тижнів, але захворювання часто та швидко рецидивує після припинення терапії [5].
Фокально-сегментарний гломерулосклероз (ФСГС)
Рекомендація 6.2.2.1. Ми рекомендуємо використання високих доз кортикостероїдів як препаратів першої лінії імуносупресії (1D) (рис. 6).
ANCA-васкуліт (ААВ)
Рекомендація 9.3.1. Ми рекомендуємо кортикостероїди в комбінації з циклофосфамідом або ритуксимабом як початкове лікування вперше виявленого ААВ (1В).
Рекомендація 9.3.1.1. Ми рекомендуємо підтримуючу терапію або ритуксимабом, або азатіоприном із низькими дозами глюкокортикоїдів після індукції ремісії (1С).
Плазмаферез не показав ефективності в запобіганні настанню термінальної ХХН або смертності (дослідження Pexivas). Призначення кортикостероїдів було однаково ефективним у повному та в 50% обсязі, але ризик інфекційних ускладнень у пацієнтів був на 30 % нижчим при терапії більш низькими дозами [6].
Люпус-нефрит (ЛН)
Рекомендація 10.2.1.1. Ми рекомендуємо лікування всіх пацієнтів із ЛН гідроксихлорохіном або еквівалентним протималярійним препаратом, якщо немає протипоказань (1С) (рис. 7).
Рекомендація 10.2.3.1.1. Ми рекомендуємо початкове лікування кортикостероїдами в поєднанні з циклофосфамідом у низькій дозі в/в або аналогами мікофенолової кислоти для пацієнтів з активним ЛН класу III та IV, із мембранозним компонентом (клас V) або без такого (1В).
Рекомендація 10.2.3.2.1. Ми рекомендуємо терапію підтримки аналогами мікофенолової кислоти після закінчення початкової терапії в таких пацієнтів (1В) (рис. 8).
Оновлені рекомендації KDIGO будуть доступні на онлайн-платформі magicapp.org, де безліч сучасних рекомендацій уже наявні в загальному доступі.
Резюме рекомендацій із гломерулярних захворювань буде опубліковане в «Kidney International» у вересні 2021 р.
/80_2.jpg)
Переклад М.Д. Іванової, НУОЗУ ім. П.Л. Шупика, науковий редактор перекладу проф. Д. Іванов
Список литературы
- Barbour S.J., Coppo R., Zhang H. еt al. International IgA Nephropathy Network. Evaluating a New International Risk-Prediction Tool in IgA Nephropathy. JAMA Intern. Med. 2019 Jul 1. 179(7). 942-952. doi: 10.1001/jamainternmed.2019.0600. Erratum in: JAMA Intern. Med. 2019 Jul 1. 179(7). 1007. PMID: 30980653. PMCID: PMC6583088.
- Rauen et al. Intensive Supportive Care plus Immunosuppression in IgA Nephropathy. N. Engl. J. Med. 2015. 373. 2225-2236. DOI: 10.1056/NEJMoa1415463.
- Rauen et al. After ten years of follow-up, no difference between supportive care plus immunisupression and supportive care alone in IgA nephropathy. Kidney Int. 2020. 98. 1044-1052. https://doi.org/10.1016/j.kint.2020.04.046
- Frevenza et al. Rituximab or Cyclosporine in the Treatment of Membranous Nephropathy. N. Engl. J. Med. 2019. 381. 36-46. DOI: 10.1056/NEJMoa1814427.
- Medjeral-Thomas N.R. et al. Randomized, Controlled Trial of Tacrolimus and Prednisolone Monotherapy for Adults with De Novo Minimal Change Disease: A Multicenter, Randomized, Controlled Trial. Clin. J. Am. Soc. Nephrol. 2020 Feb 7. 15(2). 209-218. doi: 10.2215/CJN.06180519. Epub 2020 Jan 17. Erratum in: Clin J. Am. Soc. Nephrol. 2020 Jul 1. 15(7). 1027. PMID: 31953303. PMCID: PMC7015084.
- Walsh et al. Plasma Exchange and Glucocorticoids in Severe ANCA-Associated Vasculitis. N. Engl. J. Med. 2020. 382. 622-631. DOI: 10.1056/NEJMoa1803537.

/76.jpg)
/78_2.jpg)
/78.jpg)
/79.jpg)
/80.jpg)