Вступ
Легенева гіпертензія (ЛГ) — це гемодинамічний та патофізіологічний стан, що характеризується підвищенням середнього тиску в легеневій артерії (СрТЛА) > 20 мм рт.ст. та оцінюється за даними катетеризації правих відділів серця (КПС) [1]. Існує багато причин для підвищення СрТЛА, і всі вони характеризуються різними підходами до лікування, прогнозом, змінами гемодинамічних показників (хвилинний об’єм крові (ХОК), тиск заклинювання легеневої артерії (ТЗЛА), опір легеневих артерій (ОЛА), в’язкість крові) та морфологічним субстратом (наявність ураження легеневих артерій, вен). У більшості випадків ЛГ розглядається не як самостійне захворювання, а як стан, який виникає в результаті інших хвороб.
/14.jpg)
Раніше ЛГ поділяли на первинну (ідіопатична легенева артеріальна гіпертензія (ЛАГ), спадкова ЛАГ) та вторинну форми (коли є причина). На сьогодні в клініці застосовуються етіопатогенетична (табл. 1) та гемодинамічна (табл. 2) класифікації. Згідно з першою, усі форми ЛГ поділяються на 5 груп залежно від етіології та патофізіологічних механізмів виникнення.
Залежно від величини ТЗЛА (гемодинамічна класифікація), який відображає тиск у лівому передсерді, усі пацієнти з ЛГ поділяються на тих, що мають прекапілярну та посткапілярну ЛГ. Посткапілярна форма ЛГ означає, що має місце підвищення тиску в легеневих венах унаслідок ураження лівих відділів серця. Залежно від величини ОЛА, вона може бути ізольована посткапілярна (переважне підвищення тиску у легеневих венах) та комбінована (тиск підвищений у легеневих венах, але страждають також і легеневі артерії).
Діагноз ідіопатичної легеневої артеріальної гіпертензії (ІЛАГ) встановлюється методом виключення усіх інших причин ЛГ. При ІЛАГ етіологія захворювання невідома. ІЛАГ відноситься до спорадичних захворювань без сімейного анамнезу та відомих тригерів виникнення. При цьому, якщо в США середній вік пацієнтів з ІЛАГ у першому реєстрі Національного інституту здоров’я (1981) становив 36 років, то зараз значно збільшилася частота її діагностування серед пацієнтів похилого віку, що призвело до того, що середній вік, при якому діагностується дане захворювання, становить від 50 до 65 років. При цьому домінування жінок у структурі хворих із віком зменшується, а виживання покращується.
Патогенез ЛАГ досі недостатньо вивчений. У процес формування ЛГ різною мірою на різних його стадіях залучаються системи регуляції кровообігу, вазоактивні субстанції, фактори росту, медіатори запалення, тромбоцитарні фактори, компоненти системи згортання крові. Ключовий момент патогенезу ЛГ — дисфункція ендотелію легеневих судин. Остання може виникнути внаслідок спадкових механізмів та під впливом факторів зовнішнього середовища, що змінюють природний баланс метаболізму оксиду азоту, з одного боку, та ендотеліну і тромбоксану — з іншого. Це призводить до порушення вазореактивності легеневих судин та їх вазоконстрикції. Унаслідок цього дисбалансу активуються внутрішньоклітинні механізми, що запускають гіперплазію та гіпертрофію гладком’язових елементів, апоптоз, проліферацію фібробластів, запалення й ангіогенез. Таким чином, трьома «китами» розвитку ЛАГ є вазоконстрикція, мікротромбоз та ремоделювання судин.
Симптоми ЛАГ неспецифічні: задишка при навантаженні, швидка втомлюваність, слабкість, біль у грудях, епізоди непритомності (синкопе) або їх аналоги (запаморочення і т.п.), зумовлені двома основними причинами: порушенням постачання кисню до органів і зниженням серцевого викиду. Рідше зустрічається сухий кашель. Ще рідше виникає кровохаркання, синдром Ортнера (охриплість голосу внаслідок однобічного паралічу голосових зв’язок) та аритмія. Симптоми прогресуючої правобічної серцевої недостатності (набряки, асцит, здуття живота), як правило, виникають при більш пізньому або більш прискореному перебігу захворювання [2].
Діагностичний алгоритм. Сучасний алгоритм діагностики складається з 2 етапів: 1. Проводиться поза експертним центром ЛГ, включаючи виявлення пацієнтів високого ризику та із прискореним (ускладненим) перебігом захворювання, що потребують швидкого направлення до експертного центру (рис. 1).
2. Зосереджений на діагностиці ЛГ після того, як хворий був уже направлений до експертного центру.
Діагностика ІЛАГ ґрунтується на послідовному виключенні інших, більш поширених причин зі схожою клінічною симптоматикою. Діагностичний алгоритм заходів, які проводяться до направлення в експертний центр ЛГ, поданий на рис. 1: діагностичний процес починається при появі підозри на ЛГ і оціночних результатів ЕхоКГ про ймовірність ЛГ (відповідно до різних рівнів ймовірності ЛГ за даними ЕхоКГ, описаними вище). Наявність ЛАГ слід виключати при диференціальній діагностиці задишки, що виникає при фізичному навантаженні, синкопе, болі в грудях і/або прогресуючого зниження толерантності до фізичного навантаження у пацієнтів із відсутністю явних факторів ризику, симптомів або ознак поширених серцево-судинних і респіраторних захворювань. У повсякденній лікувальній практиці подібна настороженість, як правило, є дуже низькою. ЛГ частіше виявляють несподівано під час трансторокальної ехокардіографії (TTE), яку проводять за іншими показаннями.
Комплексна оцінка прогнозу, визначення ризику та принципи спостереження хворих. ЛАГ — прогресуюче смертельне захворювання. Опубліковані настанови щодо лікування рекомендують ескалацію терапії на основі регулярних оцінок пацієнта з метою досягнення або збереження статусу низького ризику.
Тому хворим із ЛАГ наполегливо рекомендоване спостереження та регулярне обстеження в референтних центрах ЛГ. Проведення комплексної оцінки обумовлено тим, що відсутній один «золотий» параметр, на рівень якого можливо було б орієнтуватися для оцінки початкової тяжкості перебігу захворювання, а також зміни якого дали б можливість оцінювати ефективність лікування. Оцінка прогнозу хворих на ЛАГ вважається важливою частиною ведення хворих на ЛГ. У настанові ESC/ERS-2015 рекомендується гнучкий підхід до оцінки ризику пацієнтів з ЛАГ із використанням багатовимірної стратифікації змінних із відомим прогностичним значенням, які можуть бути модифікованими в процесі спостереження: клінічних проявів, функціональних параметрів, толерантності до фізичного навантаження, біохімічних, ТТЕ та гемодинамічних показників [3]. Запропоновано розподіляти пацієнтів на три категорії на основі очікуваної смертності протягом 1 року: низького, проміжного або високого ризику [3].
Оцінка ризику при ЛАГ за цими критеріями наведена у табл. 3. Індивідуальний ризик розраховується при першому візиті та під час наступного візиту при спостереженні. Кожному критерію призначаються умовні бали 1, 2 або 3 відповідно до ступеня ризику (1 — низький ризик, 2 — проміжний ризик та 3 — високий ризик), і середня величина округлюється до більшого значення.
Зазначені рівні смертності є приблизними; наведені величини були отримані переважно у пацієнтів з ІЛАГ. Не всі параметри можуть вказувати на одну й ту саму групу ризику, і у виборі методу лікування слід керуватися результатами саме всебічної оцінки для кожного пацієнта окремо. Індивідуальний ризик, у свою чергу, залежить від впливу інших факторів, таких як швидкість прогресування захворювання, наявність або відсутність ознак недостатності правих відділів серця, синкопе, а також супутніх захворювань, віку, статі, фонової терапії і підтипу ЛГ серед інших.
Зв’язок між методичною оцінкою ризику та ефективністю лікування пацієнтів з ЛАГ було підтверджено ретроспективним аналізом трьох незалежних реєстрів, що показує чіткий прогноз виживання або виживання без подій на основі цього комплексного багатопараметричного підходу на початковому рівні та під час подальшого спостереження. Важливо, що покращення прогностичних показників під час наступного візиту після призначення лікування асоціювалося із покращенням подальшого виживання таких хворих [4–7]. Результати цих спостережень дали можливість розробити новий методичній підхід до цілей лікування — намагатися за допомогою терапії перевести хворих у категорію низького ризику і таким чином покращити клінічний результат, у тому числі виживання. Подальша ескалація лікування потрібна у випадку, якщо при плановому спостереженні не буде досягнуто статусу низького ризику. Пацієнти з низьким рівнем ризику повинні продовжувати обрану терапію та проходити повторну оцінку при подальшому спостереженні, щоб вчасно виявити можливе погіршення стану. Максимальна (потрійна комбінована) терапія та трансплантація легень, відповідно, можуть знадобитися у найбільш тяжких випадках, але виявлення таких хворих буде потребувати більш короткого терміну.
Лікування легеневої артеріальної гіпертензії
Лікування хворих на ЛГ становить значні труднощі. Ситуація змінилася останніми десятиліттями завдяки значному збільшенню числа нових препаратів для специфічної терапії ЛАГ, які вивчалися в рандомізованих контрольованих дослідженнях (РКД). Метою лікування ЛГ є зменшення вираженості симптомів, уповільнення прогресування захворювання, поліпшення якості життя хворих та збільшення його тривалості. Лікування необхідно починати відразу після встановлення діагнозу. Процес лікування пацієнтів з ЛАГ не може зводитися лише до призначення медикаментозної терапії, він вимагає комплексної стратегії, що включає оцінку початкового ступеня тяжкості захворювання і подальшого ефекту лікування. За рекомендаціями ESC/ERS-2015, сучасна тактика лікування пацієнтів з ЛАГ може бути розділена на три основні етапи.
Перший включає загальні заходи (рекомендації щодо фізичної активності, реабілітація під наглядом фахівців, запобігання вагітності, ведення вагітності (якщо переривання вагітності неможливе), запобігання інфекційним захворюванням, планові оперативні втручання, постклімактерична гормональна терапія, соціально-психологічна допомога, контроль дотримання режиму лікування, генетичне консультування і рекомендації щодо подорожей/поїздок), підтримуючу терапію (пероральні антикоагулянти, діуретики, оксигенотерапія, дігоксин), направлення в референтні центри, де проводять гострий вазореактивний тест для визначення показань до тривалої терапії БКК.
Другий етап включає початкову терапію високими дозами БКК у пацієнтів з позитивними результатами вазореактивного тесту або у пацієнтів з негативними результатами вазореактивного тесту терапію специфічними препаратами, затвердженими для лікування ЛАГ, відповідно до визначеного рівня ризику в монотерапії або комбінації відповідно до рівня доказовості.
Третій етап пов’язаний із відповіддю на початкову стратегію лікування: у разі неадекватної відповіді пропонується ескалація терапії із застосуванням комбінацій затверджених препаратів і обговорення трансплантації легень.
Загальні рекомендації
Пацієнти з ЛАГ потребують розважливого медичного консультування щодо повсякденної активності та необхідності пристосовуватися до наявної невизначеності, пов’язаної з серйозним хронічним захворюванням, яке несе загрозу життю. Встановлення діагнозу зазвичай призводить до певної соціальної ізоляції. Заохочення пацієнтів і членів їхніх сімей щодо приєднання до груп підтримки може мати сприятливий ефект на психологічну адаптацію, впевненість у власних силах і сприйняття захворювання.
Фізична активність. У повсякденному житті пацієнти з ЛГ повинні уникати виникнення таких потенційно небезпечних симптомів, як виражена задишка, синкопе, біль у грудях. Забороняються фізичні навантаження після їжі, при несприятливому температурному режимі. Хворим на ЛГ слід уникати різких змін положення тіла (ризик ортостатичних реакцій і синкопе). У той же час рекомендуються щоденні дозовані фізичні навантаження, які не викликають вищевказаних симптомів, що сприяє поліпшенню якості життя та зменшенню тяжкості клінічної симптоматики. При тривалій подорожі в сидячому положенні рекомендується робити перерви для нетривалих прогулянок кожні 2 години. У літаках рекомендується вставати із крісла та ходити по салону. Пацієнтам з ЛАГ не рекомендується надмірне фізичне навантаження, що призводить до симптомів стомлення (рівень доказів ІІІС). При погіршенні фізичного стану (детренованості) можливо обговорення необхідності фізичної реабілітації під наглядом спеціаліста (рівень доказів ІІаВ).
Поточні рекомендації щодо фізичної реабілітації обмежені браком доказів, які б дозволили обрати оптимальний метод, а також необхідну інтенсивність і тривалість тренування. Крім того, залишаються неясними особливості контролю за тренувальною програмою і механізми поліпшення симптоматики, толерантності до фізичного навантаження і функціональних можливостей, як і не встановлено можливий вплив таких заходів на прогноз захворювання. Програми з фізичної реабілітації повинні впроваджуватися референтними центрами ЛГ або центрами, які займаються реабілітацією пацієнтів з функціональним дефіцитом. Перш за все до призначення програми фізичної реабілітації хворі повинні отримувати лікування відповідно до найкращих стандартів фармакологічної терапії і бути в стабільному клінічному стані.
Вагітність та ЛАГ. Вагітність, пологи, замісна гормонотерапія в постменопаузному періоді пов’язані з підвищеним ризиком погіршення перебігу захворювання та смертності у цій категорії хворих. Усім пацієнткам з ЛГ репродуктивного віку повинні бути рекомендовані відповідні методи контрацепції (рівень доказів ІС). Для хворих на ЛГ рекомендується використання контрацептивів, що не містять естрогенів, бар’єрні методи контрацепції, проведення хірургічної стерилізації. Замісна гормональна терапія показана пацієнткам з ЛГ у постменопаузі лише при виражених клімактеричних симптомах за умови адекватного запобігання тромботичним ускладненням.
Незважаючи на значні досягнення в галузі діагностики і лікування хворих на ЛАГ, вагітність такими пацієнтками переноситься дуже погано і прискорює прогресування захворювання [8, 9]. Це положення має особливе значення, враховуючи, що від ЛАГ найчастіше страждають жінки дітородного віку. Історично склалося так, що у вагітних жінок з ЛАГ були зареєстровані високі показники материнської і внутрішньоутробної смерті (30–56 і 11–28 % відповідно) [9, 10]. Незважаючи на ризики як для матері, так і для майбутньої дитини, деякі жінки вирішують продовжити вагітність, і все більше пацієнток із ЛАГ бажають думати про наявність повноцінної сім’ї. Незважаючи на наполегливу рекомендацію хворим на ЛАГ уникати вагітності, існують ситуації, у яких пацієнти можуть звернутися до лікаря під час вагітності або завагітніти протягом їх спостереження. Якщо жінка з ЛАГ завагітніла, їй необхідно наполегливо запропонувати медичний аборт, у тому числі як терапевтичний захід щодо основного захворювання. Якщо аборт за медичними показаннями приймається, то рекомендується його провести до 22 тижнів вагітності: дослідження показали, що проведення хірургічного переривання в пізні терміни було пов’язане з підвищеним ризиком смерті [8, 11]. Дані літератури відзначають, що пацієнтки з успішним перебігом вагітності мали нижчу величину ОЛА або рівень СрТЛА < 40 мм рт.ст., ніж ті, які померли або потребували трансплантації серця/легень [8]. Слід пам’ятати, що ЛАГ може погіршитися протягом післяпологового періоду.
Планові оперативні втручання. У пацієнтів з ЛАГ планове оперативне втручання супроводжується підвищеним ризиком. При планових хірургічних втручаннях перевагу слід віддавати регіональній (епідуральній) анестезії (рівень доказів ІІаС), яка, ймовірно, переноситься краще, ніж загальна. Пацієнти, які приймають пероральні препарати, зазвичай потребують тимчасового переходу на внутрішньовенне або інгаляційне введення до тих пір, поки вони не зможуть знову ковтати і засвоювати пероральні препарати.
Запобігання інфекційним захворюванням. Профілактика інфекційних захворювань є дуже важливим завданням для хворих на ЛГ. Слід рекомендувати пацієнтам щорічне вакцинування від грипу та пневмококової інфекції (рівень доказів ІС). Виникнення пневмонії ускладнює перебіг ЛГ і є причиною смертельних випадків у 7 % хворих на ЛГ. Пацієнти з ЛАГ сприйнятливі до розвитку пневмонії, яка закінчується смертельним результатом в 7 % випадків. До тих пір, поки з’являться інші дані контрольованих досліджень, рекомендується проводити вакцинацію проти грипу та пневмококової пневмонії.
Соціально-психологічна допомога. ЛГ істотно впливає на психологічний, соціальний (у тому числі фінансовий), емоційний і духовний стан пацієнтів і їхніх сімей [12]. Командам фахівців, які ведуть дану категорію пацієнтів, слід володіти навичками і досвідом в оцінці та вирішенні проблем у всіх зазначених сферах, а також підтримувати тісну співпрацю з колегами із відповідною спеціалізацією (наприклад, у психіатрії, клінічній психології, сферах суспільної роботи і соціальної допомоги) у випадку надання допомоги пацієнтам із тяжкими порушеннями. Групи підтримки пацієнтів також мають важливе значення, і участь в них слід рекомендувати всім пацієнтам. ЛГ може значно обме-жити тривалість життя. На додаток до психологічної і соціальної допомоги слід також попередньо планувати алгоритм надання допомоги пацієнту із направленням, у разі необхідності, в спеціалізовані служби паліативної допомоги.
Дотримання режиму лікування. Прихильність до лікування є ключовим чинником, який забезпечує тривалий ефект терапії. Потрібен періодичний контроль дотримання режиму лікування ЛАГ у зв’язку з його складністю і можливим обмеженням або зміною схеми терапії з ініціативи пацієнта або медичних працівників (лікарів), які не спеціалізуються в даному питанні.
Подорожі/поїздки. Гіпоксія збільшує вазоконстрикцію при ЛГ, тому під час авіаперельотів для хворих на ЛГ необхідно обговорювати можливість проведення додаткової киснетерапії (рівень доказів ІІаС). Хворим на ЛГ слід виключити підйом у гори (більше ніж 1500 м над рівнем моря). Дослідження, що використовують симуляцію польоту для визначення необхідності підтримуючої оксигенотерапії протягом тривалих перельотів у пацієнтів з ЛАГ, відсутні. Знані фізіологічні ефекти гіпоксії припускають необхідність розгляду питання про застосування оксигенотерапії під час польоту у пацієнтів з ВООЗ-ФК III і IV, а також у пацієнтів з постійним парціальним тиском кисню в артеріальній крові < 8 кПа (60 мм рт.ст.). Швидкість кисневого струменя 2 л/хв піднімає парціальний тиск кисню у вдихуваній газовій суміші до значень, що спостерігаються на рівні моря. Аналогічним чином пацієнтам даної категорії слід уникати підняття на висоту > 1500–2000 м без забезпечення оксигенотерапії. Пацієнтам слід рекомендувати брати з собою в подорож письмову інформацію про своє захворювання, а також повідомити, яким чином можна зв’язатися з місцевими спеціалізованими центрами ЛГ у безпосередній близькості від місця призначення.
Медикаментозне лікування
Алгоритм лікування хворих на ЛАГ у референтному центрі ЛГ наведено на рис. 2. Першим кроком після підтвердження діагнозу у «наївного» до лікування хворого на ЛАГ в експертному центрі є обговорення та призначення загальних заходів та початок підтримуючої терапії у разі необхідності. Гострий вазореактивний тест слід проводити лише у пацієнтів із ІЛАГ, спадковою ЛАГ та ЛАГ, пов’язаною із прийомом препаратів або дією токсинів.
Вазореактивних пацієнтів слід лікувати високими дозами (прогресуючим титруванням) блокаторів кальцієвих каналів (БКК); адекватна відповідь повинна бути підтверджена через 3–4 місяці лікування. Пацієнти із позитивним вазореактивним тестом, які не мають адекватної клінічної реакції на лікування БКК, повинні лікуватися специфічними препаратами для лікування ЛАГ відповідно до стратегії лікування невазореактивного пацієнта.
Наведений алгоритм лікування ЛАГ не застосовується до пацієнтів інших клінічних груп, і зокрема, він не застосовується до пацієнтів із ЛГ 2-ї групи, асоційованими із захворюваннями лівих відділів серця, або 3-ї групи (захворювання легень). Крім того, методи лікування ЛАГ специфічними засобами були оцінені в клінічних дослідженнях переважно для хворих на ІЛАГ, спадкову ЛАГ, токсиніндуковану ЛАГ та ЛАГ, асоційовану із захворюваннями сполучної тканини або вродженими вадами серця (ВВС) (кореговані або некореговані хірургічно). Також недостатньо доказів для надання рекомендацій пацієнтам 5-ї групи.
Підтримуюча терапія
Загальна терапія хворих на ЛАГ включає прийом антикоагулянтів, діуретиків і дигоксину, а також інгаляції кисню. Хворим на ЛАГ протипоказаний хронічний прийом бета-блокаторів та нітратів. Слід уникати тривалого прийому нестероїдних протизапальних засобів, які можуть викликати затримку рідини та стати причиною декомпенсації.
Антикоагулянти. При патанатомічному дослідженні у хворих на ІЛАГ часто виявляється тромботичне ураження судин. Також у клініці відзначається патологія системи коагуляції і фібринолізу, зміни у мікроциркуляторному руслі. Усе це в сукупності із неспецифічними факторами ризику венозної тромбоемболії, включаючи серцеву недостатність і малорухливий спосіб життя, є методичним обґрунтуванням для планового застосування пероральних антикоагулянтів у пацієнтів з ЛАГ. Сприятливі ефекти пероральних антикоагулянтів (ПОК) показані в одноцентрових ретроспективних дослідженнях у хворих на ІЛАГ і ЛАГ, що виникла внаслідок прийому аноректиків. Дані регістрів та більш нових невеликих досліджень є неоднорідними (відсутність впливу або позитивний вплив у пацієнтів з ІЛАГ та негативний вплив у пацієнтів із ревматичними захворюваннями). Роль нових пероральних антикоагулянтів у лікуванні ЛАГ ще не вивчена. Пацієнтам із ХТЕЛГ ПОК призначаються обов’язково. Окрім того, вони мають застосовуватися при ФП та наявності тромботичних ускладнень. Цільовий рівень міжнародного нормалізованого співвідношення (МНС) при ЛАГ становить 1,5–2,5 (за рекомендаціями США) та 2–3 (за європейськими рекомендаціями). Рішення про призначення антикоагулянтів повинно прийматися індивідуально на основі оцінки співвідношення ризик/ефективність (зокрема, при ЛАГ, асоційованій з портальною гіпертензією, через варикозно розширені вени стравоходу існує високий ризик кровотечі). Пацієнти з ЛАГ, які отримують тривало в/в простаноїди, мають високий ризик тромбозу катетера. Тому вони можуть отримувати ПОК за відсутності протипоказань.
Діуретики. У стадії декомпенсації недостатність правих відділів серця призводить до підвищення центрального венозного тиску, застійної печінки, затримки рідини в організмі, асциту і периферичних набряків. Діуретики рекомендовані для лікування та профілактики застійних явищ, хоча РКД до цього часу не проводилися, але клінічний досвід показує явне поліпшення симптоматики у пацієнтів із декомпенсацією, які отримують діуретики. Дози діуретиків підбираються лікуючим лікарем та повинні ретельно титруватися, щоб уникнути різкого падіння об’єму циркулюючої крові та зниження системного тиску, що веде до преренальної форми ниркової недостатності. Вибір діуретика і визначення його дози залишаються на розсуд лікаря, що спеціалізується на лікуванні ЛАГ. Застосовуються петльові діуретики: фуросемід 20–200 мг/добу, торасемід 5–100 мг/добу. У деяких випадках при стаціонарному лікуванні застосовують і більші дози. Слід ретельно контролювати функцію нирок і показники електролітного обміну для запобігання розвитку ускладнень хронічної діуретичної терапії. Слід також розглядати додаткову терапію антагоністами альдостерону (спіронолактон у дозі 25–100 мг/добу) в поєднанні із систематичною оцінкою рівнів електролітів у плазмі крові.
Киснева терапія. Мета лікування — підтримка насичення крові киснем не менше 90 %. Більшість пацієнтів із ЛГ, за винятком осіб з ВВС і легенево-системними шунтами, мають незначні ступені артеріальної гіпоксемії у спокої, якщо у них немає відкритого овального отвору. Незважаючи на те, що у пацієнтів з ЛАГ при ингаляції кисню показано зниження ОЛА, рандомізовані дані, що підтверджують користь довгострокової терапії киснем, відсутні. Попри позитивний вплив на ОЛА, у деяких випадках тривале застосування кисню, особливо у високих дозах, може, навпаки, викликати легеневу вазоконстрикцію та призвести до погіршення стану хворого. Рекомендації щодо терапії киснем хворим на ЛАГ засновані на доказових даних, отриманих у пацієнтів з ХОЗЛ: у разі, якщо парціальний тиск кисню в артеріальній крові постійно становить < 60 мм рт.ст. або сатурація артеріальної крові становить < 91 %, пацієнтам рекомендується отримувати О2 для досягнення парціального тиску кисню в артеріальній крові > 60 мм рт.ст. У той же час при ВВС із шунтуванням крові справа наліво може розвиватися рефрактерна до кисневої терапії гіпоксемія, унаслідок чого застосування кисню у цієї категорії хворих буде практично неефективним. У літературі є дані, що нічна оксигенотерапія не впливає на природний перебіг синдрому Ейзенменгера на пізніх стадіях [13]. Амбулаторну оксигенотерапію можна розглядати в разі наявності доказів на користь поліпшення симптоматики і корекції десатурації при фізичному навантаженні.
Серцеві глікозиди. В історичному дослідженні було продемонстровано, що дигоксин покращує серцевий викид у пацієнтів з ІЛАГ при короткостроковому застосуванні [14], а його ефективність при довгостроковому застосуванні не вивчена. В/в уведення дигоксину хворим на ІЛАГ супроводжувалося достовірним зменшенням вмісту норадреналіну в плазмі крові. Хворим на ЛАГ серцеві глікозиди можуть призначатися у випадках тахісистолічної форми фібриляції передсердь для зменшення частоти шлуночкового ритму.
Анемія, гемоконцентрація та еритроцитоз. Дефіцит заліза часто зустрічається у хворих з ЛГ: у 43 % хворих з ідіопатичною ЛАГ, у 46 % з ЛАГ, асоційованою із захворюваннями сполучної тканини, та у 56 % хворих із синдромом Ейзенменгера. Хворі на ЛАГ високочутливі до зниження рівня гемоглобіну в крові, тому навіть невиражена анемія вимагає швидкого ефективного лікування. Дефіцит заліза може асоціюватися із зниженням толерантності до фізичного навантаження та більш високою смертністю. Тому рекомендовано проводити регулярний моніторинг цього стану, особливо на фоні прийому ПОК. При виявленні дефіциту заліза або анемії необхідно визначити усі можливі причини їх виникнення. При виявленні дефіциту заліза призначаються препарати заліза. Слід мати на увазі, що іноді у хворих з ЛГ спостерігається порушення всмоктування заліза, і тоді ефективними є препарати заліза, що призначаються парентерально.
Специфічна терапія ЛАГ
Блокатори кальцієвих каналів. Хоча основною патогенетичною ланкою при ЛАГ є прогресуюче ремоделювання дрібних легеневих артерій (ЛА), але легенева вазоконстрикція також відіграє важливу роль у патофізіології ЛАГ, особливо у вазореактивних пацієнтів [15–17]. Невелике неконтрольоване дослідження показало, що тривалий прийом високої дози БКК значно покращує виживаня у підгрупі пацієнтів із позитивним вазореактивним тестом порівняно із пацієнтами, які не реагували на вазодилататори (Rich et al., 1992). У подальшому велике ретроспективне дослідження французького референтного центру ЛГ показало, що менше ніж 10 % пацієнтів із ІЛАГ та ЛАГ, асоційованою із аноректиками, можуть відповісти на тривалу терапію БКК [15]. Пацієнти зі спадковою формою ЛАГ мали меншу ймовірність виявити позитивну вазореактивну реакцію. Сприятливі клінічні та прогностичні ефекти БКК, що застосовуються у високих дозах хворими на ІЛАГ з позитивним гострим вазореактивним тестом, були показані в одноцентрових нерандомізованих дослідженнях, але через рідкість захворювання на сьогодні жодного рандомізованого контрольованого дослідження не було проведено для підтвердження сприятливих ефектів БКК у лікуванні ЛАГ.
Сучасний підхід до призначення БКК при ІЛАГ полягає в призначенні початкової дози препарату, якщо у пацієнта до початку терапії при КПС виявлена позитивна вазодилататорна реакція, адекватний системний артеріальний тиск (вище від 90 мм рт.ст.) та стабільний ФК I–III (Barst et al., 2009; Galie et al., 2009). До числа рекомендованих для лікування ЛАГ на сьогодні належать дигідропіридинові БКК (амлодипін, ніфедипін) та дилтіазем. Вибір препарату визначається початковою частотою серцевих скорочень. Пацієнтам із частотою серцевих скорочень у спокої менше 80 ударів на хвилину слід рекомендувати антагоністи кальцію дигідропіридинового ряду, при відносній тахікардії — дилтіазем.
Терапію потрібно починати в стаціонарі, поступове збільшення дози через 3–5 тижнів проводиться під ретельним контролем АТ, показників оксигенації крові та толерантності до навантажень. Таким способом доза препарату титрується до максимально переносимої. Часто доза БКК, яку застосовують при ЛАГ, перевищує таку, яку зазвичай призначають при артеріальній гіпертензії та ішемічній хворобі серця (табл. 4).
Через можливі серйозні побічні ефекти (наприклад, гіпотензія, синкопе та провокація або посилення правосторонньої ХСН) терапія високими дозами БКК не показана пацієнтам, яким не проводили гострий вазореактивний тест при КПС (клас ІІІ, рівень доказів С). У деяких випадках може виникнути потреба в комбінації БКК із препаратами для специфічного лікування ЛАГ через подальше клінічне погіршення у разі спроб відміни БКК. Деякі пацієнти без позитивного вазодилататорного тесту можуть мати інші додаткові показання для призначення БКК у середніх дозах (синдром Рейно).
Більш сприятливий перебіг ЛАГ у хворих із позитивним результатом вазодилататорного тесту на фоні тривалої ефективної терапії БКК дозволив експертам виділити цю категорію пацієнтів в окрему групу ЛАГ у сучасній класифікації ЛГ із затвердженням рекомендацій як щодо їх виявлення, так і лікування [1].
Позитивний результат вазодилататорного тесту не передбачає сприятливої тривалої реакції на терапію БКК у пацієнтів з ЛАГ, асоційованою із дифузними захворюваннями сполучної тканини, ВІЛ, портолегеневою гіпертензією та ВОХ. Те саме відноситься і до хворих на ХТЕЛГ (група 4) [18]. Таким чином, проведення гострого вазореактивного тесту та, особливо, призначення тривалого лікування ЛГ БКК у пацієнтів цих категорій не показано.
Простагландини. Простациклін продукується переважно ендотеліальними клітинами й індукує потужну дилатацію всіх судинних басейнів. Ця сполука є найпотужнішим ендогенним інгібітором агрегації тромбоцитів, а також, мабуть, має цітопротекторну й антипроліферативну дії. На сьогодні простагландини розглядаються як ключова група препаратів для лікування ЛАГ, що має вазодилатуючу, антиагрегантну і антипроліферативну дію (табл. 5).
/22.jpg)
Епопростенол — перший синтетичний аналог простацикліну. Епопростенол має короткий період напіврозпаду (3–5 хв), вимагає охолодження та безперервного введення за допомогою інфузійного насоса і постійного тунельного катетера. Існують сучасні більш стабільні форми епопростенолу. Ефективність безперервного внутрішньовенного введення епопростенолу була вивчена в трьох відкритих РКД у пацієнтів з ІЛАГ ВООЗ-ФК III і IV [19, 20], а також у пацієнтів з ЛАГ, пов’язаною зі склеродермією [21]. Епопростенол поліпшував симптоми, толерантність до фізичного навантаження і гемодинаміку при обох клінічних станах і є єдиним методом лікування, що продемонстрував в одному РКД зниження смертності при ІЛАГ. Метааналіз даних із загальної смертності, отриманих у цих РКД, продемонстрував зниження ризику смерті більше 70 %. Було також показано довгострокове збереження ефективності для ІЛАГ та інших типів ЛАГ [22], а також при неоперабельній ХТЕЛГ [23]. Слід уникати різкої відміни інфузії епопростенолу через високий ризик розвитку синдрому рикошету, погіршення гемодинамічних показників і смерті.
Ілопрост — хімічно більш стабільний аналог простацикліну, який можна використовувати для лікування ЛАГ як шляхом в/в введення, так і в інгаляційній формі за допомогою небулайзера. Тривалість дії інгаляційного ілопросту становить 60–120 хв, протягом доби необхідно провести 6–9 інгаляцій через небулайзер. Застосування інгаляційного ілопросту призводить до селективної легеневої вазодилатації, що викликає розширення судин у вентильованих альвеолах, уникаючи їх розширення в невентильованих ділянках. Крім того, ілопрост має антитромботичну, протизапальну, антипроліферативну та фібринолітичну дію. Таке лікування поліпшує гемодинамічні зміни та здатність переносити фізичне навантаження у пацієнтів із ЛАГ. Терапія ілопростом ефективна у хворих на ЛГ IІI–IV ФК — при ІЛАГ, ЛАГ, асоційованій з захворюваннями сполучної тканини та зумовленій дією токсинів, синдромі Ейзенменгера, неоперабельній ХТЕЛГ. Доказова база щодо застосування ілопросту як монотерапії у хворих на ЛАГ і ХТЕЛГ включає подвійне сліпе рандомізоване плацебо-контрольоване дослідження AIR та відкрите багатоцентрове тривале рандомізоване дослідження AIR-2. У першому була показана ефективність і переносимість інгаляційного ілопросту у 203 пацієнтів з ІЛАГ, ХТЕЛГ та ЛАГ, асоційованою із системними захворюваннями сполучної тканини або прийомом аноректиків (III і IV ФК). Згідно з отриманими даними, поліпшення ФК як мінімум на 1 клас, приріст > 10 % дистанції в тесті 6-хвилинної ходьби (Т6ХХ), а також відсутність погіршення або фатального результату було досягнуто у 17 % пацієнтів групи ілопросту та у 5 % групи плацебо. Дистанція в Т6ХХ у групі ілопросту до 12-го тижня збільшилася на 36,4 м порівняно із плацебо. Причому в підгрупі хворих на ІЛАГ був досягнутий найкращий результат (+58,8 м). У другому дослідженні — AIR-2 — оцінювалася ефективність і переносимість інгаляційного ілопросту протягом 24 місяців терапії. На фоні лікування гемодинамічний ефект (зниження тиску в легеневій артерії) зберігався або наростав, необхідність у будь-яких підвищеннях дози через тахіфілаксію була відсутня. Відмічалося значне поліпшення толерантності до фізичних навантажень за даними Т6ХХ, індексу задишки, ФК. За весь період спостереження виживаність для групи пацієнтів з ІЛАГ становила 91,4 %, у той час як розрахунковий рівень виживаності становив усього 63,1 %. Отримані дані підтвердили коротко- і довгострокову ефективність інгаляційного ілопросту; у тривалих відкритих дослідженнях не показано ризику збільшення числа побічних ефектів препарату.
Трепростиніл — трициклічне бензидинове похідне епопростенолу із задовільною хімічною стабільністю, що дозволяє вводити його у фізіологічному розчині при температурі навколишнього повітря як внутрішньовенно, так і підшкірно. Підшкірне введення препарату можна проводити за допомогою мікроінфузійної помпи та маленьких катетерів. У цих випадках усуваються ускладнення, пов’язані з постійним втручанням у центральну венозну мережу, наприклад інфекції, а догляд за системою набагато простіший. Цей метод найбільш часто використовується для тривалого лікування тяжких пацієнтів (високий ризик, ІІІ–ІV ФК) у комбінації зі специфічними препаратами інших груп. Безперервне підшкірне або внутрішньовенне введення трепростинілу призводить до поліпшення толерантності до фізичних навантажень, зниження ОЛА, поліпшення клінічного стану хворих на ЛАГ. Найзначніше збільшення переносимості фізичних навантажень отримано у хворих з найважчим початковим станом і у хворих, здатних переносити високі дози препарату. Найчастішим побічним ефектом препарату є біль у місці введення, що стає причиною припинення лікування у 8 % випадків і обмежує підвищення дози ще в частини хворих. Лікування трепростинілом для підшкірного введення починається з дози 1–2 нг/кг/хв, а швидкість збільшення дози визначається наявністю побічних ефектів (локальний біль у місці введення препарату, припливи, головний біль). Оптимальна доза варіює в індивідуальному порядку і знаходиться, як правило, у межах 20–80 нг/кг/хв. Була зроблена спроба провести РКД ефективності трепростинілу для внутрішньовенного введення у пацієнтів з ЛАГ, однак набір у дослідження був достроково припинений з міркувань безпеки після рандомізації менше половини із запланованих пацієнтів. У РКД інгаляційної форми трепростинілу у пацієнтів з ЛАГ на фоні терапії бозентаном або силденафілом відзначили покращення результатів Т6ХХ на 20 м при максимальній дозі і на 12 м при мінімальній дозі, а також показників NT-proBNP і критеріїв якості життя [24]. У нещодавньому подвійному сліпому дослідженні FREEDOM-EV, яке включало 690 хворих на ЛАГ із додаванням до затвердженої пероральної монотерапії плацебо або пероральних таблеток трепростинілу тривалого вивільнення тричі на день (співвідношення 1 : 1), було показано, що призначення перорального трепростинілу достовірно зменшило ризик клінічного погіршення на 26 % [25]. Аналіз результатів у підгрупах на основі неінвазивної стратифікації ризику показав, що початково учасники, яким призначали трепростиніл, мали значно вищий ризик смертності, але через 12–60 тижнів досягали більш низького профілю ризику. Найбільш поширеними побічними ефектами в групі перорального трепростинілу були головний біль, діарея, почервоніння шкіри, нудота та блювання.
Берапрост — це перший хімічно стабільний простациклін. У європейському, а потім у американському дослідженні продемонстрував покращення толерантності до фізичного навантаження, але дані щодо тривалого гемодинамічного ефекту або впливу на перебіг та прогноз захворювання відсутні. Найбільш часті побічні дії — головний біль, почервоніння обличчя, біль у щелепах та діарея.
Агоністи рецепторів простагландину для перорального прийому. Селексипаг — перший селективний агоніст простациклінових рецепторів для перорального прийому. Дія схожа з дією ендогенних простациклінів. У рандомізованих дослідженнях продемонстровано, що препарат, що призначали пацієнтам з ЛАГ, які не приймали специфічної терапії або приймали стабільні дози антагоністів ендотелінових рецепторів або блокатори фосфодіестерази, зменшує ОЛА, достовірно на 40 % зменшує розвиток ускладнень та смертність (смерть від усіх причин, госпіталізації з приводу погіршення симптомів ЛАГ, погіршення ЛАГ, що призвело до трансплантації або атріальної септостомії, початку лікування парентеральними простаноїдами або до хронічної кисневої терапії і прогресування захворювання) [26].
Ралінепаг — ще один селективний агоніст простациклінових рецепторів для перорального прийому. Механізм дії подібний до ендогенних простациклінів. У РКД 3-ї фази пацієнти з ЛАГ (61 особа), які отримували стандартне лікування, включаючи моно- або подвійну специфічну терапію ЛАГ, були рандомізовані у співвідношенні 2 : 1 у групу ралінепагу (n = 40) або плацебо (n = 21). Початкова доза ралінепагу становила 10 мкг двічі на день. Потім дозу титрували за переносимістю протягом 9-тижневого періоду до максимальної загальної добової дози 600 мкг (300 мкг двічі на день). Ралінепаг достовірно знижував ОЛА порівняно із плацебо у хворих, які приймали моно- або подвійну комбіновану терапію. Середнє зниження ОЛА від початкового рівня становило –29,8 % порівняно із плацебо. Серйозні побічні явища траплялися у 10 % пацієнтів у групі з ралінепагом та у 29 % пацієнтів — із плацебо. Розроблена форма препарату із тривалою дією для одноразового прийому, яка на сьогодні проходить тестування у програмі досліджень ADVANCE. Так само розпочато дослідження ефективності препарату у хворих на ХТЕЛГ. Препарат зареєстровано EMEA для лікування ЛАГ в 2019 році.
Антагоністи рецепторів ендотеліну. У хворих на ЛАГ доведена активація системи ендотеліну як у плазмі, так і в тканинах легень [27–29]. Залишається нез’ясованим, чи є збільшення рівнів ендотеліну-1 в плазмі причиною або наслідком ЛГ, але ці дані підтверджують важливу роль системи ендотеліну в патогенезі ЛАГ. Ендотелін-1 в організмі людини зв’язується із двома типами специфічних рецепторів (А і В) і може викликати такі патологічні реакції, характерні для ЛАГ: судинозвужувальний ефект унаслідок скорочення гладком’язових клітин судин і бронхів, проліферація та міграція гладком’язових клітин, проліферація фібробластів, міграція лейкоцитів, моноцитів, макрофагів і вивільнення цитокінів, адгезія та агрегація тромбоцитів, гіпертрофія кардіоміоцитів, позитивний іно- і хронотропний ефект. Антагоністи рецепторів ендотеліну (АРЕ) — бозентан, амбризентан, таксентан, меситентан — є пероральними засобами. Механізм їх дії зумовлений пригніченням описаних ефектів ендотелінів.
Бозентан — перший у клініці і в даний час найбільш широко використовуваний препарат із цієї групи. Він блокує як рецептор ендотеліну А, так і рецептор ендотеліну В. Бозентан був вивчений при ЛАГ (ідіопатичній, асоційованій із захворюваннями сполучної тканини і при синдромі Ейзенменгера) у шести РКД (Дослідження-351, BREATHE-1, BREATHE-2, BREATHE-5, EARLY і COMPASS 2), які продемонстрували поліпшення толерантності до фізичного навантаження, ФК, гемодинаміки, показників ехокардіографії і допплерографії, а також збільшення часу до клінічного погіршення [30–34]. Збільшення печінкових амінотрансфераз спостерігалося приблизно у 10 % пацієнтів і було дозозалежним, але оберненим при зниженні дози або відміні препарату. З цих причин у пацієнтів, які отримують бозентан, печінкові функціональні тести слід виконувати щомісяця.
У 2018 році були опубліковані дані метааналізу оцінки ефективності бозентану в пацієнтів із ВВС [35]. Загалом проаналізовані дані 17 досліджень, 3 із них були педіатричними, до яких було залучено 456 пацієнтів із ВВС. 91,7 % лікувалися бозентаном строком не менше ніж 6 місяців. Терапія супроводжувалася збільшенням дистанції Т6ХХ, покращанням ФК, зменшенням індексу Borg, збільшенням сатурації в спокої. Покращувалися також гемодинамічні показники: зменшувався середній тиск у ЛА та ОЛА. Застосування бозентану також можливе при ХТЕЛГ, але, за даними досліджень, позитивні зміни не були такими вираженими, як при ЛАГ, і препарат не має в інструкції показань для даного типу ЛГ.
Амбрисентан є несульфаніламідом, класу пропанової кислоти, АРЕ, що є селективним для рецептора ендотеліну А. Амбрисентан був оцінений у пілотному дослідженні [36] і в 2 великих РКД — ARIES-1 і -2 (Амбрисентан при легеневій артеріальній гіпертензії; рандомізоване, подвійне сліпе, плацебо-контрольоване, багатоцентрове дослідження ефективності), які показали ефективність щодо зменшення симптомів, покращення переносимості фізичних навантажень, гемодинаміки і збільшення часу до клінічного погіршення у пацієнтів з ідіопатичною ЛАГ і ЛАГ, асоційованою із захворюваннями сполучної тканини та ВІЛ. Амбрисентан був схвалений для лікування пацієнтів ВООЗ-ФК II і III. Частота аномальних функціональних тестів печінки в діапазоні від 0,8 до 3 %. Жодної тенденції до аномальних функціональних тестів печінки не спостерігалося у пацієнтів, які раніше продемонстрували аномалії на іншому АРЕ, і щомісячна оцінка функції печінки не є обов’язковою у США [37, 38]. Було повідомлено про зростання частоти периферичних набряків при вживанні амбрисентану. Амбрисентан рекомендований для пацієнтів з ЛАГ.
Неселективний АРЕ мацитентан був розроблений шляхом модифікації структури бозентану з метою збільшення ефективності і безпеки. Мацитентан характеризується більш стійким зв’язуванням із рецептором та підвищенням проникнення в тканини. У дослідженні за дизайном «випадок — контроль» SERAPHIN (Дослідження антагоніста рецептора ендотеліну при легеневій артеріальній гіпертензії для покращення клінічних результатів) 742 хворі на ЛАГ у середньому лікувалися 3 або 10 мг мацитентану порівняно із плацебо протягом 100 тижнів. Первинною кінцевою точкою був час від початку лікування до появи першої композитної кінцевої точки — смерті, передсердної септостомії, трансплантації легень, початку лікування в/в або п/ш простаноїдами або погіршення ЛАГ. Мацітентан значно знизив частоту даної композитної кінцевої точки захворюваності та смертності серед пацієнтів з ЛАГ, а також підвищив переносимість фізичного навантаження. Переваги були показані як для пацієнтів, які не отримували лікування раніше, так і для тих, хто отримував попередню терапію ЛАГ. Хоча не було виявлено ніякої печінкової токсичності, спостерігалося зниження гемоглобіну в крові ≤ 8 г/дл у 4,3 % пацієнтів, які отримували 10 мг мацитентану. Мацитентан рекомендований у США (FDA) і Європейському Союзі (EMA) для лікування пацієнтів з ЛАГ. Досліджується його ефективність для лікування ХТЕЛГ.
Інгібітори фосфодіестерази-5. Зниження активності ферменту, що руйнує циклічний гуанозинмонофосфат (цГМФ), фосфодіестерази 5-го типу, призводить до вазодилатації через вплив на сигнальний шлях NO/цГМФ у ділянках, що експресують даний фермент. Пригнічуючи гідроліз цГМФ, препарати даного класу підвищують його рівні в крові, що зумовлює вазодилатаційні, антипроліферативні та проапоптичні ефекти, здатні уповільнити ремоделювання легеневих артерій. У системному кровотоці експресія ФДЕ-5 мінімальна, що пояснює відносну селективність інгібіторів ФДЕ-5 щодо легеневого циркуляторного русла. Крім того, є докази, що інгібітори ФДЕ-5 можуть безпосередньо підсилювати скоротливість ПШ. Дози та кратність прийому інгібіторів ФДЕ-5 наведені в табл. 6.
/25.jpg)
Силденафіл викликає зниження ОЛА та зменшує навантаження на ПШ. На сьогодні накопичені дані, що демонструють добру переносимість та ефективність силденафілу у хворих на ЛАГ різної етіології. У клінічних дослідженнях у хворих на ЛАГ силденафіл застосовувався в разових дозах 20–90 мг 2–3 рази на день і викликав поліпшення гемодинаміки та толерантності до фізичних навантажень. Більшість побічних ефектів силденафілу мають легкий або помірний ступінь тяжкості і пов’язані головним чином з розширенням судин (головний біль, припливи, носова кровотеча). Описані деякі інші побічні ефекти препарату — припливи, раптова втрата слуху, порушення кольоросприйняття, диспепсія. На підставі фармакокінетичних даних була запропонована внутрішньовенна лікарська форма силденафілу [39] як перехідна терапія для пацієнтів з ЛАГ із запланованим тривалим пероральним лікуванням, які тимчасово не в змозі ковтати таблетки. Можливо також застосування силденафілу у вигляді букального (сублінгвального) спрею. Силденафіл з обережністю може застосовуватися у хворих із іншими формами ЛГ, у яких неефективна інша медикаментозна терапія, але слід пам’ятати, що у деяких категорій пацієнтів при захворюваннях лівих відділів серця та ураженні паренхіми легень він може викликати погіршення стану.
Тадалафіл — інгібітор ФДЕ-5 із тривалим періодом напіввиведення (близько 17,5 години), що дозволяє його однократне застосування протягом доби. РКД за участю 406 пацієнтів з ЛАГ (53 % — на тлі терапії бозентаном), які отримували тадалафіл у дозі 2,5; 10; 20 або 40 мг один раз на добу, продемонструвало в найвищій дозі позитивний вплив на толерантність до фізичного навантаження, симптоми, гемодинаміку і час до клінічного погіршення [40]. Профіль побічних ефектів був аналогічний такому силденафілу.
Варденафіл — інгібітор ФДЕ-5, що приймається два рази на добу. У РКД за участю 66 пацієнтів із ЛАГ, які раніше не отримували лікування та прий-мали варденафіл 5 мг два рази на добу, було продемонстровано позитивний вплив на толерантність до фізичного навантаження, симптоми, показники гемодинаміку і час до клінічного погіршення [41]. Профіль побічних ефектів був аналогічний такому у силденафілу.
Стимулятори розчинної гуанілатциклази (РГЦ). У той час, як такі інгібітори ФДЕ-5 стимулюють сигнальний шлях NO — цГМФ, сповільнюючи деградацію цГМФ, стимулятори РГЦ підвищують продукцію цГМФ. У доклінічних дослідженнях на різних тваринних моделях стимулятори РГЦ продемонстрували антипроліферативні та антиремодулюючі властивості.
Ріоцигуат є першим представником цього нового класу сполук. Він має подвійний механізм дії: підвищує чутливість розчинної гуанілатциклази до ендогенного NO, а також напряму стимулює розчинну гуанілатциклазу незалежно від NO, активуючи синтез цГМФ, який відіграє важливу роль у регулюванні судинного тонусу, проліферації, фіброзу та запалення. За рахунок цього нового механізму дії ріоцигуат має більшу ефективність щодо ЛАГ та інших форм ЛГ, таких так ХТЕЛГ, для яких немає затверджених способів специфічного медикаментозного лікування. РКД за участю 443 пацієнтів з ЛАГ (44 і 6 % — на тлі терапії АРЕ або простаноїдами відповідно), які отримували ріоцигуат у дозі до 2,5 мг 3 р/добу, продемонструвало позитивний вплив на толерантність до фізичного навантаження, ФК, гемодинаміку та час до клінічного погіршення [42]. Збільшення толерантності до фізичного навантаження було продемонстровано й у пацієнтів із фоновою специфічною терапією. Найбільш поширеним серйозним небажаним явищем в групі лікування було синкопе (4 і 1 % відповідно в групі плацебо). Одночасне призначення ріоцигуату та інгібіторів ФДЕ-5 протипоказане через розвиток гіпотензії та інших значущих побічних ефектів [43]. Ріоцигуат — єдиний препарат, який продемонстрував ефективність при 2 різних типах легеневої гіпертензії: ХТЕЛГ (коли операція неможлива/неефективна) і ЛАГ. Аналіз вторинних кінцевих точок досліджень показав достовірно значимі зміни, зокрема ОЛА, рівня NT-proBNP, ФК, часу до клінічного погіршення та індексу вираженості задишки за шкалою Борга. Позитивна тенденція була відзначена при оцінці якості життя. У дослідженнях ефективності при ХТЕЛГ ріоцигуат достовірно поліпшував толерантність до фізичних навантажень у пацієнтів з неоперабельною формою, а також у хворих на стійку або рецидивуючу ЛГ після легеневої тромбендартеректомії. Також у цих пацієнтів спостерігалося стабільне суттєве поліпшення клінічно значимих показників, таких як гемодинаміка, ФК, рівень NT-proBNP [44]. Ефект спостерігався через 4 тижні після початку лікування, і поліпшення тривало надалі. Виживання хворих на ЛАГ і ХТЕЛГ протягом 4,5 року лікування ріоцигуатом становило > 91 %. Дослідження також показали, що у пацієнтів з ЛАГ ріоцигуат має добрий профіль безпеки як у вигляді монотерапії, так і в комбінації з АРЕ або простаноїдами. Найбільш частими несприятливими явищами при прийомі ріоцигуату були гіпотензія, головний біль, запаморочення, периферичні набряки та шлунково-кишкові симптоми, такі як диспепсія та нудота.
Підсумкові рекомендації щодо ефективності монотерапії ЛАГ (група 1) специфічними лікарськими засобами відповідно до функціонального класу та доказової бази наведені у табл. 7.
Більшості призначається комбінована специфічна терапія. На сьогодні експерти у своїх рекомендаціях значно обмежили категорію пацієнтів для призначення монотерапії специфічними засобами:
— ідіопатична ЛАГ, спадкова ЛАГ та ЛАГ, асоційована із прийомом препаратів, у вазореактивних хворих із ФК І–ІІ та стійким гемодинамічним покращенням (таке саме або краще, ніж досягнуте при гострому тесті) через щонайменше 1 рік лише на БКК;
— тривалий час лікування історичних хворих на ЛАГ за допомогою монотерапії (> 5–10 років) зі стабільним профілем низького ризику;
— хворі на ідіопатичну ЛАГ > 75 років із множинними факторами ризику СНзбФВ (підвищений АТ, цукровий діабет, ішемічна хвороба серця, ФП, ожиріння);
— хворі на ЛАГ із підозрою або високою ймовірністю легеневого ВОХ/ЛКГ;
— хворі на ЛАГ, асоційовану із ВІЛ-інфекцією, портальною гіпертензією або некорегованою вродженою хворобою серця, якщо вони не були включені до РКД із початковою комбінованою терапією;
— хворі на ЛАГ із дуже легким перебігом захворювання (наприклад, ФК І, ОЛА 3–4 од. Вуда, СрТЛА < 30 мм рт.ст., нормальний ПШ при ехокардіографії);
— комбінована терапія недоступна або протипоказана (наприклад, тяжкі захворювання печінки).
Якщо було обрано початкову монотерапію, то, оскільки порівняння між різними класами специфічних засобів не досліджувалися, практично неможливо запропонувати жоден кращий тип монотерапії на основі доказової медицини. Вибір препарату може залежати від різних факторів, включаючи статус схвалення, маркування, спосіб введення, профіль побічної дії, потенційну взаємодію із фоновою терапією, переваги пацієнта, супутні захворювання, досвід лікаря та вартість.
Наступний крок при незадовільному результаті лікування одним препаратом — перевести пацієнтів із одного лікарського засобу на інший. У клінічній практиці це буває необхідно в багатьох ситуаціях. Показовим прикладом може служити системна гіпертензія: якщо не вдається домогтися достатнього контролю АТ, то можна спробувати перевести пацієнта на інший препарат. Пілотним досвідом у цій галузі терапії ЛГ стало дослідження RESPITE [45], у якому була продемонстрована тактика переведення хворих на ЛАГ, які приймали інгібітори ФДЕ-5 із незадовільним клінічним результатом, на терапію ріоцигуатом. Інше рандомізоване контрольоване дослідження REPLACE, у якому у хворих на ЛАГ досліджено потенційну клінічну користь від переходу від інгібіторів ФДЕ-5 з АРЕ або без нього до ріоцигуату, знаходиться на фінальному етапі, і його результати поки недоступні [46]. Тим не менш, дана стратегія при ЛАГ пов’язана із безліччю труднощів, які обмежують її використання. По-перше, відсутня явна перевага одного лікарського засобу над іншим, що могло б послужити обґрунтуванням для використання покрокового підходу до лікування, навіть якщо лікарські засоби відносяться до одного і того ж фармакологічного класу. Винятком є внутрішньовенне застосування простацикліну, яке, за загальним визнанням, є найбільш ефективним, але інвазивним методом терапії. По-друге, невідомий профіль пацієнтів, які на терапію препаратами одного класу відповідали б краще, ніж на застосування іншого.
Комбінована терапія ЛАГ
Досвід тривалого спостереження підтвердив, що ефективність монотерапії з часом стає недостатньою у більшості хворих на ЛАГ, і очевидним етапом із метою зниження неприйнятно високої летальності при ЛАГ є одночасне застосування двох або більше лікарських засобів, дія яких спрямована на різні ланки патогенезу. Комбінована терапія із одночасним застосуванням двох або більше класів лікарських засобів успішно використовується в лікуванні системної гіпертензії і серцевої недостатності. Вона також є привабливим варіантом лікування ЛАГ, тому що певні препарати впливають на окремі сигнальні шляхи, які, як було зазначено вище, залучені в патогенез хвороби: простацикліновий шлях (простаноїди), ендотеліновий шлях (АРЕ) та шлях NO (інгібітори ФДЕ-5 і РГЦ).
У дослідженні PACES силденафіл додавали до внутрішньовенної терапії епопростенолом у 267 хворих із ЛАГ. Через 12 тижнів лікування відзначалася достовірна динаміка в Т6ХХ та часі до розвитку клінічного погіршення. Випадки смерті пацієнтів за період спостереження відзначалися тільки в групі плацебо [47]. Так само ефективність призначення другого препарату (трепростеніл до монотерапії) було підтверджено у вже згаданому дослідженні FREEDOM-EV: призначення перорального трепростинілу достовірно зменшило ризик клінічного погіршення на 26 % [25].
Іншою стратегією застосування комбінації є її призначення з самого початку, навіть хворим, які до цього не приймали специфічної терапії. Таке призначення має на меті більш агресивний вплив на патогенетичні ланки захворювання, щоб запобігти його прогресуванню та викликати стійке покращення, — так звана терапія на упередження (upfront therapy). Підставою для такої початкової або комбінованої терапії на упередження є загальновідомий рівень смертності при ЛАГ, який можна порівняти із таким при злоякісних новоутвореннях, а також той факт, що злоякісні пухлини і критичні медичні стани (серцева недостатність, злоякісна гіпертензія) гірше піддаються лікуванню за допомогою ступеневої терапії і більш ефективним є призначення комбінованої терапії на упередження. Досвід застосування комбінованої терапії на упередження при ЛАГ в РКД почався з невеликого дослідження BREATHE-2, яке не змогло продемонструвати суттєвої різниці між пацієнтами, які спочатку отримували комбінацію епопростенолу і бозентану порівняно із епопростенолом [48]. Було проведено кілька невеликих РКД, у яких оцінювали комбіновану терапію ЛАГ, але вони надали неоднозначні результати з точки зору ефективності. У 2011 році на основі метааналізу припустили, що комбінована терапія не має жодних переваг перед монотерапією, за винятком незначного збільшення переносимості фізичного навантаження [49].
Результати наступних двох великих рандомізованих контрольованих досліджень SERAPHIN (маситентан додавався до базисної специфічної терапії) і GRIPHON (силексипаг додавався до терапії інгібіторами ФДЕ-5 або АРЕ) продемонстрували, що додавання другого або третього лікарського засобу в комбінації з перевіреною базовою монотерапією може істотно сповільнити прогресування захворювання [50, 51]. Ці дані підтвердили обґрунтованість концепції, яка стверджує, що більше число лікарських засобів може забезпечити більш виражений клінічний ефект. І врешті-решт ця концепція була остаточно підкріплена результатами дослідження із початкового використання комбінованої терапії на упередження. Такий результат було отримано у дослідженні AMBITION, у якому проводилося порівняння монотерапії першої лінії тадалафілом або монотерапії амбризентаном із початковою комбінованою терапією тадалафілом і амбризентаном у пацієнтів із вперше виявленою ЛАГ ФК II і III [51]. Основною кінцевою точкою був комбінований показник клінічної неефективності (у тому числі смерть, госпіталізація, прогресування ЛАГ і незадовільний клінічний стан пацієнта). Дослідження продемонструвало позитивні результати зі зниженням числа подій у групі комбінованої терапії на 50 %. Крім того, спостерігалося поліпшення показників толерантності до фізичного навантаження, частоти задовільної клінічної відповіді і вмісту NT-proBNP у плазмі. Важливо, що на цей позитивний результат не вплинув початковий стан пацієнтів, у тому числі тих, хто мав хороший прогноз при монотерапії.
Таким чином, комбінована терапія може застосовуватися послідовно або безпосередньо з самого початку. Послідовна комбінована терапія — найбільш широко використовувана стратегія, як у РКД, так і в клінічній практиці: до монотерапії додають другий, а потім третій препарат при відсутності бажаної відповіді на лікування або прогресуванні хвороби. Для оцінки досягнення запланованих клінічних результатів використовується структурована проспективна програма — так звана цільова стратегія лікування, при якій як цілі терапії використовуються відомі прогностичні показники. На сьогодні такою метою є стабільне знаходження хворого у зоні низького ризику. Терапія вважається успішною тільки при досягненні цільових показників. Основна відмінність між цільовою терапією і неструктурованими підходами полягає в тому, що пацієнти, чий стан стабілізовано або він навіть трохи поліпшується, можуть все ще отримувати ескалацію лікування, якщо цілі терапії не досягнуті.
/28.jpg)
Рекомендації та докази щодо використання певних препаратів для початкової та послідовної комбінованої терапії ЛАГ відповідно до ФК наведені в табл. 8, 9.
Протягом останніх 15 років досвід використання комбінованої терапії постійно збільшується, і за даними метааналізу 17 РКД із комбінованої терапії за участю 4095 пацієнтів було показано, що комбінована терапія асоціювалася зі значним зниженням ризику клінічного погіршення порівняно із монотерапією: коефіцієнт ризику [RR] 0,65 [95% CI 0,58–0,72], р < 0,00001. Комбінована терапія також була пов’язана зі значним зниженням ризику госпіталізації, пов’язаного з ЛАГ, ескалації лікування та прогресування симптомів. Крім того, комбінована терапія достовірно покращувала функціональний статус, дистанцію при Т6ХХ [52]. Зниження рівня загальної смертності не було статистично значущим. Однак рівень смертності в РКД із застосуванням лікарських засобів для лікування ЛАГ є відносно низьким, і для досягнення рівня статистичної значущості може знадобитися значно більший обсяг вибірки, а також автори відмітили значну гетерогенність даних включених в аналіз досліджень, що також вплинуло на оцінку ризику смертності.
/29.jpg)
O. Sitbon зі співавторами дослідили роль початкової потрійної комбінованої терапії у пацієнтів із тяжкою ЛАГ із високим ризиком (n = 19), які мали ФК III–IV із тяжким порушенням гемодинаміки. Хворим призначали початкову потрійну комбіновану терапію в/в епопростенолом, пероральним бозентаном та силденафілом. На фоні терапії за 4 місяці спостереження спостерігалося достовірне зниження ОЛА на 67 %, а 17 із 19 пацієнтів досягли рівня ФК I або II (тобто жодних симптомів при фізичному навантаженні або лише легкі симптоми) [53]. Лише одному пацієнту була потрібна транс-плантація легень за час спостереження, виживання без пересадки становило 94 % за 3 роки.
Ця ж група дослідників також описала результати лікування 97 пацієнтів з ЛАГ із французького реєстру хворих на ЛГ, яким як перша лінія була розпочата подвійна пероральна комбінована терапія, що складалася із АРЕ та інгібітору ФДЕ-5.
Загальний рівень виживання становив 97, 94 та 83 % на 1, 2 та 3-му році спостереження відповідно. Виживання хворих, описане в цих дослідженнях початкової комбінованої терапії, набагато перевищувало виживання, яке спостерігалося до того у світових регістрах, в яких в основному застосовували послідовну комбіновану терапію [54].
У 2020 році був опублікований новий консенсус експертів щодо використання пероральних засобів простациклінового ряду у пацієнтів з різними формами ЛАГ, які отримували подвійну терапію АРЕ та інгібіторами ФДЕ-5 [56]. Виходячи з наявних даних, було узгоджено думку, що селексипаг може розглядатися для пацієнтів з ідіопатичною, спадковою, асоційованою із прийомом ліків та асоційованою зі ВВС після операції ЛАГ та гемодинамічними параметрами низького або середнього ризику, які отримують подвійну пероральну терапію АРЕ та інгібіторами ФДЕ-5. Це особливо показано хворим із ФК ІІ, які не були госпіталізовані через ЛАГ протягом останніх 6 місяців, але мають середню та тяжку дисфункцію ПШ. Експерти також погодилися, що внутрішньовенне або підшкірне введення препаратів простацикліну має бути вибором для лікування у пацієнтів із указаними формами ЛАГ, а також ЛАГ, асоційованою із захворюваннями сполучної тканини, які отримують подвійну пероральну терапію та мають гемодинамічні параметри високого ризику. Загалом у консенсусі обговорено 14 клінічних сценаріїв щодо використання пероральних простациклінових препаратів, із яких в 13 розглянуто можливість призначення селексипагу. Але автори підкреслили, що «висновки експертів повинні бути підтверджені суворими перспективними дослідженнями, і цей документ може слугувати моделлю для планування подальших випробувань».
Таким чином, сучасний алгоритм лікування, прописаний у рекомендаціях, щодо лікування із акцентом на корисність комбінованої терапії на упередження, базується в основному на указаних позитивних результатах дослідження AMBITION, обсерваційного дослідження та даних метааналізу. Рекомендація щодо початкової комбінованої терапії двома таблетованими засобами стосується більшості невазореактивних терапевтично «наївних» пацієнтів із низьким або середнім рівнем ризику.
Незалежно від початкового стану ризику слід проводити переоцінку клінічного стану пацієнтів через 3–6 місяців після початку лікування. Терапію можна продовжувати без змін, якщо досягається статус низького ризику. Для хворих, у яких зберігається статус проміжного ризику, лікування слід посилити шляхом переведення на потрійну комбіновану терапію (або подвійну терапію, якщо було обрано початкову монотерапію). Для статусу високого ризику рекомендується максимальна медикаментозна терапія (потрійна комбінована терапія, включаючи аналоги простацикліну п/ш або в/в, хоча в/в введення є кращим) та направлення на трансплантацію легень. Незважаючи на досягнення медикаментозної терапії та застосування комбінованих терапевтичних стратегій, ЛАГ залишається хронічним захворюванням, яке має прогресуючий характер, а пацієнтів, у яких спостерігається таке прогресування, незважаючи на медикаментозну терапію, важливо своєчасно скеровувати на трансплантацію легень.
Індивідуальний підхід до специфічної терапії залежно від початкового рівня ризику
Враховуючи відому на сьогодні доказову базу, пацієнти низького ризику із ФК І можуть початково отримати монотерапію. Найбільш часто призначається силденафіл у стандартних дозах. При його непереносимості призначають інші таблетовані засоби або інгібітори ФДЕ або АРЕ, у рідких випадках при непереносимості препаратів обох груп —препарати простацикліну.
Пацієнтам помірного рівня ризику при ФК ІІ, як правило, призначають початкову комбіновану терапію і вкрай рідко — монотерапію. Принцип вибору монотерапії описано вище. Комбінована терапія включає інгібітори ФДЕ та АРЕ, у нашій країні найбільш часто — силденафіл із бозентаном у стандартних дозах. При наявності протипоказань або обмежень щодо застосування АРЕ силденафіл комбінують із препаратами простацикліну, у нашій країні — з ілопростом у стандартних дозах.
Пацієнтам помірного рівня ризику при ФК ІІІ призначають початкову комбіновану терапію інгібіторами ФДЕ та АРЕ, у нашій країні найбільш часто — силденафіл із бозентаном у стандартних дозах. При наявності протипоказань або обмежень щодо застосування АРЕ силденафіл комбінують із препаратами простацикліну, у нашій країні — з ілопростом у стандартних дозах. При неефективності або недосягненні низького ризику до лікування підключають третій препарат простациклінового ряду, у нашій країні — ілопрост. Індивідуальний алгоритм лікування хворого на ІЛАГ із негативним вазореактивним тестом і низьким або помірним рівнем ризику показано на рис. 3.
/30.jpg)
Хворим високого ризику із самого початку рекомендована потрійна терапія (ІІІ та ІV ФК): призначають комбіновану терапію інгібіторами ФДЕ, АРЕ та препаратами простацикліну. У нашій країні найбільш часто призначають комбінацію силденафілу, бозентану та ілопросту в стандартних дозах. При неефективності намагаються збільшити дозу силденафілу, замінити бозентан на амбризентан або мацизентан та збільшити кратність прийому і дозу ілопросту. Можлива заміна інгібіторів ФДЕ на ріоцигуат. У тяжких випадках у нашій країні замість інгаляцій застосовують тривалу внутрішньовенну інфузію ілопросту оф-лейбл (5–10 діб) із подальшою заміною на інгаляційний шлях введення. Безумовно, такі пацієнти відповідно до симптомів та клінічного стану повинні отримувати інгаляції кисню, інфузію діуретиків, а при необхідності — інотропних препаратів (дофамін, добутамін, левосимендан).
Хірургічне лікування хворих на ЛГ
Передсердна септостомія — створення перфорації в міжпередсердній перегородці — почала застосовуватися у хворих із правошлуночковою СН з 80-х років ХХ століття [57]. Основою методики став факт, що хворі на ІЛАГ із вторинним відкриттям овального вікна мають кращу виживаність, ніж ті, у яких міжпередсердну перегородку збережено [58]. Створення міжпередсердного шунта, спрямованого справа наліво, може забезпечити декомпресію правих камер серця і збільшити переднавантаження для ЛШ і, відповідно збільшення серцевого викиду. Крім того, це покращує системний транспорт кисню, незважаючи на артеріальну десатурацію O2, і зменшує симпатичну гіперактивність.
Рекомендованою методикою є градуйована балонна дилатаційна передсердна септостомія, яка забезпечує покращення гемодинаміки і симптомів, а також знижує хірургічний ризик порівняно із відкритою методикою розсічення. Суть операції полягає в наступному: за допомогою спеціального катетера для доставки у міжпередсердну перегородку встановлюють балонний катетер, який поступово розширюють, поки показник насичення артеріальної крові О2 не знизиться на 10 %. Створення постійного скидання крові справа наліво призводить до зниження тиску в ПП, покращення показників функції ПШ, збільшення наповнення ЛШ та ХОК, що клінічно проявляється зменшенням частоти запаморочень, синкопе, підвищенням толерантності до фізичного навантаження [59, 60]. Інші методики, у тому числі встановлення в міжпередсердну перегородку різного типу клапанних пристроїв, вважаються експериментальними [3, 61].
Передсердна септостомія рекомендується хворим на ЛГ з ВООЗ-ФК ІІІ і IV із частими синкопе або рефрактерною до терапії правошлуночковою СН. Смертність хворих при проведенні передсердної септостомії становить 5–15 %. Із урахуванням ризику відновлення небезпечної для життя артеріальної гіпоксемії та, як наслідок, збільшення смертності, особливо у хворих на тяжку правошлуночкову недостатність, передсердна септостомія показана при неефективності всіх видів медикаментозного лікування або як підготовчий етап перед трансплантацією легень.
Ретельна оцінка ризику перед проведенням процедури забезпечує зниження рівня смертності. Слід уникати виконання балонної передсердної септостомії у пацієнтів із термінальною стадією хвороби із початковими значеннями тиску у правому передсерді > 20 мм рт.ст. і сатурацією артеріальної крові в спокої < 85 % при диханні кімнатним повітрям [3].
Трансплантація легень або комплексу серце — легені
Незважаючи на значні досягнення фармакотерапії ЛАГ, довгострокові результати медикаментозної терапії залишаються невизначеними, і трансплантація, як і раніше, залишається важливим варіантом лікування для пацієнтів, у яких медикаментозна терапія виявилася неефективною, із ВООЗ-ФК III або IV, або в яких захворювання прогресує [3]. Несвоєчасне направлення пацієнтів на трансплантацію в поєднанні з можливим тривалим очікуванням у зв’язку з нестачею донорських органів можуть збільшити смертність пацієнтів, які знаходяться в черзі на трансплантацію, і збільшити ризик погіршення їх клінічного стану на момент трансплантації.
Загальна 5-річна виживаність зі збереженням задовільної якості життя після трансплантації легень унаслідок ЛАГ становить 45–50 % [62]. Пізніші дані демонструють, що виживаність підвищилася до 52–75 % через 5 років і 45–66 % через 10 років [63–65].
У прийнятті рішення щодо направлення на трансплантацію може допомогти етіологія ЛАГ, оскільки прогноз залежить від основного захворювання. Насправді ЛАГ, асоційована із дифузними захворюваннями сполучної тканини, має найгірший прогноз, навіть при лікуванні простаноїдами, у той час як у пацієнтів із ЛАГ, асоційованою із ВВС, спостерігається краща виживаність. Найгірший прогноз у пацієнтів з венооклюзійною хворобою легень і легеневим капілярним гемангіоматозом через відсутність ефективних методів лікування. Цих пацієнтів слід ставити в чергу на трансплантацію з моменту встановлення діагнозу.
При ЛАГ виконується як трансплантація комплексу серце — легені, так і трансплантація обох легень, хоча поріг критичної систолічної дисфункції ПШ і/або діастолічної дисфункції ЛШ невідомий. Згідно з даними реєстру Міжнародного співтовариства трансплантації серця і легень, зараз переважній більшості пацієнтів у всьому світі виконують двосторонню пересадку легень [66]. Пацієнтам із синдромом Ейзенменгера на фоні простих шунтів проводиться ізольована трансплантація легень і усунення внутрішньосерцевого дефекту або трансплантація комплексу серце — легені [62]. Дані реєстру спочатку підтримували користь щодо виживання при трансплантації комплексу серце — легені для пацієнтів з ЛГ, пов’язаною із дефектом міжшлуночкової перегородки [67], але на сьогодні збільшився досвід проведення ізольованої двосторонньої трансплантації легень, і більш пізні дані підтверджують користь даного підходу у поєднанні із корекцією вади серця [68]. За даними Регістру міжнародного товариства трансплантації (2006), загальна 5-річна виживаність зі збереженням задовільної якості життя після трансплантації легень унаслідок ЛАГ становила 45–50 % [62]. Більш пізні дані демонструють, що виживаність підвищилася до 52–75 % через 5 років і 45–66 % через 10 років [69].
Оцінка можливості трансплантації легень передбачає багатодисциплінарну оцінку тяжкості захворювання, очікуваного прогнозу та потенційних протипоказань, а також гемодинамічне, лабораторне та візуалізаційне тестування. Найбільш частими причинами виключення хворих із розгляду питання про трансплантацію легень у більшості центрів є вік старше від 60 років, попередні торакальні операції, виражена дисфункція інших життєво важливих внутрішніх органів, хронічні системні захворювання, такі як погано контрольований діабет із супутніми ураженням органів, тяжкий атеросклероз, у тому числі ураження коронарних артерій, рак (крім локалізованих ракових захворювань шкіри), токсикоманія або неприхильність до лікування. Крім того, у всіх центрах проводиться детальна психосоціальна оцінка, щоб визначити, чи повністю пацієнти перенесуть трансплантацію легень та чи буде адекватна соціальна підтримка після трансплантації. У 90-х роках парентеральні простаноїди вважалися єдиним прийнятним засобом для підтримки до трансплантації легень, тоді як останніми роками стратегія підтримки змістилася в бік систем екстракорпоральної оксигенації та допоміжного кровообігу [69].
Рекомендації Міжнародного товариства транс-плантації серця та легень (2006) щодо направлення на трансплантацію легень при ЛАГ [70] включають наступне.
Проведення трансплантації
— ФК III або IV, незалежно від тривалості терапії.
— Швидке прогресування хвороби.
Включення хворих у чергу на трансплантацію
— Стійкий ФК III або IV на максимальній медикаментозній терапії.
— Низький результат Т6ХХ (< 350 м) або значне його зниження.
— Неефективність терапії внутрішньовенним епопростенолом або еквівалентом.
— Серцевий індекс < 2 л/хв/м2.
— Тиск у правому передсерді > 15 мм рт.ст.
Додаткові фактори ризику поганого результату трансплантації легень при ЛАГ
— Гіпонатріємія.
— Гіпербілірубінемія.
— TAPSE < 1,8 мм.
— Дифузне захворювання сполучної тканини (склеродермія).
— Хронічне обструктивне захворювання легень.
— Саркоїдоз.
— Легеневий фіброз.
— Синкопе.
— Поєднання емфіземи, легеневого фіброзу та ЛАГ.
Рекомендації щодо практики. ІЛАГ — тяжке і смертельне захворювання, яке потребує ретельного обстеження та специфічного лікування. Остаточна діагностика та підбір лікування повинні проводитися в спеціалізованих центрах досвідченими фахівцями. Чітке дотримання протоколу діагностики та лікування дозволяє принципово покращити якість життя та виживання пацієнтів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 24.09.2021
Рецензовано/Revised 08.10.2021
Прийнято до друку/Accepted 13.10.2021
Список литературы
1. Simonneau G., Montani D., Celermajer D., Denton C., Gatzoulis M., Krowka M., Williams P., Souza R. Number 4 in the series “Proceedings of the 6th World Symposium on Pulmonary Hypertension”. Edited by N. Galiè, V.V. McLaughlin, L.J. Rubin and G. Simonneau. Haemodynamic definitions and updated clinical classification of pulmonary hypertension. Eur. Respir. J. 2019. 53. 1801913; doi: 10.1183/13993003.01913-2018.
2. Frost A., Badesch D., Gibbs J.S.R., et al. Diagnosis of pulmonary hypertension. Eur. Respir. J. 2019. 53. 1801904; doi: 10.1183/13993003.01904-2018.
3. Galiè N., Humbert M., Vachiery J.L., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur. Heart J. 2016. 37(1). 67-119; doi: 10.1093/eurheartj/ehv317.
4. Kylhammar D., Kjellström B., Hjalmarsson C., et al. A comprehensive risk stratification at early follow-up determines prognosis in pulmonary arterial hypertension. Eur. Heart J. 2018. 39. 4175–4181; doi: 10.1093/eurheartj/ehx257.
5. Hoeper M.M., Kramer T., Pan Z., et al. Mortality in pulmonary arterial hypertension: prediction by the 2015 European pulmonary hypertension guidelines risk stratification model. Eur. Respir. J. 2017. 50. 1700-1740; doi: 10.1183/13993003.00740-2017.
6. Boucly A., Weatherald J., Savale L., et al. Risk assessment, prognosis and guideline implementation in pulmonary arterial hypertension. Eur. Respir. J. 2017. 50. 1700889; doi: 10.1183/13993003.00889-2017.
7. Hoeper M., Pittrow D., Opitz C., et al. Risk assessment in pulmonary arterial hypertension. Eur. Respir. J. 2018. 51. 1702606; doi: 10.1183/13993003.02606-2017.
8. Svetlichnaya J., Janmohammed M., De Marco T. Special Situations in Pulmonary Hypertension Pregnancy and Right Ventricular Failure. Cardiol. Clin. 2016. 34. 473-487; doi: 10.1016/j.ccl.2016.04.007.
9. Regitz-Zagrosek V., Roos-Hesselink J., Bauersachs J. et al. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy: The Task Force for the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). European Heart Journal. 2018. 39. 3165-3241; doi: 10.1093/eurheartj/ehy340.
10. Katsuragi S., Yamanaka K., Neki R. et al. Maternal outcome in pregnancy complicated with pulmonary arterial hypertension. Circ. J. 2012. 76. 2249-2254; doi: 10.1253/circj.cj-12-0235.
11. Satoh H., Masuda Y., Izuta S. et al. Pregnant patient with primary pulmonary hypertension: general anesthesia and extracorporeal membrane oxygenation support for termination of pregnancy. Anesthesiology. 2002. 97. 1638-1640; doi: 10.1097/00000542-200212000-00045.
12. Guillevin L., Armstrong I., Aldrighetti R., et al. Understanding the impact of pulmonary arterial hypertension on patients’ and carers’ lives. Eur. Respir. Rev. 2013. 22. 535-542; doi: 10.1183/09059180.00005713.
13. Sandoval J., Aguirre J.S., Pulido T., et al. Nocturnal oxygen therapy in patients with the Eisenmenger syndrome. Am. J. Respir. Crit. Care Med. 2001. 164. 1682-1687; doi: 10.1164/ajrccm.164.9.2106076.
14. Rich S., Seidlitz M., Dodin E., et al. The short-term effects of digoxin in patients with right ventricular dysfunction from pulmonary hypertension. Chest. 1998. 114. 787-792; doi: 10.1378/chest.114.3.787.
15. Arrigo M., Huber L.C. Eponyms in cardiopulmonary reflexes. Am. J. Cardiol. Elsevier. 2013. 112(3). 449-53; doi: 10.1016/j.amjcard.2013.03.055.
16. Sommer N., Dietrich A., Schermuly R.T., Ghofrani H.A., Gudermann T., Schulz R. et al. Regulation of hypoxic pulmonary vasoconstriction: basic mechanisms. Eur. Respir. J. 2008. 32(6). 1639-51; doi: 10.1183/09031936.00013908.
17. Sitbon O., Humbert M., Jaïs X., et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation. 2005. 111. 3105-3111; doi: 10.1161/CIRCULATIONAHA.104.488486.
18. Lang I.M. Measuring vasorectivity in pulmonary hypertension: a simple test, but do we understand it? The Journal Heart and Lung Transplant. 2015. 34(3). 306-7; doi: 10.1016/j.healun.2014.12.002.
19. Rubin L.J., Mendoza J., Hood M., et al. Treatment of primary pulmonary hypertension with continuous intravenous prostacyclin (epoprostenol). Results of a randomized trial. Ann. Intern. Med. 1990. 112. 485-491; doi: 10.7326/0003-4819-112-7-485.
20. Barst R.J., Rubin L.J., Long W.A., et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. N. Engl. J. Med. 1996. 334. 296-302; doi: 10.1056/NEJM199602013340504.
21. Badesch D.B., Tapson V.F., McGoon M.D., et al. Continuous intravenous epoprostenol for pulmonary hypertension due to the scleroderma spectrum of disease. A randomized, controlled trial. Ann. Intern. Med. 2000. 132. 425-434; doi: 10.7326/0003-4819-132-6-200003210-00002.
22. Rosenzweig E.B., Kerstein D., Barst R.J. Long-term prostacyclin for pulmonary hypertension with associated congenital heart defects. Circulation. 1999. 99. 1858-1865; doi: 10.1161/01.cir.99.14.1858.
23. Cabrol S., Souza R., Jaїs X. et al. Intravenous epoprostenol in inoperable chronic thromboembolic pulmonary hypertension. J. Heart Lung Transplant. 2007. 26. 357-362; doi: 10.1016/j.healun.2006.12.014.
24. McLaughlin V., Rubin L., Benza R.L., et al. Addition of inhaled treprostinil to oral therapy for pulmonary arterial hypertension: a randomized controlled clinical trial. J. Am. Coll. Cardiol. 2010. 55. 1915-1922; doi: 10.1016/j.jacc.2010.01.027.
25. White R.J., Jerjes-Sanchez C., Bohns Meyer G.M., et al. Combination Therapy with Oral Treprostinil for Pulmonary Arterial Hypertension. A Double-Blind Placebo-controlled Clinical Trial. Am. J. Respir. Crit. Care Med. 2020. 201 (6). 707-717; doi: 10.1164/rccm.201908-1640OC.
26. Sitbon O., Channick R., Chin K.M., et al.; for the GRIPHON Investigators. Selexipag for the Treatment of Pulmonary Arterial Hypertension. N. Engl. J. Med. 2015. 373. 2522-2533; doi: 10.1056/NEJMoa1503184.
27. Giaid A., Yanagisawa M., Langleben D., et al. Expression of endothelin-1 in the lungs of patients with pulmonary hypertension. N. Engl. J. Med. 1993. 328. 1732-1739; doi: 10.1056/NEJM199306173282402.
28. Stewart D.J., Levy R.D., Cernacek P., et al. Increased plasma endothelin-1 in pulmonary hypertension: marker or mediator of disease? Ann. Intern. Med. 1991. 114. 464-469; doi: 10.7326/0003-4819-114-6-464.
29. Galié N., Manes A., Branzi A. The endothelin system in pulmonary arterial hypertension. Cardiovasc Res. 2004. 61. 227-237; doi: 10.1016/j.cardiores.2003.11.026.
30. Channick R.N., Simonneau G., Sitbon O., et al. Effects of the dual endothelin-receptor antagonist bosentan in patients with pulmonary hypertension: a randomised placebo-controlled study. Lancet. 2001. 358. 1119-1123; doi: 10.1016/S0140-6736(01)06250-X.
31. Rubin L.J., Badesch D.B., Barst R.J., et al. Bosentan therapy for pulmonary arterial hypertension. N. Engl. J. Med. 2002. 346. 896-903; doi: 10.1056/NEJMoa012212.
32. Humbert M., Barst R.J., Robbins I.M., et al. Combination of bosentan with epoprostenol in pulmonary arterial hypertension: BREATHE-2. Eur. Respir. J. 2004. 24. 353-359; doi: 10.1183/09031936.04.00028404.
33. Galiè N., Rubin L.J., Hoeper M., et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. Lancet. 2008. 371. 2093-2100; doi: 10.1016/S0140-6736(08)60919-8.
34. Galiè N., Beghetti M., Gatzoulis M.A., et al. Bosentan the-rapy in patients with Eisenmenger syndrome: a multicenter, double-blind, randomized, placebo-controlled study. Circulation. 2006. 114. 48-54; doi: 10.1161/CIRCULATIONAHA.106.630715.
35. Hong-Yu Kuang, Yu-Hao Wu, Qi-Jian Yi et al. The efficiency of endolhelin receptor antagonist bosentan for pulmonary arterial hypertension associated with congenital heart disease A systematic review and meta-analysis. Medicine. 2018. 97. I0(e0075); doi: 10.1097/MD.0000000000010075.
36. Galie N., Badesch D., Oudiz R., et al. Ambrisentan the-rapy for pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2005. 46. 529-535; doi: 10.1016/j.jacc.2005.04.050.
37. Galié N., Olschewski H., Oudiz R.J., et al. Ambrisentan for the treatment of pulmonary arterial hypertension: results of the ambrisentan in pulmonary arterial hypertension, randomized, double blind, placebo-controlled, multicenter, efficacy (ARIES) study 1 and 2. Circulation. 2008. 117. 3010-3019; doi: 10.1161/CIRCULATIONAHA.107.742510.
38. Qudiz R.J., Galié N., Olschewski H., et al. Longterm ambrisentan therapy for the treatment of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2009. 54. 1971-1981; doi: 10.1016/j.jacc.2009.07.033.
39. Vachiery J.L., Huez S., Gillies H., et al. Safety, tolera-bility and pharmacokinetics of an intravenous bolus of sildenafil in patients with pulmonary arterial hypertension. Br. J. Clin. Pharmacol. 2011. 71. 289-292; doi: 10.1111/j.1365-2125.2010.03831.x.
40. Galiè N., Brundage B.H., Ghofrani H.A., et al. Tadalafil therapy for pulmonary arterial hypertension. Circulation. 2009. 119. 2894-2903; doi: 10.1161/CIRCULATIONAHA.108.839274.
41. Jing Z.C., Yu Z.X., Shen J.Y., et al. Vardenafil in pulmonary arterial hypertension: a randomized, double-blind, placebo-controlled study. Am. J. Respir. Crit. Care Med. 2011. 183. 1723-1729; doi: 10.1164/rccm.201101-0093OC.
42. Ghofrani H.A., Galiè N., Grimminger F., et al. Riociguat for the treatment of pulmonary arterial hypertension. N. Engl. J. Med. 2013. 369. 330-340; doi: 10.1056/NEJMoa1209655.
43. Galiè N., Muller K., Scalise A.V., Grunig E. PATENT PLUS: a blinded, randomised and extension study of riociguat plus sildenafil in PAH. Eur. Respir. J. 2015. 45. 1314-1322; doi: 10.1183/09031936.00105914.
44. Farber H., Busse D., de Oliveira Pena J., Ghofrani H.-A. Riociguat in chronic thromboembolic pulmonary hypertension (CTEPH): ERS/ESC risk assessment in CHEST. European Resp. J. 2016. 48. PA3598; doi: 10.1183/13993003.congress-2016.PA3598.
45. Hoeper M.M., Simonneau G., Corris P.A., et al. RESPITE: switching to riociguat in pulmonary arterial hypertension patients with inadequate response to phosphodiesterase-5 inhibitors. Eur. Respir. J. 2017. 50 (3). 1602425; doi: 10.1183/13993003.02425-2016.
46. Benza R.L., Corris P.A., Ghofrani H.A. et al. Switching to riociguat: a potential treatment strategy for the management of CTEPH and PAH. Pulmonary Circulation. 2020. 10 (1). 1-12; doi: 10.1177/2045894019837849.
47. Simonneau G., Rubin L.J., Galiè N., et al. Addition of sildenafil to long-term intravenous epoprostenol therapy in patients with pulmonary arterial hypertension: a randomized trial. Ann. Intern. Med. 2008. 149 (8). 521-530; doi: 10.7326/0003-4819-149-8-200810210-00004.
48. Humbert M., Barst R.J., Robbins I.M., et al. Combination of bosentan with epoprostenol in pulmonary arterial hypertension: BREATHE-2. European Resp. J. 2004. 24 (3). 353-359; doi: 10.1183/09031936.04.00028404.
49. Galiè N., Manes A., Negro L., Palazzini M. et al. A meta-analysis of randomized controlled trials in pulmonary arterial hypertension. Eur. Heart J. 2009. 30. 394-403; doi: 10.1093/eurheartj/ehp022.
50. Pulido T., Adzerikho I., Channick R.N., et al., for the SERAPHIN Investigators. Macitentan and Morbidity and Mortality in Pulmonary Arterial Hypertension. N. Engl. J. Med. 2013. 369. 809-818; doi: 10.1056/NEJMoa1213917.
51. Galie N., Barbera J.A., Frost A.E. et al., and AMBITOIN Investigators. Initial use of Ambrisentan plus tadalafil in pulmonary arterial hypertension. New Engl. J. Med. 2015. 373. 834-844; doi: 10.1056/NEJMoa1413687.
52. Lajoie A.C., Lauzière G., Lega J.-C., et al. Combination therapy versus monotherapy for pulmonary arterial hypertension: a meta-analysis. Lancet Respir. Med. 2016. 4 (4). 291-305; doi: 10.1016/S2213-2600(16)00027-8.
53. Sitbon O., Jais X., Savale L. et al. Upfront triple combination therapy in pulmonary arterial hypertension: a pilot study. Eur. Respir. J. 2014. 43. 1691-1697; doi: 10.1183/09031936.00116313.
54. Sitbon O., Sattler C., Bertoletti L. et al. Initial dual oral combination therapy in pulmonary arterial hypertension. Eur. Respir. J. 2016. 47. 1727-1736; doi: 10.1183/13993003.02043-2015.
55. McLaughlin V.V., Channick R., De Marco T., et al. Results of an Expert Consensus Survey on the Treatment of Pulmonary Arterial Hypertension With Oral Prostacyclin Pathway Agents. Chest. 2020. 157 (4). 955-965; doi: 10.1016/j.chest.2019.10.043.
56. Hummel S.L., Seymour E.M., Brook R.D., Kolias T.J., Sheth S.S., Rosenblum H.R., Wells J.M., Weder A.B. Low-sodium dietary approaches to stop hypertension diet reduces blood pressure, arterial stiffness, and oxidative stress in hypertensive heart failure with preserved ejection fraction. Hypertension. 2012. 60(5). 1200-6; doi: 10.1161/HYPERTENSIONAHA.112.202705.
57. Rich S., Lam W. Atrial septostomy as palliative therapy for refractory primary pulmonary hypertension. Am. J. Cardiol. 1983. 51. 1560-1561; doi: 10.1016/0002-9149(83)90678-1.
58. Rozkovec A., Montanes P., Oakley C.M. Factors that influence the outcome of primary pulmonary hypertension. Br. Heart J. 1986. 55. 449-458; doi: 10.1136/hrt.55.5.449.
59. Sandoval J., Gaspar J., Pulido T., et al. Graded balloon dilation atrial septostomy in severe primary pulmonary hypertension. A therapeutic alternative for patients nonresponsive to vasodilator treatment. J. Am. Coll. Cardiol. 1998. 32. 297-304; doi: 10.1016/s0735-1097(98)00238-1.
60. Kurzyna M., Dabrowski M., Bielecki D., et al. Atrial septostomy in treatment of end-stage right heart failure in рatients with pulmonary hypertension. Chest. 2007. 131. 977-983; doi: 10.1378/chest.06-1227.
61. Althoff T.F., Knebel F., Panda A., et al. Long-term follow-up of a fenestrated Amplatzer atrial septal occluder in pulmonary arterial hypertension. Chest. 2008. 133. 283-285; doi: 10.1378/chest.07-1222.
62. Trulock E.P., Edwards L.B., Taylor D.O., et al. Registry of the International Society for Heart and Lung Transplantation: twenty-third official adult lung and heart lung transplantation report — 2006. J. Heart Lung Transplant. 2006. 25. 880-892; doi: 10.1016/j.healun.2006.05.002.
63. Toyoda Y., Thacker J., Santos R., et al. Long-term outcome of lung and heart-lung transplantation for idiopathic pulmonary arterial hypertension. Ann. Thorac. Surg. 2008. 86. 1116-1122; doi: 10.1016/j.athoracsur.2008.05.049.
64. Fadel E., Mercier O., Mussot S., et al. Long-term outcome of double-lung and heart-lung transplantation for pulmonary hypertension: a comparative retrospective study of 219 patients. Eur. J. Cardiothorac. Surg. 2010. 38. 277-284; doi: 10.1016/j.ejcts.2010.02.039.
65. De Perrot M., Granton J.T., McRae K., et al. Outcome of patients with pulmonary arterial hypertension referred for lung transplantation: a 14-year single-center experience. J. Thorac. Cardiovasc. Surg. 2012. 143. 910-918; doi: 10.1016/j.jtcvs.2011.08.055.
66. Christie J.D., Edwards L.B., Kucheryavaya A.Y., et al. The Registry of the International Society for Heart and Lung Transplantation: 29th adult lung and heart-lung transplant report — 2012. J. Heart Lung Transplant. 2012. 31. 1073-1086; doi: 10.1016/j.healun.2012.08.004.
67. Waddell T.K., Bennett L., Kennedy R., et al. Heart-lung or lung transplantation for Eisenmenger syndrome. J. Heart Lung Transplant. 2002. 21. 731-737; doi: 10.1016/s1053-2498(01)00420-x.
68. Choong C.K., Sweet S.C., Guthrie T.J., et al. Repair of congenital heart lesions combined with lung transplantation for the treatment of severe pulmonary hypertension: a 13-year experience. J. Thorac. Cardiovasc. Surg. 2005. 129. 661-669; doi: 10.1016/j.jtcvs.2004.07.058.
69. De Perrot M., Granton J.T., McRae K., Cypel M., Pierre A., Waddell T.K., et al. Impact of extracorporeal life support on outcome in patients with idiopathic pulmonary arterial hypertension awaiting lung transplantation. J. Heart Lung Transplant. 2011. 30. 997-1002; doi: 10.1016/j.healun.2011.03.002.
70. Orens J.B., Estenne M., Arcasoy S., et al. International guidelines for the selection of lung transplant candidates: 2006 update — a consensus report from the pulmonary scientific council of the international society for heart and lung transplantation. J. Heart Lung Transplant. 2006. 25. 745-55; doi: 10.1016/j.healun.2006.03.011.

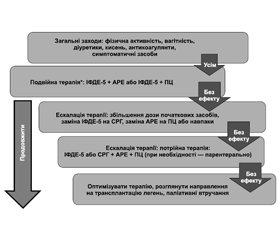
/14.jpg)
/15.jpg)
/15_2.jpg)
/16.jpg)
/19.jpg)
/21.jpg)
/22.jpg)
/25.jpg)
/26.jpg)
/28.jpg)
/29.jpg)
/30.jpg)