Вступ
На сьогодні лікування онкологічних захворювань є важливою соціально-економічною проблемою, яка кидає виклик системі охорони здоров’я всіх без виключення країн світу. За даними GLOBOCAN, у 2020 році у всьому світі виявлено близько 19,3 мільйона нових випадків та майже 10 мільйонів (9,9 млн) смертей від злоякісних пухлин [1]. Останніми десятиріччями, незважаючи на певні успіхи у лікуванні певних нозологічних форм (рак молочної залози, окремі види нейробластозів, нейроендокринні пухлини тощо), результати лікування деяких злоякісних новоутворень залишаються невтішними (наприклад, рак шлунка, рак яєчників, меланома). Значний внесок у покращення лікування роблять новітні методи медикаментозної (таргетної, імунотерапії) та променевої терапії (радіохірургія, променева терапія з модуляцією інтенсивності пучка тощо). Проте основним методом лікування солідних пухлин, який впливає на перебіг та прогноз, залишається хірургічне лікування.
Cучасна онкохірургія має у своєму арсеналі як вдосконалені технології, що з’явились декілька десятиріч тому (лапароскопічна резекційна хірургія, методика визначення сигнального лімфатичного вузла, інтраопераційне зварювання тканин тощо), так і новітні методи (роботизована хірургія). У деяких випадках це зумовило розвиток принципово нових концепцій лікування онкологічних хворих: наприклад, раціональний підхід до патофізіологічних змін періопераційного періоду, що ґрунтується на сучасних досягненнях анестезіології, мінімальній інтраопераційній травматизації тканини, ранній мобілізації пацієнта та пероральному харчуванні, призвів до виникнення і широкого застосування методології швидкого одужання хворого (fast-track surgery).
Зрозуміло, що наявність нових концепцій, технік, методологій в онкохірургії вимагає високого професіоналізму хірургів, який здобувається у провідних лікувальних та освітніх центрах під керівництвом досвідчених фахівців (що особливо важливо для хірургії), а також постійним удосконаленням знань та практичних навичок на робочому місці. Одним з найбільш суттєвих факторів, який впливає на прогноз перебігу солідних злоякісних пухлин, є хірургічне лікування, оскільки радикальність хірургічного втручання визначає віддалені показники виживаності онкологічних хворих [2, 3].
У кінці 70-х років минулого століття з’явилися результати декількох досліджень про взаємозв’язок між кількістю виконаних онкохірургічних втручань у лікарні (об’єм лікарні, ОЛ), а також кількістю проведених операцій окремим хірургом (об’єм хірурга, ОХ) та результатами лікування хворих на злоякісні пухлини. Згідно з цими публікаціями, хворі, яким проводили хірургічне лікування в лікарнях з великим об’ємом втручань, мали кращі результати порівняно з хворими, які лікувалися в лікарнях з невеликим об’ємом [4]. Поясненнями цього факту можуть слугувати: вищі показники технічних навичок хірургів з великим оперативним навантаженням, краща організаційна інфраструктура та оснащення медичних установ великого об’єму [5]. Пацієнти, які отримують лікування в спеціалізованих закладах, з більшою ймовірністю пройдуть коректне обстеження, отримають необхідний об’єм хірургічного лікування та своєчасну ад’ювантну терапію згідно з існуючими клінічними рекомендаціями, що і зумовить вищі показники загальної та безрецидивної виживаності хворих [6].
Практичною реалізацією цих даних стала централізація лікування онкологічних хворих останніми десятиріччями в низці країн і створення спеціалізованих вузькопрофільних онкологічних лікарень. Останні забезпечують мультидисциплінарний підхід до визначення тактики лікування, необхідні ресурси і обладнання для послідовності та наступності методів протипухлинної терапії [7, 8]. Методологічна функція провідних медичних центрів полягає в розробці єдиної моделі виконання стандартних онкохірургічних втручань, яка забезпечує оптимальний радикалізм при мінімальній хірургічній травмі.
Метою даного літературного огляду є систематизація наявних досліджень із вивчення взаємозв’язку об’єму лікувального закладу/об’єму хірурга з результатами лікування та виживаністю хворих на рак грудної залози (РГЗ), рак легені (РЛ), колоректальний рак (КРР) та рак шийки матки (РШМ).
Вплив об’єму лікувального закладу та хірургічного навантаження хірурга на результати лікування та виживаність при раку грудної залози
Лікування раку грудної залози потребує комплексного підходу, при цьому радикальність хірургічного втручання має найбільший вплив на тривалість життя хворих. У літературі наявні дослідження різного дизайну, результати яких вказують на вплив типу та об’єму лікувального закладу на результати лікування хворих та прогноз перебігу РГЗ. У закладах з більшим хірургічним навантаженням (об’ємом) лікування хворих на РГЗ є значно перспективнішим, тому що ймовірність проведення лікування згідно з найновішими клінічними рекомендаціями значно вища [2, 6, 9, 10]. Сучасний спектр онкохірургічних втручань з приводу раку грудної залози зводиться до двох основних альтернатив — мастектомія та органозберігаюча операція, ефективність яких при ранніх стадіях РГЗ є однаковою. У свою чергу, будь-яке з вищевказаних хірургічних втручань передбачає виконання регіонарної лімфодисекції або ж біопсії сторожових (сигнальних) лімфатичних вузлів. Виконання органозберігаючих операцій вимагає обов’язкового визначення статусу країв резекції, а отже, і можливості проведення експрес-біопсії безпосередньо під час оперативного втручання та післяопераційної променевої терапії у спеціалізованих радіологічних відділеннях. Проведення органозберігаючих операцій потребує певних технічних навичок для досягнення задовільних косметичних результатів втручання без втрати необхідного для онкохірургічних втручань радикалізму, що, у свою чергу, корелює з більшою кількістю виконаних операцій. Крім того, мультидисциплінарний підхід, що передбачає участь у плануванні лікування як мінімум 3 спеціалістів (онкохірурга, радіолога та клінічного онколога), найімовірніше може бути реалізований у лікувальних закладах великого об’єму. Результати досліджень показують, що неоад’ювантна терапія частіше проводиться саме у таких установах, а залучення хіміотерапевта і радіолога до визначення тактики лікування хворих дозволяє хірургу оцінити можливі переваги та недоліки передопераційної протипухлинної терапії [10, 11].
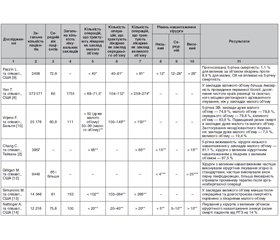
У популяційному проспективному дослідженні L. Pezzin та співавт. (2015) вивчали взаємозв’язок між об’ємом лікувального закладу і об’ємом хірурга та смертністю хворих на рак грудної залози від будь-яких причин. У дослідження було включено 2408 жінок старше від 65 років, хворих на РГЗ, із 4 штатів США (Флорида, Іллінойс, Нью-Йорк та Каліфорнія), які лікувались за програмою Medicare з квітня по вересень 2003 року. ОЛ був розрахований на основі середньорічного показника кількості хірургічних втручань за 24-місячний період до виконання операції хворій у 2003 році. Медичні заклади відносили до лікарень з малим об’ємом, якщо в них проводили менше ніж 40 хірургічних втручань з приводу РГЗ на рік, з середнім об’ємом — 40–80 втручань на рік та великим об’ємом — за наявності 81 і більше операції на рік. У результаті аналізу було встановлено, що смертність протягом 5 років після операції з приводу раку грудної залози була нижчою у пацієнтів, що проходили лікування у закладах з більшим хірургічним навантаженням. Прогнозована ймовірність смерті через 5 років після операції становила 1,1 % для хворих, які лікувалися в лікарнях з великим об’ємом, порівняно з 8,9 % для лікарень з малим об’ємом втручань. ОХ був визначений на основі сумарної кількості хірургічних втручань з приводу РГЗ, виконаних хірургом протягом 12 міс. За умови проведення менше 12 операцій на рік ОХ вважався малим, 12–28 — помірним та 28 і більше операцій на рік класифікувалися як великий ОХ. Взаємозв’язку між ОХ та смертністю хворих на РГЗ у даному дослідженні не було виявлено. Результати дослідження були скореговані за соціально-економічними та демографічними факторами. Також у процесі дослідження було з’ясовано, що одним з основних критеріїв, що впливають на вибір пацієнтами лікувального закладу, є географічна близькість [9].
Метою дослідження T. Yen та співавт. (2017) було вивчення впливу відмінностей надання медичної допомоги хворим на РГЗ на загальну та безрецидивну виживаність хворих та визначення ступеня впливу ОЛ на відмінності лікування. У дослідження включено дані 573 571 жінки, хворої на РГЗ І–ІІІ стадії, які лікувалися у 1755 різних лікарнях США з 1 січня 2007 по 31 грудня 2011 року. Середній вік хворих становив 60 років. У 53 % хворих діагностовано РГЗ І стадії, 35 та 12 % мали ІІ та ІІІ стадію відповідно. Лікувальні заклади за ОЛ були розподілені таким чином: малого об’єму — менше ніж 68–71,5 хірургічних втручання за 24 міс., середнього об’єму — 104–112 та великого об’єму — більше ніж 259–274 за 24 міс. Від загальної когорти пацієнтів 10, 51 та 38 % проходили лікування в малих, середніх та великих за об’ємом лікарнях відповідно. Встановлено, що пацієнти, які лікувались у закладах великого об’єму, мали більшу ймовірність проведення біопсії перед хірургічним втручанням (відношення шансів (OR) = 1,30, 95% CI = 1,14–1,49), ніж пацієнти, що отримували лікування в закладах малого об’єму, — 86 та 72 % відповідно, більшу імовірність досягнення чистоти країв резекції (OR = 1,28, 95% CI = 1,13–1,44) та подальшого спеціалізованого своєчасного ад’ювантного місцево-регіонарного лікування (OR = 1,16, 95% CI = 1,09–1,24). Корегування даних було проведено за расовою/етнічною приналежністю, віком, супутньою патологією, доходом, наявністю страхування, географічним розташуванням, рівнем урбанізації. Встановлено, що найчастіше лікування у великих за об’ємом лікарнях проходили жінки, які жили переважно в мегаполісному регіоні, отримували лікування в академічному/дослідницькому або комплексному закладі, були молодшими, застрахованими та мали мінімальну кількість супутньої патології [6].
У ретроспективному популяційному дослідженні F. Vrijens та співавт. (2012) порівнювали показники якості надання онкологічної допомоги та виживаність хворих на РГЗ в 111 різних за об’ємом надання допомоги лікувальних закладах Бельгії. Відомості про 25 178 жінок (середній вік 60,8 року), які проходили лікування з приводу РГЗ з 1 січня 2004 по 31 грудня 2006 року, були отримані з 3 баз даних Бельгії (Belgian Cancer Registry database, Belgian population database та Аdministrative database containing claims data). За ОЛ медичні заклади розподілили на 4 категорії: дуже малого об’єму — менше ніж 50 хворих на РГЗ на рік, малого об’єму — 50–99 пацієнтів, середнього об’єму — 100–149 та великого об’єму — більше ніж 150 пролікованих випадків на рік. За кількістю пролікованих хворі розподілилися таким чином: у медичних закладах дуже малого об’єму проліковано 20 % усіх хворих, малого об’єму — 22,1 %, середнього об’єму — 19,9 % та великого об’єму — 38 % хворих. Повнота надання даних стосовно стадії РГЗ відрізнялась залежно від ОЛ. У лікарнях з дуже низьким об’ємом в 15,1 та 16,4 % хворих були відсутні дані стосовно стадії та ступеня диференціювання пухлини після хірургічного втручання порівняно з 5,8 та 9,1 % випадків у великих за об’ємом лікарнях (p < 0,001). Загальна 5-річна виживаність всіх хворих становила 80,2 %, з варіаціями 74,9; 78,8; 79,8 та 83,9 % у пацієнтів, які проходили лікування в лікарнях дуже малого, малого, середнього та великого об’єму відповідно. Після проведення корегування складу випадків лікування РГЗ було встановлено, що пацієнти, які лікувалися в закладах дуже малого та малого об’єму, мали підвищений ризик смерті порівняно з хворими, які лікувалися у великих за об’ємом лікарнях (відношення ризиків (HR) = 1,26 (95% CI = 1,12–1,42) та 1,15 (95% CI = 1,01–1,30) для дуже малих та малих за об’ємом лікарень відповідно). Також було встановлено, що органозберігаючі операції у хворих з І–ІІ стадією РГЗ проводились з меншою частотою у закладах дуже малого об’єму порівняно з великими закладами: 65,2 проти 71,1 % відповідно. Застосування неоад’ювантного лікування у жінок з cT2-T3 РГЗ у закладах великого об’єму становило 19,4 % порівняно з 7,3 % у лікувальних закладах дуже малого об’єму. Також було встановлено асоціацію між вищою частотою застосування променевої терапії та об’ємом лікувального закладу на користь великооб’ємних лікарень (ефект 3,2 %; 95% CІ 1,5–4,9 %) та виявлено вищі показники обсягу подальшого мамографічного спостереження в аналогічних лікувальних закладах (ефект 1,5 %; 95% CІ 0,6–2,5 %) [10].
У дослідженні С. Chang та співавт. (2012) перевіряли гіпотезу про те, що онкологічні хворі, які лікувалися у лікарнях і у хірургів малого об’єму, мають нижчу виживаність порівняно з пацієнтами, які лікувалися у великих за об’ємом закладах та у хірургів великого оперативного об’єму. У дослідженні аналізували дані хворих на РГЗ, колоректальний рак, рак легені, рак простати та голови і шиї, яким проводили хірургічне лікування в 2002 році. Дані з 2002 по 2006 рік отримували з National Health Insurance (NHI) Research Database, яка охоплює заявки на отримання виплат на медичну допомогу 23 мільйонів мешканців Тайваню (97 % населення острова). Серед вибраних 11 677 пацієнтів, включених у дослідження, 3957 проходили лікування з приводу РГЗ. Особливістю цього дослідження є те, що в даній роботі оцінювався комбінований вплив об’єму медичного закладу та навантаження хірурга на результати виживаності. Основні соціодемографічні дані пацієнтів, залежно від яких виконувалось корегування, включали вік, стать, географічне розташування, метод лікування, стадію захворювання, соціально-економічний стан. Пацієнти, що лікувались у закладах малого об’єму, частіше були старшими, проживали в приміських/сільських регіонах і мали порівняно нижчий соціально-економічний статус. У результаті цього дослідження було встановлено, що пацієнти, які лікувались у хірургів низького навантаження у закладах малого об’єму, мали найнижчі показники 5-річної виживаності — 81,1 проти 87,5 % у хворих, яким проводилось оперативне лікування хірургами з великим навантаженням у лікарнях з великим об’ємом (HR = 1,65 (95% CI = 1,32–2,06); p < 0,001) [2].
На особливу увагу заслуговує дослідження М. Gilligan та співавт. (2007), які відобразили у своїй роботі взаємозв’язок між характеристиками хірурга та результатами лікування ранніх стадій РГЗ у популяційній, географічно різноманітній вибірці жінок похилого віку. Дані про хворих отримано з реєстру National Cancer Institute’s population-based Surveillance, Epidemiology, and End Results (SEER), що пов’язаний з базою заявок на виплати за програмою Medicare. Географічно в дослідження включено дані хворих на РГЗ з Коннектикуту, Детройту, штатів Мічиган, Айова, Нью-Мексико, Юта, Атланта та Джорджія. Для визначення характеристик хірургів використовували базу даних American Medical Association (AMA) Physicians’ Professional Database (PPD), яка містить відомості про вік, стать, демографічні, освітні та практичні поточні дані лікарів. Таким чином, було проаналізовано показники лікувальної роботи 1045 хірургів, які виконували операції 9449 жінкам віком 65 років і старше з І та ІІ стадією РГЗ у період з 1993 по 1996 рік. У даному дослідженні належним обсягом лікування ранніх стадій РГЗ, згідно з рекомендаціями National Institutes of Health (NIH) (Бетесда, Меріленд, США) 1990 року, було визнано органозберігаючу операцію (ОЗО) з аксилярною лімфодисекцією (АЛД) та подальшою променевою терапією або мастектомію з АЛД. Вивчалася відповідність проведеного лікування стандартам NIH, а саме виконання АЛД пацієнтам при ОЗО та мастектомії і проведення ад’ювантної променевої терапії пацієнтам, які перенесли ОЗО. Виконання аксилярної лімфодисекції оцінювалося окремо у зв’язку зі зростаючою тенденцією до її невиконання у пацієнтів похилого віку. Хірург визначався академічним у тому випадку, якщо він працював у медичній школі або більшість хірургічних втручань з приводу РГЗ було виконано ним у лікарні, яка є філіалом медичної школи. Середній вік хірургів, включених у дослідження, становив 50,4 року, більшість (64,3 %) були віком до 55 років, а 12,2 % хірургів були старше за 65 років. Більше 80 % хірургів були сертифіковані по загальній хірургії та вузькій хірургічній спеціальності, майже 30 % мали академічне звання, а 13 % лікарів були сертифіковані тільки по загальній хірургії. У результаті дослідження було встановлено, що пацієнтам, які лікувались у хірургів без вторинної спеціалізації (онкохірургічної), рідше виконували хірургічне лікування відповідно до рекомендацій, особливо це стосувалось пацієнтів, які мали показання до ОЗО. Хірурги великого об’єму (> 25 операцій) частіше виконували вид хірургічного лікування згідно з рекомендаціями NIH, частіше виконували хворим АЛД під час ОЗО та мастектомії, та їх пацієнти з більшою ймовірністю отримували в подальшому променеву терапію після ОЗО. Відношення шансів 1,12 для взаємозв’язку між ОХ та відповідністю проведеного лікування стандартам відповідає 12% збільшенню ймовірності надання медичної допомоги в необхідному обсязі при кожному подвоєнні ОХ. Наприклад, якщо всі інші фактори будуть постійними, можна очікувати, що хірург, котрий виконує 8 операцій з приводу РГЗ, буде мати на 12 % вищі шанси провести лікування згідно з рекомендаціями NIH, ніж хірург, який виконує 4 операції на рік за програмою Medicare [12].
У своїй роботі М. Simunovic та співавт. (2006) вивчали вплив ОЛ та статусу навчального центру на післяопераційну летальність та віддалену виживаність хворих на рак ободової кишки, грудної залози, легені, стравоходу та печінки. Дані для дослідження отримані з Ontario Cancer Registry (Онтаріо, Канада) у період з 1990 по 2000 рік. За вказаний період виявлено відомості про 14 346 жінок, середній вік 61 рік, які перенесли хірургічне втручання з приводу РГЗ. Для всіх хворих не було виявлено статистично значущих відмінностей за розміром пухлини (T) та статусом регіонарних лімфовузлів (N). Середня післяопераційна летальність у хворих на РГЗ становила 0,2 %, а імовірність післяопераційної смертності була вищою серед пацієнтів, які лікувались у закладах малого об’єму (OR = 10,0, 95% СІ = 1,1–91,8, p = 0,04). Серед усіх досліджуваних локалізацій злоякісних новоутворень (рак товстого кишечника, легень, стравоходу, печінки) статистично значимою була лише залежність між об’ємом закладу та післяопераційною летальністю при РГЗ, незважаючи на те, що показник смертей був досить малим. ОЛ впливає на показники довгострокової смерті від РГЗ, а саме відношення ризиків були значно збільшені в лікарнях з малим об’ємом порівняно з лікарнями з великим об’ємом (HR = 1,2 (95% CI = 1,0–1,4); p < 0,05). Для всіх лікувальних закладів не було статистично значущих відмінностей у ризику післяопераційної або довгострокової смертності пацієнтів залежно від наявності статусу навчального центру. Дане дослідження дозволяє зробити припущення, що централізація надання онкологічної допомоги може значно зменшити показники смертності та покращити показники виживаності серед пацієнтів із злоякісними новоутвореннями [13].
A. Nattinger та співавт. (2007) вивчали потенційну похибку у взаємозв’язку між ОХ та смертністю від РГЗ або інших причин. Для дослідження з бази даних SEER взято відомості 12 216 жінок віком 66 років і старше, у яких діагностовано інвазивний РГЗ І або ІІ стадії у період з 1 січня 1994 по 31 грудня 1996 року. ОХ вважався малим за умови проведення менше ніж 5 операцій з приводу РГЗ на рік, середнім та великим — 5–10 та більше ніж 10 хірургічних втручань на рік. При медіані спостереження 50 міс. серед 12 216 хворих на РГЗ було виявлено 2753 випадки смерті (22,5 %, або 54,4 випадку на 1000 пацієнто-років), з яких 760 випадків (6,2 %, або 15,6 випадку на 1000 пацієнто-років) — від РГЗ та 1894 (15,5 %, або 38,8 випадку на 1000 пацієнто-років) — від інших причин, а причина смерті 99 (0,8 %) хворих невідома. Було встановлено, що рівень смертності від РГЗ серед пацієнтів з малим та великим об’ємом становив 17,4 проти 13,0 випадку на 1000 пацієнто-років відповідно, а смертність від інших причин — 46,0 проти 31,7 смерті на 1000 пацієнто-років для малого та великого ОХ відповідно. Після корегування показників смертності за демографічними і прогностичними факторами, супутньою патологією та ОЛ встановлено, що ОХ впливає на ризик смерті від РГЗ, а саме у пацієнтів, які отримали лікування у хірургів великого навантаження, ризик смерті від РГЗ на 14 % нижчий порівняно з пацієнтами, які лікувались у хірургів малого об’єму. Факторами, які визначались предикторами до лікування у великооб’ємних хірургів, були білий колір шкіри, проживання в сільській місцевості або мегаполісному регіоні з рівнем населення менше 250 тис., більший середній дохід, менша кількість супутньої патології, відомий статус гормональних рецепторів та невідомий статус лімфатичних вузлів. Особливістю даного дослідження є те, що серед пацієнтів, що лікувались у хірургів великого, середнього та малого об’єму оперативного навантаження, були чітко окреслені відмінності як клінічних показників, так і соціально-демографічних. Це дозволяє зробити припущення, що рівень навантаження хірурга та вищенаведені чинники є взаємопов’язаними характеристиками [14].
У популяційному дослідженні R. Kuo та співавт. (2012) вивчали вплив якості надання медичної допомоги на рівні пацієнта та на рівні медичного закладу на показники загальної та безрецидивної виживаності хворих на РГЗ. У дослідження включили 6396 жінок, зареєстрованих у базі даних Taiwan’s Cancer Database (середній вік 51,4 року), у яких діагностовано РГЗ у період з 2003 по 2004 рік. Оцінка якості надання медичної допомоги проводилася за 10 критеріями для кожного пацієнта. Критеріями виключення із дослідження були такі характеристики: хірургічне лікування не проводилось; немає даних про проведення операції; лікування проводилося більше ніж через 2 роки після встановлення діагнозу; хірургічне втручання у медичних закладах з ОЛ менше ніж 30 випадків. Встановлено, що висока коморбідність та низька якість надання медичних послуг зменшують показники 5-річної загальної та безрецидивної виживаності (p < 0,001). Статистично значущого впливу ОЛ на виживаність хворих не виявлено (p < 0,181), що, ймовірно, пов’язано з включенням у дослідження медичних закладів, у яких виконувалось 177 і більше хірургічних операцій з приводу РГЗ на рік. Частота рецидивів, виявлених протягом 5 років після лікування у пацієнтів, які лікувались у спеціалізованих хірургів, становила 20,4 % порівняно 30,2 % (p = 0,056) серед хворих, яким хірургічне втручання виконували неспеціалізовані хірурги. Показники 5-річної загальної виживаності становили 87,9 та 61,9 % (p < 0,001) серед хворих, які лікувалися у спеціалізованих та неспеціалізованих хірургів відповідно. Смертність також залежала від рівня оперативного навантаження хірурга [15].
Дослідження К. Skinner та співавт. (2003) мало на меті вивчити вплив спеціалізації хірурга та лікарні на виживаність після лікування РГЗ. У дослідження включено 29 666 хворих на РГЗ у період з 1990 по 1998 рік, відомості про яких знаходилися в базі даних Cancer Surveillance Program database for Los Angeles County. Встановлено, що лікування в спеціалізованому центрі не вплинуло на виживаність хворих. Багатофакторний аналіз показав, що пацієнти, які лікувались у хірургів-онкологів, мають на 33 % нижчий ризик смерті через 5 років після операції, ніж пацієнти, що лікувались у хірургів неонкологічної спеціалізації (ОR = 0,77; CI = 0,67–0,88). Також було виявлено тенденцію до частішого застосування органозберігаючих операцій онкохірургами, які, у свою чергу, працюють у багатопрофільних медичних установах великого об’єму, що підтверджує гіпотезу позитивного зв’язку між ОЛ/ОХ та кращим прогнозом лікування і відповідає результатам вищенаведених досліджень [16].
У дослідженні R. Greenup та співавт. (2018) вивчали взаємозв’язок між об’ємом лікарні та смертністю від РГЗ. Джерелом даних для цього дослідження була American College of Surgeons National Cancer Data Base (NCDB). У дослідження включено відомості про 1 064 251 жінку віком від 18 до 90 років (медіана 60 років), у яких діагностовано 0–ІІІ стадію однобічного РГЗ з 2004 по 2012 рік. За об’ємом лікарні розділили на малого об’єму — менше ніж 148 випадків на рік, середнього об’єму — 148–298 випадків та великого об’єму — більше ніж 298 випадків хірургічного лікування РГЗ за рік. Обсяг хірургічного втручання, частота призначення променевої, хіміо- та ендокринотерапії не відрізнялись у лікарнях з різним об’ємом. Показники загальної 5-річної та 10-річної виживаності становили відповідно 91 та 77 % для лікарень великого, 90 та 75 % — для середнього і 87 та 70 % — для лікарень малого об’єму (p < 0,001). Пацієнти, які лікувалися в лікарнях з великим об’ємом, мали меншу на 11 % загальну смертність, ніж пацієнти лікарень малого об’єму (ОR = 0,89, 95% CI = 0,84–0,96). Додаткові переваги у виживаності мали пацієнти з 0 (ОR = 0,79, 95% CI = 0,70–0,89) та І стадією (ОR = 0,87, 95% CI = 0,80–0,94), які лікувалися в лікарнях з великим об’ємом, порівняно з пацієнтами з ІІ та ІІІ стадією РГЗ [17]. Результати наведених досліджень систематизовані в табл. 1.
/63.jpg)
/64.jpg)
Вплив об’єму лікувального закладу на результати лікування раку легені
Хірургічне лікування раку легені залежить від локалізації та гістологічного типу пухлини. Важливим моментом виконання даних операцій є збереження мікроскопічно негативних країв резекції (R0). У випадку дрібноклітинного раку легені застосування хірургічних втручань обмежене та не є основним методом лікування (через низькі показники виживаності). Даний розділ включатиме лише оцінку впливу об’єму лікувального закладу/хірурга на результати лікування хворих на недрібноклітинний РЛ [18–20].
Дослідження М. Simunovic та співавт. (2006), дизайн дослідження наведено вище, включало когорту із 2698 хворих на РЛ, які отримали хірургічне лікування в лікарнях малого (42 лікарні), середнього (21 лікарня) та великого об’єму (4 лікарні). У результаті було виявлено, що пацієнти, які отримали лікування у лікарнях великого та середнього об’єму, мають меншу імовірність післяопераційної летальності порівняно із закладами малого об’єму (OR = 2,8, 95% СІ = 1,2–6,3, p = 0,01) та віддаленої смертності хворих (HR = 1,3, 95% СІ = 1,1–1,6, p < 0,01). Для всіх лікувальних закладів не було статистично значущих відмінностей у ризику післяопераційної або довгострокової смертності пацієнтів залежно від статусу навчального центру [13].
У популяційному дослідженні P. Bach та співавт. (2001) оцінювали взаємозв’язок між ОЛ та виживаністю хворих на РЛ. У дослідження включено 2118 хворих, які перенесли хірургічне втручання з приводу недрібноклітинного раку легень І–ІІІА стадій, із 76 лікарень. Дані отримано з бази SEER за період з 1985 по 1996 рік. За об’ємом лікарні розподілили таким чином: 1–8 операцій, 9–14, 15–19, 20–66 та 67–100 операцій з приводу РЛ на рік. У дослідженні встановлено, що 5-річна виживаність у пацієнтів, які лікувались у закладах з об’ємом 1–8 операцій, становила 33 %, 9–14 операцій — 36 %, 15–19 — 39 %, 20–66 — 40 % та 44 % у лікарнях з об’ємом 67–100 операцій на рік. Відмінності показників виживаності між найменшим та найбільшим ОЛ є статистично вірогідними (p < 0,001). Окрім цього, кращі показники 5-річної виживаності були виявлені серед пацієнтів, які лікувались у начальних медичних закладах: 42 % порівняно з 34 % для ненавчальних. Також було з’ясовано, що у пацієнтів, які лікувалися в лікарнях з найбільшим об’ємом, частота легеневих післяопераційних ускладнень (пневмоторакс та колапс легені) була в 2 рази меншою (20 проти 44 %) та зафіксовано в 2 рази меншу 30-денну смертність (3 проти 6 %), ніж у закладах з найменшим об’ємом [21].
У ретроспективному когортному дослідженні F. Farjah та співавт. (2020) вивчали вплив ОЛ/ОХ на короткочасні результати лікування хворих на РЛ. З використанням бази даних Society of Thoracic Surgeons General Thoracic Surgery Database (STS-GTSD) було ідентифіковано 32 183 пацієнти, яким з січня 2015 по грудень 2017 року проведено хірургічне лікування з приводу будь-якої стадії РЛ. Результати дослідження не показали статистично значимого зв’язку між об’ємом лікувального закладу/рівнем оперативного навантаження хірурга та операційною смертністю, частотою ускладнень, тривалістю перебування в клініці. Однак при подальшому аналізі даних було виявлено нелінійну залежність між великим ОХ (кількість проведених операцій > 115) та більш низьким рівнем операційної летальності. Також був встановлений пороговий показник для ОХ — ≥ 60 проведених операцій на рік, що асоціювався з кращим прогнозом у пацієнтів. Отже, дане дослідження дозволяє припустити, що ОХ впливає на короткострокові результати хірургічного лікування раку легень [22].
S. Harrison та співавт. (2018) провели дослідження з вивчення зв’язку між ранніми післяопераційними ускладненнями та ОЛ/ОХ. Відомості про пацієнтів були отримані з State inpatient databases (SIDs) та Healthcare Cost and Utilization Project (HCUP) за 2009–2011 роки. У дослідження включено 20 138 пацієнтів (старше за 18 років), які перенесли лобектомію чи пневмонектомію з приводу раку легень у лікувальних закладах малого та великого хірургічних об’ємів. У результаті статистично значимого зв’язку між частотою виникнення ранніх післяопераційних ускладнень та ОЛ не виявлено. Різниця була виявлена лише в середній тривалості перебування в стаціонарі для велико- та малооб’ємних лікарень, 6 та 5 днів відповідно [23].
А. Thai та співавт. (2019) провели дослідження серед 15 369 пацієнтів з недрібноклітинним раком легень, які лікувались у період з 2008 по 2014 рік у 30 клініках. У даній когорті пацієнтам здійснювали 3 види операцій — лобектомія (57 %), субчасткова резекція (38 %), пневмонектомія (5 %). У результаті було встановлено, що смертність протягом 90 днів після операції в закладах малого об’єму є вищою порівняно із закладами великого об’єму і становить 5,4 та 3,1 % відповідно. Потреба у перебуванні пацієнтів у відділенні інтенсивної терапії > 24 годин була вищою у пацієнтів, які лікувались у клініках малого об’єму [24].
У дослідження С. Chang та співавт. (2012), дизайн якого наведено вище, включено 655 хворих на РЛ. У результаті цього дослідження було встановлено, що пацієнти, які лікувались у хірургів низького навантаження у закладах малого об’єму, мали найнижчі показники 5-річної виживаності: 39,5 проти 50,2 % у хворих на РЛ, яким проводилось оперативне лікування хірургами з великим хірургічним навантаженням у лікарнях з великим об’ємом (HR = 1,67 (95% CI = 1,02–2,73); p < 0,001) [2].
Результати наведених досліджень систематизовані в табл. 2.
Вплив об’єму лікувального закладу та навантаження хірурга на результати лікування колоректального раку
Основним методом лікування неметастатичного колоректального раку є хірургічне втручання. Одним з найважливіших аспектів у даній операції є край резекції, який має прогностичне значення для ризику виникнення локального рецидиву, а отже, і впливає на якість та тривалість життя хворих. Дослідження щодо кореляції хірургічного об’єму лікувального закладу та прогнозу захворювання описані в багатьох роботах, однак більшість з них вказує на пряму залежність між навантаженням клініки та кращими показниками 5-річної та загальної виживаності, зменшенням частоти післяопераційних ускладнень та смертності [25, 26].
У вищезгаданому дослідженні С. Chang та співавт. (2012) вивчали залежність між ОЛ/ОХ та показниками 5-річної виживаності 4274 хворих на КРР. У результаті дослідження встановлено, що пацієнти, які лікувались у хірургів високого навантаження у закладах великого об’єму, мали вищі показники 5-річної виживаності: 65,1 проти 53,8 % у хворих на КРР, яким проводилось оперативне лікування хірургами з низьким хірургічним навантаженням у лікарнях з малим об’ємом (HR = 1,64 (95% CI = 1,40–1,92); p < 0,001). Це дозволяє дійти висновків, що кількість випадків лікування у закладі > 61 та оперативних втручань > 14 у хірурга протягом 12 місяців мають комбінований вплив на показники 5-річної виживаності [2].
J. Meyerhardt та співавт. (2003) у своїй роботі досліджували взаємозв’язок між ОЛ та віддаленими результатами лікування хворих на рак товстої кишки. У рандомізоване когортне дослідження було включено 3161 пацієнта із ІІ–ІІІ стадіями раку товстої кишки, які проходили лікування в 1078 лікувальних закладах США. Було виявлено тенденцію, що пацієнти, які лікувались у закладах малого об’єму, найчастіше мали пухлини з інвазією в сусідні тканини (Т4), більше 5 уражених метастазами лімфатичних вузлів. У закладах великого об’єму виявляли порівняно більшу кількість лімфатичних вузлів у післяопераційному препараті. Загальна 5-річна виживаність пацієнтів, які лікувались у закладах малого об’єму, становила 63,8 %, а у закладах великого об’єму — 67,3 %. Пацієнти, які отримували хірургічне лікування у медичних закладах малого об’єму, мали вищий ризик смертності (OR = 1,16 (95% СІ = 1,03–1,32)). Статистично значимого зв’язку між об’ємом закладу та ризиком рецидиву виявлено не було. 5-річна БРВ пацієнтів лікарень малого об’єму становила 63,9 проти 63,0 % у лікарнях великого об’єму [27].
У загальнонаціональному популяційному дослідженні на Тайвані С. Liu та співавт. (2015) вивчали вплив ОЛ та ОХ на результати лікування хворих на КРР. Дослідження включало 61 728 пацієнтів, котрим було проведено радикальне хірургічне лікування з приводу КРР у 218 лікувальних закладах (1658 хірургів) за період з 2005 по 2011 рік. Відомості про хворих отримано з бази даних National Health Insurance Research Database (NHIRD). У результаті встановлено, що пацієнти старше від 60 років, низького доходу, які мають супутню патологію та проживають у сільській місцевості, частіше підлягають лікуванню хірургами малого оперативного навантаження. Показники 5-річної смертності від усіх причин нижчі у пацієнтів, які лікувалися у хірургів з високим хірургічним навантаженням: 27,4 % порівняно з 41,4 % у хірургів низького навантаження. П’ятирічна смертність від усіх причин корелює з ОЛ і становить 32,0 % у лікарнях з великим об’ємом проти 38,7 % у медичних закладах з малим об’ємом хірургічного лікування. Після корегування всіх характеристик пацієнтів (вік, рівень доходу, географічне розташування, наявність супутньої патології) було встановлено, що на ризик смертності пацієнта впливає саме об’єм навантаження хірурга, а не навантаження лікувального закладу. Пацієнти, які лікувались хірургами великого оперативного навантаження, мали нижчий показник операційної летальності, менший термін перебування в лікувальному закладі та нижчі медичні витрати [25].
D. Schrag та співавт. (2000) у ретроспективному когортному дослідженні вивчали можливий вплив ОЛ на прогноз виживаності після хірургічного лікування хворих на рак ободової кишки. Дослідження проводилося на основі ідентифікованих у базі SEER даних 29 966 хворих, яким проводилося хірургічне лікування раку ободової кишки з 1991 по 1996 р. У результаті дослідження виявлено зв’язок між ОЛ та смертністю пацієнтів з І–ІІІ стадією раку ободової кишки. Так, смертність протягом перших 30 днів після операції становила 3,5 % у лікарнях з великим об’ємом та 5,5 % — з малим об’ємом (p < 0,001). 5-річна смертність у великих за об’ємом лікарнях становила 50,4 проти 54,8 % у лікарнях з малим об’ємом хірургічного лікування (p < 0,001). Найбільша різниця в показниках 5-річної смертності (+6,5 %) зафіксована у хворих із ІІІ стадією раку ободової кишки: 62,5 % для малих за об’ємом лікарень та 56,0 % для лікарень з великим об’ємом (p < 0,001). При цьому зв’язок між вищими показниками смертності та закладом малого об’єму залишився статистично значущим після корегування за статтю, віком, расою, стадією захворювання, географічним розташуванням, наявністю ускладненого перебігу захворювання (обструкція/перфорація). Також було встановлено, що об’єм лікувального закладу є важливим предиктором смертності пацієнтів унаслідок раку ободової кишки всіх стадій, за винятком IV [28].
На особливу увагу заслуговує ретроспективне дослідження М. Aubert та співавт. (2020), метою якого було порівняння результатів хірургічного лікування раку ободової кишки, ускладненого обструктивною кишковою непрохідністю (ОКН), у лікарнях з різним об’ємом. Дослідження проведене серед 1957 пацієнтів з раком ободової кишки, ускладненим ОКН, яким проведено хірургічне лікування в 56 центрах Французької національної хірургічної асоціації (French National Surgical Association) з 2005 по 2015 рік. У роботі показано, що підвищений ризик післяопераційних ускладнень та смертності пов’язаний із лікувальними закладами малого об’єму, де здійснювався перший етап хірургічної допомоги (менше ніж 28 операцій протягом року), OR = 1,8 (95% СІ = 1,3–2,4, p < 0,0001) та OR = 1,73 (95% СІ = 1,05–2,8, p = 0,03) відповідно. Однак показники загальної та безрецидивної виживаності були майже ідентичними, а отже, не корелювали з об’ємом клініки (1-, 2-, 5-річна ЗВ для малооб’ємних госпіталів — 80, 66 і 48 %, для великооб’ємних — 78, 60 та 49 %, p = 0,2; 1-, 2-, 5-річна БРВ для лікувальних закладів малого об’єму — 88, 67 та 67 %, великого — 86, 65 та 61 %, p = 0,035). Наведений факт дає змогу зробити припущення, що на прогноз захворювання при раку ободової кишки, ускладненому ОКН, не впливатиме об’єм клініки, де буде здійснено первинне хірургічне лікування, оскільки ключовим аспектом даного виду лікування є невідкладність [29].
У дослідження М. Simunovic та співавт. (2006), дизайн дослідження наведено вище, включено когорту із 8398 хворих на рак ободової кишки, які отримали хірургічне лікування в лікарнях малого (90 лікарень), середнього (47 лікарень) та великого об’єму (14 лікарень). У результаті було виявлено, що ОЛ не впливає на ризик післяопераційної летальності (OR = 1,1, 95% СІ = 0,8–1,7, p = 0,52) та віддаленої смертності хворих на рак ободової кишки (HR = 1,0, 95% СІ = 0,8–1,1, p = 0,56). Для всіх лікувальних закладів не було статистично значущих відмінностей в ризику післяопераційної або довгострокової смертності пацієнтів залежно від статусу навчального центру [13].
Результати наведених досліджень систематизовані в табл. 3.
Вплив об’єму клініки та рівня оперативного навантаження хірурга на прогноз, виживаність та частоту ускладнень при раку шийки матки
Радикальне хірургічне втручання є провідним методом у лікуванні хворих на І–ІІ стадію раку шийки матки [8, 30]. У даному розділі розглянуто питання впливу як об’єму лікувального закладу, так і рівня оперативного навантаження хірурга на показники лікування, виживаності, ризику рецидиву та ускладнень у пацієнтів, які перенесли даний вид хірургічного лікування.
E. Aviki та співавт. (2020) у своїй роботі вивчали дотримання рекомендацій з лікування та відмінності в результатах лікування хворих на ранній стадії РШМ у лікарнях з різним об’ємом хірургічного навантаження. Використовуючи National Cancer Database (США), у дослідження включено 3469 жінок з IA2–IB1стадією рака шийки матки, яким проводилось хірургічне лікування в 598 лікарнях з 2011 по 2013 рік. Об’єм лікарні визначався на основі кількості гістеректомій, проведених за 1 рік. Заклади, у яких надавалась допомога, були розділені географічно — на столичні, міські та сільські. У результаті оцінювались такі показники, як загальна виживаність, 30- та 90-денна смертність та смертність від інших причин. У результаті дослідження було встановлено, що з об’ємом закладу асоціюється раса, рік встановлення діагнозу, тип страхування, середній дохід та місце проживання, тип лікувального закладу, його розташування, спосіб гістеректомії, гістологічний тип пухлини, стадія. 30-денна смертність була нижчою в закладах великого об’єму. Частота виконання радикальної гістеректомії більша в закладах з великим об’ємом: 68,9 проти 59,6 % у закладах з малим об’ємом (p < 0,001). Тазову лімфодисекцію виконували в 96,1 % випадків у лікарнях з великим об’ємом та в 87,3 % в медичних закладах малого об’єму (p < 0,001). Також встановлено, що пацієнти в закладах великого хірургічного об’єму мають на 11,4 % більше шансів отримати лікування згідно з рекомендаціями National Comprehensive Cancer Network (NCCN) порівняно із закладами малого об’єму (67,8 проти 56,4 %; p < 0,001). Однак це ніяк не впливало на 90-денну смертність, смертність від інших причин та на загальну виживаність [31].
Дослідження J. Lin та співавт. (2014) мало на меті встановити вплив об’єму лікувального закладу на повноту надання медичної допомоги (хірургічне лікування, хіміо- та променева терапія) згідно з рекомендаціями та результати лікування хворих
на місцевопоширений РШМ. Використані відомості про 27 660 пацієнтів з National Cancer Database (США), яким проводилось лікування ІІВ–ІІІВ стадій раку шийки матки в 1361 медичному закладі з січня 1998 по грудень 2010 року. Встановлено, що хворі, які проходили лікування в закладах великого об’єму (> 9,4 пацієнта на рік), мають вищу медіану виживаності: 53,8 проти 42,3 міс. для закладів малого об’єму (p < 0,001), більшу ймовірність отримання брахітерапії (OR = 1,22, 95% СІ 1,17–1,27) та хіміотерапії (OR = 1,09, 95% СІ = 1,02–1,16), більшу ймовірність швидшого завершення променевої терапії. Виявлена також тенденція до зниження ймовірності смерті на 11,4 % серед пацієнтів, що лікувались у великих медичних центрах, порівняно із закладами малого об’єму [32].
У загальнонаціональному багатоцентровому ретроспективному дослідженні К. Matsuo та співавт. (2019) вивчали взаємозв’язок між ОЛ та виживаністю хворих на ранній РШМ. У дослідження включено 5964 пацієнтки з IB1–IIB стадіями раку шийки матки, які зазнали радикальної гістеректомії з тазовою лімфодисекцією в період з 2004 по 2008 рік. У результаті дослідження виявлено, що пацієнти, які проходили лікування в медичних закладах малого об’єму, частіше отримували неоад’ювантну хіміотерапію, а жінки, які лікувались у великооб’ємних лікарнях, рідше отримували ад’ювантну хіміотерапію. При цьому в закладах малого об’єму ад’ювантна променева терапія застосовувалась з меншою частотою. За період спостереження 5,4 року було виявлено 1162 випадки рецидиву (серед яких 654 випадки місцевого та 636 — віддаленого) та 750 випадків смерті. П’ятирічна виживаність без ознак захворювання становила 77,2; 79,9 та 84,5 % для груп хворих з малим, середнім та великим ОЛ відповідно. Встановлено, що пацієнти з IB1 та ІІВ стадіями, які лікувались у закладах великого об’єму, мають нижчу ймовірність розвитку рецидиву (особливо місцевого). Серед 25,8 % пацієнтів, які мали уражені лімфатичні вузли, імовірність розвитку місцевого рецидиву та смерті була нижчою в закладах великого об’єму порівняно з середнім та низьким. У результаті дослідження встановлено, що лікування в центрах з великим хірургічним об’ємом є основним прогностичним фактором, що знижує ймовірність виникнення рецидиву (HR 0,69, 95% СІ 0,57–0,84, P < 0,001) та смертності (HR 0,75, 95% СІ 0,59–0,95, P = 0,016) порівняно з малим та середнім ОЛ [8].
Метою дослідження J. Wright та співавт. (2011) було визначення впливу ОЛ/ОХ на частоту ускладнень та смертність хворих після радикальної гістеректомії з приводу РШМ. Автори провели дослідження серед 1536 жінок, які перенесли радикальну гістеректомію за період з 2003 по 2007 рік. У результаті був виявлений статистично вірогідний зв’язок великого оперативного навантаження хірургів із нижчим рівнем післяопераційних ускладнень (OR = 0,55; 95% СI = 0,34–0,88), меншою тривалістю перебування пацієнта в лікувальному закладі (OR = 0,49; 95% СI = 0,25–0,98) та потребою в гемотрансфузії. ОЛ при цьому не мав статистично значимої залежності [33].
У дослідженні Н. Yasunaga та співавт. (2009) вивчали вплив рівня оперативного навантаження хірурга на можливі найпоширеніші післяопераційні ускладнення (лімфедема, розлади сечовипускання та дефекації). У роботу було включено 84 лікувальні заклади, у яких було проведено хірургічне лікування раку шийки матки ІВ та ІІ стадій 407 жінкам. Хірургами малого об’єму були визнані ті, що мали кількість операцій менше ніж 20, великого — більше ніж 200. Встановлено, що хірурги, які здійснювали більше ніж 200 гістеректомій з приводу РШМ, мали меншу частоту післяопераційних ускладнень, особливо тих, які пов’язані з розладами сечовипускання (OR = 0,45, 95% СІ = 0,21–0,96). Зв’язку між об’ємом лікувального закладу та можливими ускладненнями не було виявлено. Окрім наведених результатів, було зроблено припущення, що хірурги великого об’єму частіше будуть виконувати нервозберігаючі операції при радикальній гістеректомії, що в подальшому супроводжуватиметься меншою кількістю ускладнень [30]. Результати наведених досліджень систематизовані в табл. 4.
/70.jpg)
Обговорення
Хірургічне втручання, безумовно, є ключовим етапом лікування онкологічних хворих. Стратегія розширення мережі лікувальних закладів або ж регіоналізації є спірним моментом, оскільки дослідження вказують на корелятивний зв’язок лікарень з великим об’ємом із кращими результатами лікування. Публікації, що були розглянуті в даному огляді, майже однозначно підтверджують цю кореляцію у випадках 4 описаних локалізацій злоякісних новоутворень. Більшість досліджень були великокогортними, скорегованими за соціально-економічними показниками пацієнта та виконані у ретроспективному дизайні, групи пацієнтів були сформовані на основі відомостей з локальних канцер-реєстрів про онкологічних хворих. Значною перевагою цих досліджень є саме нівелювання впливу на показники, що вивчалися (навантаження хірурга та об’єм лікувального закладу), соціально-демографічних характеристик пацієнта, оскільки деякі з них (географічне положення, економічний стан, вік) доказово впливають на смертність. Недостатнє врахування цих факторів спотворює результати оцінки впливу об’єму лікувального закладу на результати лікування [14].
За результатами даного огляду літератури можна дійти висновків, що медичні заклади великого хірургічного об’єму частіше керуються клінічними рекомендаціями та здійснюють міждисциплінарний підхід до лікування хворих на злоякісні новоутворення. Неоад’ювантна та ад’ювантна терапія мають вищі шанси на своєчасне застосування у пацієнтів великооб’ємних лікарень.
Стосовно рівня оперативного навантаження хірурга результати досліджень є неоднозначними. Частина з них вказує на зв’язок кількості виконуваних хірургом операцій на рік із кращими ранніми та віддаленими результатами лікування, що пов’язано з кращою оперативною технікою [30]. За даними Liu та співавт., кращі результати виживаності при оперативному втручанні з приводу КРР пов’язані із вищим оперативним рівнем хірурга. Інші автори стверджують, що ключову роль відіграє саме об’єм медичного закладу, а не навантаження хірурга [25]. Водночас існує думка, що високий рівень оперативного навантаження лікаря найчастіше пов’язаний із роботою у клініках з великим об’ємом, а отже, ці показники є тотожними [14].
Чи можна вважати об’єм лікувального закладу індикатором надання якісної онкологічної допомоги? Позитивна відповідь на це питання аргументовано описана в результатах робіт. Єдиним аспектом, який вартий корегування, є вибір когорт з урахуванням клініко-морфологічних факторів прогнозу перебігу захворювання (створення рівнозначних груп пацієнтів за стадією, розміром пухлини, гістологічним/імуногістохімічним типом тощо) та проведення дослідження в режимі реального часу.
Результати огляду є підґрунтям для перегляду концепції професійної підготовки хірурга, вимог до професійного ліцензування, безперервного післядипломного навчання та створення великооб’ємних кваліфікаційних освітніх центрів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 05.10.2021
Рецензовано/Revised 20.10.2021
Прийнято до друку/Accepted 01.11.2021

/63.jpg)
/64.jpg)
/66.jpg)
/68.jpg)
/70.jpg)