Международный эндокринологический журнал Том 18, №1, 2022
Вернуться к номеру
Цукровий діабет і хронічна серцева недостатність
Авторы: Сергієнко В.О., Сергієнко О.О.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Хронічна серцева недостатність (ХСН) є завершальною стадією захворювань серцево-судинної системи і однією з основних причин смертності від серцево-судинних захворювань. ХСН розвивається у пацієнтів із хронічним коронарним синдромом, артеріальною гіпертензією, міокардитами, ендокардитами, перикардитами й іншими захворюваннями. Поширеність ХСН останніми роками невпинно зростає і становить близько 2 % дорослого населення. До числа чинників, що погіршують прогноз ХСН, відноситься цукровий діабет (ЦД). ЦД 2-го типу — незалежний чинник ризику розвитку серцевої недостатності (СН), а рівень глюкози плазми натщесерце і підвищення вмісту глікованого гемоглобіну А1с значуще пов’язані зі збільшенням небезпеки розвитку СН. В огляді проведений аналіз літературних джерел, присвячених сучасному стану проблеми ЦД і ХСН. Зокрема, аналізуються питання, пов’язані з особливостями пошкодження міокарда при ЦД 2-го типу, ЦД як чинником ризику СН, субклінічними порушеннями міокарда у пацієнтів із ЦД, СН як чинником ризику ЦД; патофізіологічними особливостями ЦД і СН; класифікацією ХСН (згідно the New York Heart Association, the American College of Cardiology Foundation/the American Heart Association, the European Society of Cardiology); діагностикою ХСН із збереженою, зниженою та середнім рівнем фракції викиду лівого шлуночка; принципи патогенетичної терапії СН при ЦД, зокрема призначення лікарських препаратів, що впливають на ренін-ангіотензин-альдостеронову систему (інгібіторів ангіотензинперетворювального ферменту, блокаторів рецепторів ангіотензину II); сакубітрилу/валсартану; блокаторів бета-адренергічних рецепторів, антагоністів мінералокортикоїдних рецепторів, інгібіторів синусового вузла, інгібіторів натрій-глюкозного котранспортеру 2-го типу, діуретичних препаратів. Лікування пацієнта з ЦД і СН буде успішним лише в тому випадку, якщо призначено адекватну і безпечну цукрознижувальну терапію, з одного боку, і метаболічно нейтральну фармакологічну терапію — з іншого.
Congestive heart failure (CHF) is the final stage of cardiovascular disease and one of the leading causes of death. CHF develops in patients with the chronic coronary syndrome, hypertension, myocarditis, endocarditis, pericarditis, and other diseases. The prevalence of CHF in recent years is growing steadily and is about 2 % in the adult population. Among the factors that worsen the prognosis of CHF is diabetes mellitus (DM). Type 2 DM is an independent risk factor for heart failure (HF), and fasting plasma glucose and increased glycated hemoglobin A1c are significantly associated with an increased risk of HF. This review article summarizes the existing literature on the current state of the problem of DM and CHF. In particular, there are considered the issues related to the features of myocardial damage in type 2 DM, DM as a risk factor for HF, subclinical myocardial disorders in diabetic patients, HF as a risk factor for DM; pathophysiological features of DM and HF; classification of CHF (according to the New York Heart Association, the American College of Cardiology Foundation/American Heart Association, the European Society of Cardiology); diagnosis of CHF with preserved, reduced and mildly reduced left ventricular ejection fraction; principles of pathogenetic therapy of HF in DM, in particular, the appointment of drugs that affect the renin-angiotensin-aldosterone system (angiotensin-converting enzyme inhibitors, angiotensin II receptor blockers); sacubitril/valsartan; beta-adrenergic receptor blockers, mineralocorticoid receptor antagonists, sinus node inhibitors, sodium-glucose cotransporter type 2 inhibitors, diuretics. Treatment of a patient with DM and HF will be successful only if adequate and safe antidiabetic therapy is prescribed, on the one hand, and metabolically neutral pharmacological therapy, on the other.
цукровий діабет; хронічна серцева недостатність; огляд
diabetes mellitus; congestive heart failure; review
Особливості пошкодження міокарда при цукровому діабеті 2-го типу
Цукровий діабет як чинник ризику серцевої недостатності
Субклінічні порушення міокарда у пацієнтів із цукровим діабетом
Серцева недостатність як чинник ризику цукрового діабету
Патофізіологічні особливості цукрового діабету і серцевої недостатності
Класифікація хронічної серцевої недостатності
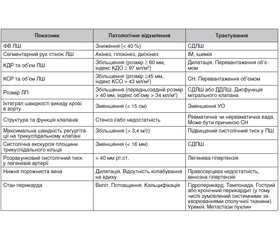
Діагностика
Принципи патогенетичної терапії серцевої недостатності при цукровому діабеті
Препарати, що впливають на РААС Інгібітори АПФ
- Lawson C.A., Jones P.W., Teece L., Dunbar S.B., Seferovic P.M., Khunti K., Mamas M. et al. Association between type 2 diabetes and all-cause hospitalization and mortality in the UK general heart failure population: stratification by diabetic glycemic control and medication intensification. JACC Heart Fail. 2018. 6(1). 18-26. doi: 10.1016/j.jchf. 2017.08.020.
- Dei Cas A., Khan S.S., Butler J., Mentz R.J., Bonow R.O., Avogaro A., Tschoepe D. et al. Impact of diabetes on epidemiology, treatment, and outcomes of patients with heart failure. JACC Heart Fail. 2015. 3(2). 136-45. doi: 10.1016/j.jchf.2014.08.004.
- Kristensen S.L, Preiss D., Jhund P.S., Squire I., Cardoso J.S., Merkely B., Martinez F. et al. Risk related to pre-diabetes mellitus and diabetes mellitus in heart failure with reduced ejection fraction: Insights from prospective comparison of ARNI with ACEI to determine impact on global mortality and morbidity in Heart Failure Trial. Circ. Heart Fail. 2016. 9(1). e002560. doi: 10.1161/CIRCHEARTFAILURE.115.002560.
- Serhiyenko V.A., Serhiyenko A.A. Diabetic cardiomyopathy: epidemiology, etiology and pathogenesis. Int. J. Endocrinol. (Ukraine). 2020. 16(4). 337-48. doi: 10.22141/2224-0721.16.4.2020.208488. (In Ukrainian).
- Koval S.M., Yushko K.O., Snihurska I.O., Starchenko T.G., Pankiv V.I., Lytvynova O.M., Mysnychenko O.V. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension (Poland). 2019. 23(3). 183-189. DOI: 10.5603/AH.a2019.0012.
- Dunlay S.M., Givertz M.M., Aguilar D., Allen L.A., Chan M., Desai A.S., Deswal A. et al. Type 2 Diabetes Mellitus and Heart Failure: A Scientific Statement From the American Heart Association and the Heart Failure Society of America. Circulation. 2019. 140(7). e294-324. doi: 10.1161/CIR.0000000000000691.
- Shah A.D., Langenberg C., Rapsomaniki E., Denaxas S., Pujades-Rodriguez M., Gale C.P., Deanfield J. et al. Type 2 diabetes and incidence of cardiovascular diseases: a cohort study in 1.9 million people. Lancet Diabetes Endocrinol. 2015. 3(2). 105-13. doi: 10.1016/S2213-8587(14)70219-0.
- Kobalava Zh.D., Medovchshikov V.V., Yeshniyazov N.B., Khasanova E.R. The modern paradigm of pathophysiology, prevention and treatment of heart failure in type 2 diabetes mellitus. Russ. J. Cardiol. 2019. 24(11). 98-111. doi: 10.15829/1560-4071-2019-11-98-111. (In Russian).
- Mardanov B.U., Korneeva M.N., Akhmedova E.B. Heart failure and diabetes mellitus: selected issues of etiology and pathogenesis, prognosis and treatment. Rational Pharmacotherapy in Cardiology. 2016. 12(6). 743-8. doi: 10.20996/1819-6446-2016-12-6-743-748. (In Russian).
- Levelt E., Mahmod M., Piechnik S.K., Ariga R., Francis J.M., Rodgers C.T., Clarke W.T. et al. Relationship between left ventricular structural and metabolic remodeling in type 2 diabetes. Diabetes. 2016. 65(1). 44-52. doi: 10.2337/db15-0627.
- Levelt E., Rodgers C.T., Clarke W.T., Mahmod M., Ariga R., Francis J.M., Liu A. et al. Cardiac energetics, oxygenation, and perfusion during increased workload in patients with type 2 diabetes mellitus. Eur. Heart J. 2016. 37(46). 3461-9. doi: 10.1093/eurheartj/ehv442.
- Obrezan A.G., Kulikov N.V. Chronic heart failure and diabetes mellitus: pathogenesis and possibilities of treatment. Kardiologiia. 2018. 58(7). 85-94. doi: 10.18087/cardio.2018.7.10156. (In Russian).
- Montaigne D., Marechal X., Coisne A. et al. Myocardial contractile dysfunction is associated with impaired mitochondrial function and dynamics in type 2 diabetic but not in obese patients. Circulation. 2014. 130(7). 554-64. doi: 10.1161/CIRCULATIONAHA. 113.008476.
- Boonman-de Winter L.J.M., Rutten F.H., Cramer M.J., Landman M.J., Zuithoff N.P., Liem A.H., Hoes A.W. Efficiently screening heart failure in patients with type 2 diabetes. Eur. J. Heart Fail. 2015. 17(2). 187-95. doi: 10.1002/ejhf.216.
- Zoppini G., Bergamini C., Bonapace S., Rossi A., Trombetta M., Mantovani A., Toffalini A. et al. Association between subclinical left ventricular systolic dysfunction and glycemic control in asymptomatic type 2 diabetic patients with preserved left ventricular function. J. Diabetes Complications. 2017. 31(6). 1035-40. doi: 10.1016/j.jdiacomp.2017.01.021.
- Selvin E., Lazo M., Chen Y., Shen L., Rubin J., McEvoy J.W., Hoogeveen R.C. et al. Diabetes mellitus, prediabetes, and incidence of subclinical myocardial damage. Circulation. 2014. 130(16). 1374-82. doi: 10.1161/CIRCULATIONAHA.114.010815.
- Scirica B.M., Braunwald E., Raz I., Cavender M.A., Morrow D.A., Jarolim P., Udell J.A. et al.; for the SAVOR-TIMI 53 Steering Committee and Investigators. Heart failure, saxagliptin, and diabetes mellitus: observations from the SAVOR-TIMI 53 randomized trial. Circulation. 2014. 130(18). 1579-88. doi: 10.1161/CIRCULATIONAHA.114.010389.
- Swoboda P.P., McDiarmid A.K., Erhayiem B., Ripley D.P., Dobson L.E., Garg P., Musa T.A. et al. Diabetes mellitus, microalbuminuria, and subclinical cardiac disease: identification and monitoring of individuals at risk of heart failure. J. Am. Heart Assoc. 2017. 6(7). e005539. doi: 10.1161/JAHA.117.005539.
- Paolillo S., Rengo G., Pellegrino T. et al. Insulin resistance is associated with impaired cardiac sympathetic innervation in patients with heart failure. Eur. Heart J. Cardiovasc. Imaging. 2015. 16(10). 1148-53. doi: 10.1093/ehjci/jev061.
- Campbell P., Krim S., Ventura H. The bi-directional impact of two chronic illnesses: heart failure and diabetes — A review of the epidemiology and outcomes. Card. Fail. Rev. 2015. 1(1). 8-10. doi: 10.15420/cfr. 2015.01.01.8.
- Preiss D., van Veldhuisen D.J., Sattar N., Krum H., Swedberg K., Shi H., Vincent J. et al. Eplerenone and new-onset diabetes in patients with mild heart failure: Results from the Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure (EMPHASIS-HF). Eur. J. Heart Fail. 2012. 14(8). 909-15. doi: 10.1093/eurjhf/hfs067.
- Marwick T.H., Ritchie R., Shaw J.E., Kaye D. Implications of underlying mechanisms for the recognition and management of diabetic cardiomyopathy. J. Am. Coll. Cardiol. 2018. 71(3). 339-51. doi: 10.1016/j.jacc.2017.11.019.
- Karavaev P.G., Veklich A.S., Koziolova N.A. Cardiovascular remodeling in patients with diabetic сardiomyopathy. Russ. J. Cardiol. 2019. 24(11). 42-7. doi: 10.15829/1560-4071-2019-11-42-47. (In Russian).
- Serhiyenko V.A., Serhiyenko A.A. Diabetic cardiomyopathy: classification, instrumental diagnostic methods. Int. J. Endocrinol. (Ukraine). 2020. 16(7). 104-14. doi: 10.22141/2224-0721.16.7.2020.219012. (In Ukrainian).
- Bonapace S., Valbusa F., Bertolini L., Zenari L., Canali G., Molon G., Lanzoni L. et al. Early impairment in left ventricular longitudinal systolic function is associated with an increased risk of incident atrial fibrillation in patients with type 2 diabetes. J. Diabetes Complications. 2017. 31(2). 413-8. doi: 10.1016/j.jdiacomp. 2016.10.032.
- Waddingham M.T., Edgley A.J., Tsuchimochi H., Kelly D.J., Shirai M., Pearson J.T. Contractile apparatus dysfunction early in the pathophysiology of diabetic cardiomyopathy. World J. Diabetes. 2015. 6(7). 943-60. doi: 10.4239/wjd.v6.i7.943.
- MacRae C.A. The genetics of congestive heart failure. Heart Fail. Clin. 2010. 6(2). 223-30. doi: 10.1016/j.hfc.2009.11.004.
- Yancy C.W., Jessup M., Bozkurt B., Butler J., Casey D.E. Jr., Drazner M.H., Fonarow G.C. et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J. Am. Coll. Cardiol. 2013. 62(16). e147-239. doi: 10.1016/j.jacc.2013.05.019.
- Ponikowski P., Voors A.A., Anker S.D., Bueno H., Cleland J.G.F., Coats A.J.S., Falk V. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2016. 37(27). 2129-200. doi: 10.1093/eurheartj/ehw128.
- Fillmore N., Mori J., Lopaschuk G.D. Mitochondrial fatty acid oxidation alterations in heart failure, ischaemic heart disease and diabetic cardiomyopathy. Br. J. Pharmacol. 2014. 171(8). 2080-90. doi: 10.1111/bph.12475.
- Obokata M., Reddy Y.N.V., Pislaru S.V., Melenovsky V., Borlaug B.A. Evidence supporting the existence of a distinct obese phenotype of heart failure with preserved ejection fraction. Circulation. 2017. 136(1). 6-19. doi: 10.1161/CIRCULATIONAHA.116.026807.
- Riehle C., Abel E.D. Insulin signaling and heart failure. Circ. Res. 2016. 118(7). 1151-69. doi: 10.1161/–CIRCRESAHA.116.306206.
- Zoroufian A., Razmi T., Taghavi-Shavazi M., Lotfi-Tokaldany M., Jalali A. Evaluation of subclinical left ventricular dysfunction in diabetic patients: longitudinal strain velocities and left ventricular dyssynchrony by two-dimensional speckle tracking echocardiography study. Echocardiogr. 2014. 31(4). 456-63. doi: 10.1111/echo.12389.
- Leung M., Wong V.W., Hudson M., Leung D.Y. Impact of improved glycemic control on cardiac function in type 2 diabetes mellitus. Circ. Cardiovasc. Imaging. 2016. 9(3). e003643. doi: 10.1161/CIRCIMAGING.115.003643.
- Seferovic J.P., Claggett B., Seidelmann S.B., Seely E.W., Packer M., Zile M.R., Rouleau J.L. et al. Effect of sacubitril/valsartan versus enalapril on glycaemic control in patients with heart failure and diabetes: a post-hoc analysis from the PARADIGM-HF trial. Lancet Diabetes Endocrinol. 2017. 5(5). 333-40. doi: 10.1016/S2213-8587(17)30087-6.
- Ofstad A.P., Atar D., Gullestad L., Langslet G, Johansen OE. The heart failure burden of type 2 diabetes mellitus a review of pathophysiology and interventions. Heart Fail. Rev. 2018. 23(3). 303-23. doi: 10.1007/s10741-018-9685-0.
- Komamura K. Similarities and differences between the pathogenesis and pathophysiology of diastolic and systolic heart failure. Cardiol. Res. Pract. 2013. 2013. 824135. doi: 10.1155/2013/824135.
- 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2016. 37(27). 2129-200. doi: 10.1093/eurheartj/ehw128.
- Skybchyk V.A. Chronic heart failure: new approaches to diagnosis and treatment. Liki Ukr. 2016. 10(206). 33-42. Available at: https://www.health-medix.com › liki_ukr › 4.pdf. Accessed 05/15/2021. (In Ukrainian).
- Oudejans I., Mosterd A., Bloemen J.A., Valk M.J., van Velzen E., Wielders J.P., Zuithoff N.P. et al. Clinical evaluation of geriatric outpatients with suspected heart failure: value of symptoms, signs, and additional tests. Eur. J. Heart Fail. 2011. 13(95). 518-27. doi: 10.1093/eurjhf/hfr021.
- van Riet E.E.S., Hoes A.W., Limburg A., Limburg A., Landman M.A., van der Hoeven H., Rutten F.H. Prevalence of unrecognized heart failure in older persons with shortness of breath on exertion. Eur. J. Heart Fail. 2014. 16(7). 772-7. doi: 10.1002/ejhf.110.
- Wong C.M., Hawkins N.M., Petrie M.C., Jhund P.S., Gardner R.S., Ariti C.A., Poppe K.K. et al. Heart failure in younger patients: the Meta-analysis Global Group in Chronic Heart Failure (MAGGIC). Eur. Heart J. 2014. 35(39). 2714-21. doi: 10.1093/eurheartj/ehu216.
- Heart failure and comorbid conditions. Recommendations of the Association of Cardiologists of Ukraine for the diagnosis and treatment of chronic heart failure. Heart failure and comorbid conditions. 2017. Special issue (Appx 1). 1-66. Available at: https://strazhesko.org.ua › upload › ch_rekomend... Accessed 05/15/2021. (In Ukrainian).
- Chronic heart failure. Clinical practice guidelines. Russian Society of Cardiology, National Society for the Study of Heart Failure and Myocardial Diseases, Society of Heart Failure Specialists. Irkutsk, 2020; 183 p. Available in: https://webmed.irkutsk.ru/doc/pdf/fedhf.pdf. Accessed 05/15/2021. (In Russian).
- Berliner D., Hanselmann A., Bauersachs J. The treatment of heart failure with reduced ejection fraction. Dtsch. Arztebl. Int. 2020. 117(21). 376-86. doi: 10.3238/arztebl.2020.0376.
- Strauss M.H., Hall A.S. The divergent cardiovascular effects of angiotensin-converting enzyme inhibitors and angiotensin II type 1 receptor blockers in adult patients with type 2 diabetes mellitus. Can. J. Diabetes. 2018. 42(2). 124-9. doi: 10.1016/j.jcjd.2017.09.011.
- Lam P.H., Dooley D.J., Fonarow G.C., Butler J., Bhatt D.L., Filippatos G.S., Deedwania P. et al. Similar clinical benefits from below-target and target dose enalapril in patients with heart failure in the SOLVD Treatment trial. Eur. J. Heart Fail. 2018. 20(2). 359-69. doi: 10.1002/ejhf.937.
- Cheng J., Zhang W., Zhang X., Han F., Li X., He X., Li Q. et al. Effect of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers on all-cause mortality, cardiovascular deaths, and cardiovascular events in patients with diabetes mellitus: a meta-analysis. JAMA Intern. Med. 2014. 174(5). 773-85. doi: 10.1001/jamainternmed.2014.348.
- Seferovic P.M., Ponikowski P., Anker S.D., Bauersachs J., Chioncel O., Cleland J.G.F., de Boer R.A. et al. Clinical practice update on heart failure 2019: pharmacotherapy, procedures, devices and patient management. An expert consensus meeting report of the Heart Failure Association of the European Society of Cardiology. Eur. J. Heart Fail. 2019. 21(10). 1169-86. doi: 10.1002/ejhf.1531.
- McMurray J.J., Packer M., Desai A.S., Gong J., Lefkowitz M.P., Rizkala A.R., Rouleau J.L. et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N. Engl. J. Med. 2014. 371(11). 993-1004. doi: 10.1056/NEJMoa1409077.
- Packer M., Anker S.D., Butler J., Filippatos G., Ferreira J.P., Pocock S.J., Rocca H.B. et al.; for the EMPEROR-Reduced Trial Committees and Investigators. Influence of neprilysin inhibition on the efficacy and safety of empagliflozin in patients with chronic heart failure and a reduced ejection fraction: the EMPEROR-Reduced Trial. Eur. Heart. J. 2021. 42(6). 671-80. doi: 10.1093/eurheartj/ehaa968.
- Diabetes Canada Clinical Practice Guidelines Expert Committee. Treatment of diabetes in people with Heart failure. Can. J. Diabetes. 2018. 42(Suppl. 1). S196-200. doi: 10.1016/j.jcjd.2017.10.026.
- Torp-Pedersen C., Metra M., Charlesworth A., Spark P., Lukas M.A., Poole-Wilson P.A., Swedberg K. et al. Effects of metoprolol and carvedilol on pre-existing and new onset diabetes in patients with chronic heart failure: data from the Carvedilol or Metoprolol European Trial (COMET). Heart. 2007. 93(8). 968-73. doi: 10.1136/hrt.2006.092379.
- Casiglia E., Tikhonoff V. Long-standing problem of β-blocker-elicited hypoglycemia in diabetes mellitus. Hypertension. 2017. 70(1). 42-3. doi: 10.1161/HYPERTENSIONAHA.117.09378.
- Dungan K., Merrill J., Long C., Binkley P. Effect of beta blocker use and type on hypoglycemia risk among hospitalized insulin requiring patients. Cardiovasc. Diabetol. 2019. 18(1). 163. doi: 10.1186/s12933-019-0967-1.
- Kosmas C.E., Silverio D., Sourlas A., Montan P.D., Guzman E. Role of spironolactone in the treatment of heart failure with preserved ejection fraction. Ann. Transl. Med. 2018. 6(23). 461. doi: 10.21037/atm.2018.11.16.
- Zannad F., McMurray J.J., Krum H., van Veldhuisen D.J., Swedberg K., Shi H., Vincent J. et al. Eplerenone in patients with systolic heart failure and mild symptoms. N. Engl. J. Med. 2011. 364(1). 11-21. doi: 10.1056/NEJMoa1009492.
- Pitt B., Anker S.D., Bohm M. Rationale and design of mineralocorticoid receptor antagonist tolerability Study-Heart Failure (ARTS-HF): a randomized study of finerenone vs eplerenone in patients who have worsening chronic heart failure with diabetes and/or chronic kidney disease. Eur. J. Heart Fail. 2015. 17(2). 224-32. doi: 10.1002/ejhf.218.
- Paneni F. Empagliflozin across the stages of diabetic heart disease. Eur. Heart J. 2018. 39(5). 371-3. doi: 10.1093/eurheartj/ehx519.
- van Melle J.P., Bot M., de Jonge P., de Boer R.A., van Veldhuisen D.J., Whooley M.A. Diabetes, glycemic control, and new-onset heart failure in patients with stable coronary artery disease: data from the Heart and Soul Study. Diabetes Care. 2010. 33(9). 2084-9. doi: 10.2337/dc10-0286.

/67.jpg)
/68.jpg)
/69.jpg)