Резюме
Актуальність. Результати більшості наукових досліджень останніх років дали змогу з нових позицій переглянути традиційні уявлення про патогенез хронічного гастродуоденіту (ХГД). Мета: дослідити клініко-ендоскопічні особливості перебігу ХГД, асоційованого з Helicobacter pylori (H.pylori), в поєднанні з лямбліозом. Матеріали та методи. Під спостереженням перебували 105 дітей віком 7–16 років, розподілені на дві групи: I — діти, хворі на ХГД, асоційований із H.рylori (n = 29), II — діти, хворі на ХГД, асоційований із H.pylori, в поєднанні з лямбліозом (n = 76). Дослідження проводилося на базі гастроентерологічного відділення обласного комунального некомерційного підприємства «Чернівецька обласна клінічна лікарня» впродовж 2020–2021 рр. та включало езофагогастродуоденофіброскопію, ультразвукове дослідження органів черевної порожнини, швидкий уреазний тест, визначення специфічних імуноглобулінів класів М, А та G до антигену CagA H.pylori у сироватці крові, антигену CagA H.pylori в калі, дослідження калу на антиген Giardia lamblia (G.lamblia) методом полімеразної ланцюгової реакції. Результати. Максимальна інфікованість G.lamblia спостерігалась у дітей віком 9–13 років (17 осіб із 29 позитивних). Кількість дітей із G.lamblia підвищувалась у віці між 7–9 та 10–12 роками (р < 0,05, χ2 = 5,236, z = 1,899) та знижувалась у віці 13–16 років (р < 0,05, χ2 = 7,144, z = 2,567). Діти з лямбліозом пред’являли скарги на дратівливість (р < 0,05), головний біль, запаморочення, неспокійний сон, біль у серці, а також у них частіше виявлялися ознаки інтоксикаційного та шкірного синдромів. У дітей групи I найчастіше діагностувався гастрит тіла (р < 0,05), антрума (р < 0,05) або пангастрит (р < 0,05) з вогнищевою гіперплазією (р < 0,05), а у дітей групи II — переважно гастрит з локалізацією в антральному відділі, а також виражений дуоденіт (р < 0,05). Характерною ендоскопічною ознакою в дітей групи II був фолікулярний дуоденіт. Запальний процес у групі II вірогідно частіше (р < 0,05) мав виражений (81,5 %) та активний (77,6 %) характер, і відзначались еозинофільна інфільтрація (51,3 %), мікроерозії та осередки гіперплазії лімфоїдної тканини (6,5 %). Висновки. Клінічний перебіг ХГД, асоційованого з Н.pylori, в поєднанні з G.lamblia, характеризується більш вираженими диспептичними симптомами з ознаками інтоксикаційного та шкірного синдромів. За результатами ендоскопічного дослідження, при ХГД, асоційованому з інфекцією Н.pylоri, вірогідно частіше (р < 0,05) діагностувалися езофагіт, гастрит тіла, антрума та пангастрит. У дітей з інвазією G.lamblia відзначався виражений фолікулярний дуоденіт (р < 0,05).
Background. The results of most scientific studies in recent years have made it possible to reconsider the traditional ideas about the pathogenesis of chronic gastroduodenitis (CGD) from a new perspective. The purpose was to investigate the clinical and endoscopic features of СGD associated with Helicobacter pylori (H.pylori) in combination with giardiasis. Materials and methods. The study included 105 children aged 7–16 years divided into two groups: I — patients with СGD associated with H.pylori (n = 29), II — children with СGD associated with H.pylori in combination with giardiasis (n = 76). The study was conducted on the basis of the gastroenterology department of the Chernivtsi Regional Clinical Hospital during 2020–2021 and included esophagogastroduodenofibroscopy, ultrasound examination of the abdominal cavity, rapid urease test, determination of specific M, A and G immunoglobulins to H.pylori CagA antigen in the blood serum and in feces, fecal examination for Giardia lamblia (G.lamblia) antigen by polymerase chain reaction. Results. The most severe infection of G.lamblia occurred in children aged 9–13 years (17 people out of 29 positive). The number of children with G.lamblia increased between the ages of 7–9 and 10–12 years (p < 0.05, χ2 = 5.236, z = 1.899) and decreased in the age of 13–16 years (p < 0.05, χ2 = 7.144, z = 2.567). Patients with giardiasis complained of irritability (p < 0.05), headache, dizziness, restless sleep, heart pain, and they were more likely to show signs of intoxication and skin syndromes. Children of group I were most often diagnosed with corpus gastritis (p < 0.05), antral gastritis (p < 0.05) or pangastritis (p < 0.05) with focal hyperplasia (p < 0.05), and children of group II — with mainly antral gastritis, as well as severe duodenitis (p < 0.05). A characteristic endoscopic feature in children of group II was follicular duodenitis. Inflammatory process in group II significantly more often (p < 0.05) was severe (81.5 %) and active (77.6 %) and was associated with eosinophilic infiltration (51.3 %), microerosions and foci of lymphoid tissue hyperplasia (6.5 %). Conclusions. The clinical course of СGD associated with H.pylori in combination with G.lamblia is characterized by more pronounced dyspeptic symptoms with signs of intoxication and skin syndromes. According to the results of endoscopic examination, patients suffered from СGD associated with H.pylori infection had esophagitis, corpus gastritis, antral gastritis and pangastritis (p < 0.05) significantly more often. Children with G.lamblia invasion had severe follicular duodenitis (p < 0.05).
Вступ
На сьогодні спостерігається невпинне зростання частоти виявлення хронічного гастродуоденіту (ХГД) у дітей всіх вікових груп (110–126 випадків на 1000 дитячого населення), особливо в підлітків (140–150 випадків на 1000 дитячого населення) [1]. Різноманітні форми ХГД об’єднані в одну нозологічну одиницю, однак дана патологія є поліетіологічною [2–4]. Результати більшості наукових досліджень останніх років дали змогу з нових позицій переглянути традиційні уявлення про патогенез ХГД. Найбільш важливим етіологічним фактором на сьогодні вважається Helicobacter pylori (H.pylori) [5]. Визнання зв’язку між ХГД і наявністю H.pylori дало можливість поглибити знання щодо цієї проблеми [6, 7]. Встановлено, що потрапляння H.pylori до шлунка раніше не інфікованих дітей призводить до розвитку гострого запального процесу з подальшою його трансформацією у хронічний. При цьому патогенні властивості H.pylori посилюються додатковими екзо- і ендогенними факторами, які беруть участь у формуванні та рецидивуванні ХГД [8]. Не менш значущою причиною гастродуоденального запалення може бути паразитарна інвазія, насамперед лямбліоз [9]. Лямбліоз є актуальною проблемою як у дітей, так і в дорослих. Сприйнятливість дітей до лямблій зумовлена високою інтенсивністю пристінкового травлення, що є важливою умовою паразитування найпростіших, відсутністю навичок особистої та суспільної гігієни, а також переважанням у раціоні дітей вуглеводів. В останні роки накопичуються дані, що дозволяють віднести лямбліоносійство до патологічних процесів, оскільки при хронічних захворюваннях травного тракту інвазія реєструється у 65–72 % випадків, що дозволяє говорити про персистуючий, хронічний лямбліоз [10–12].
Мета: дослідити клініко-ендоскопічні особливості перебігу ХГД, асоційованого з H.pylori, в поєднанні з лямбліозом.
Матеріали та методи
Під спостереженням перебували 105 дітей віком 7–16 років із верифікованим діагнозом ХГД відповідно до протоколу згідно з наказом МОЗ України № 53. Залежно від наявності лямбліозу діти були розподілені на дві групи: I — діти, хворі на ХГД, асоційований із H.рylori (n = 29), II — діти, хворі на ХГД, асоційований із H.pylori, в поєднанні з лямбліозом (n = 76). Дослідження проводилося на базі гастроентерологічного відділення обласного комунального некомерційного підприємства «Чернівецька обласна клінічна лікарня» впродовж 2020–2021 рр. з урахуванням основних положень GCР (1996 р.), Гельсінської декларації Всесвітньої медичної асоціації про етичні принципи проведення наукових медичних досліджень та підписання інформованої згоди. Дітям, які знаходились під спостереженням, проводили ретельне параклінічне дослідження за загальноприйнятими в клініці методиками: загальний аналіз крові, біохімічні показники крові, аналіз крові на глюкозу, загальний аналіз сечі, аналіз калу на наявність яєць гельмінтів, копрограма. Інструментальні методи діагностики включали езофагогастродуоденофіброскопію (трактування змін слизової оболонки (СО) відповідно до Сіднейської системи (1990), виявлення ендоскопічних ознак інфікування H.pylori та проведення щипкової біопсії СО шлунка та дванадцятипалої кишки (ДПК) для визначення варіанта й активності запального процесу, мікроскопії H.pylori) за допомогою відеоендоскопічної стійки «OLYMPUS EVIS EXERA II –CV-165» та відеогастроскопа «GIF-Q165», топографічну інтрагастральну рН-метрію (для визначення кислотності шлункового соку за методикою, розробленою Чорнобровим В.М. (1990 р.), за допомогою рН-метра «РН-150М»), ультразвукове дослідження органів черевної порожнини з використанням апарата «Aloka SSD-1400». Інфікування H.pylori підтверджували за допомогою швидкого уреазного тесту з використанням набору реактивів фірми «Farmasco» (Швеція); визначення специфічних імуноглобулінів класів М, А та G до антигену CagA H.pylori у сироватці крові — за загальноприйнятою методикою з використанням діагностичної тест-системи «ХелікоБест-антитіла» (серія D-3752) та набору реактивів фірми «Вектор-Бест» (м. Новосибірськ, Російська Федерація); методом імуноферментного аналізу виявляли антиген CagA H.pylori в калі. Дослідження калу на антиген Giardia lamblia (G.lamblia) проводили методом полімеразної ланцюгової реакції.
Результати дослідження представлені кількістю спостережень у групі, відсотками або середнім і середньоквадратичним відхиленням, точним значенням р. Аналіз якісних ознак проводили за критерієм χ2, за частот менше 5 застосовували точний тест Фішера.
Результати та обговорення
Діти були розподілені на підгрупи залежно від віку (рис. 1).
В анамнезі хворих на ХГД, асоційований із H. pylori, в поєднанні з лямбліозом, відзначалися дисбактеріоз кишечника на першому році життя (14,2 %), паразитарна інвазія (11,4 %) та харчова токсикоінфекція (8,5 %). У дітей з ізольованою інфекцією Н.pylori таких захворювань в анамнезі виявлено не було.
Такі форми лямбліозної інвазії, як безсимптомна, субклінічна (виділення лямблій без клінічних проявів) та гостра (первинна інфекція з діареєю), в обстежених дітей не відзначалися.
Максимальна інфікованість G.lamblia відмічалась у дітей 9–13 років (17 осіб із 29 позитивних). Варто відзначити, що кількість дітей із G.lamblia підвищувалась у віці між 7–9 та 10–12 роками (р < 0,05, χ2 = 5,236, z = 1,899) та знижувалась у віці 13–16 років (р < 0,05, χ2 = 7,144, z = 2,567).
При аналізі клінічних ознак, які потенційно вказують на наявність лямблій в організмі дитини, було встановлено, що діти з лямбліозом пред’являли скарги з боку нервової системи на дратівливість (р < 0,05), головний біль, запаморочення, неспокійний сон, а також на біль у серці (табл. 1). Біль у дітей II групи найчастіше був нападоподібний, не пов’язаний із прийомом їжі та локалізувався в навколопупковій (77,6 %) та епігастральній ділянках (14,5 %), а також у 7,9 % відзначалась поєднана локалізація. За тривалістю та інтенсивністю больового синдрому відмінностей не встановлено.
У групі дітей із ХГД в поєднанні з лямбліозом частіше виявлялися ознаки інтоксикаційного синдрому (рис. 2).
При аналізі даних лабораторних методів дослідження в загальному аналізі крові у групі з лямбліозом виявлені вірогідна еозинофілія (р < 0,05) та лімфоцитоз (р < 0,05), що не відзначалося при інфекції Н.pylori (I група).
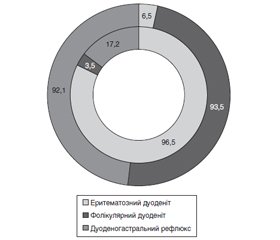
При езофагогастродуоденофіброскопії в дітей I групи найчастіше діагностувався гастрит тіла (р < 0,05), антрума (р < 0,05) або пангастрит (р < 0,05) з вогнищевою гіперплазією (р < 0,05), а в дітей II групи — переважно гастрит з локалізацією в антральному відділі, а також виражений дуоденіт (р < 0,05). Характерною ендоскопічною ознакою в дітей II групи був фолікулярний дуоденіт — 90,7 %, тоді як для дітей I групи така ознака була нехарактерною (рис. 3).
Дослідження біоптатів слизової оболонки ДПК у дітей обох груп виявило поверхневий дуоденіт (88,2 %). Однак запальний процес у групі II вірогідно частіше (р < 0,05) мав виражений (81,5 %) та активний (77,6 %) характер. Варто зазначити, що у дітей цієї групи також відзначалась еозинофільна інфільтрація (51,3 %). Мікроерозії спостерігались у 11,8 % випадків, осередки гіперплазії лімфоїдної тканини — у 6,5 %.
Отже, для хелікобактерної інфекції характерним здебільшого є поверхневий дуоденіт із помірною активністю запального процесу, тоді як для лямбліозу — виражений дуоденіт із вогнищами атрофії, мікроерозіями та гіперплазією лімфоїдної тканини.
Висновки
1. Клінічний перебіг ХГД, асоційованого з Н.pylori, в поєднанні з G.lamblia, характеризується більш вираженими диспептичними симптомами з ознаками інтоксикаційного та шкірного синдромів.
2. За результатами ендоскопічного дослідження, при ХГД, асоційованому з інфекцією Н.pylоri, вірогідно частіше (р < 0,05) діагностувались езофагіт, гастрит тіла, антруму та пангастрит. У дітей з інвазією G.lamblia відзначався виражений фолікулярний дуоденіт (р < 0,05).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 06.01.2022
Рецензовано/Revised 18.01.2022
Прийнято до друку/Accepted 26.01.2022
Список литературы
1. Зрячкин Н.И., Чеботарева Г.И., Бучкова Т.Н. Хронический гастрит и гастродуоденит у детей дошкольного и школьного возраста (1-я и 2-я части). Вопросы детской диетологии. 2015. № 13(4). С. 46-51.
2. Балко ОА. Helicobacter pylori-ассоциированный хронический гастродуоденит у детей: конституциональные особенности течения. Детские инфекции. 2020. № 19(1). С. 34-36. https://doi.org/10.22627/2072-8107-2020-19-1-34-36
3. Spużak J., Jankowski M., Kubiak K., Glińska-Suchocka K., Ciaputa R. A modified Sydney system for the diagnosis of chronic gastritis. Acta Vet. Scand. 2020. № 62(1). Р. 44. doi: 10.1186/s13028-020-00542-2.
4. Балко О.А., Сапожников В.Г. О методах диагностики хронического гастродуоденита, ассоциированного с Helicobacter pylori, в зависимости от типа конституции (обзор литературы). Вестник новых медицинских технологий. 2019. № 26(2). С. 5-11.
5. Mnich E., Kowalewicz-Kulbat M., Sicińska P. et al. Impact of Helicobacter pylori on the healing process of the gastric barrier. World J. Gastroenterol. 2016. № 22(33). Р. 7536-7558. doi: 10.3748/wjg.v22.i33.7536.
6. Reshetnyak V.I., Burmistrov A.I., Maev I.V. Helicobacter pylori: Commensal, symbiont or pathogen? World J. Gastroenterol. 2021. № 27(7). Р. 545-560. doi: 10.3748/wjg.v27.i7.545.
7. Sharndama H.C., Mba I.E. Helicobacter pylori: an up-to-date overview on the virulence and pathogenesis mechanisms [published online ahead of print, 2022 Jan 6]. Braz. J. Microbiol. 2022. Р. 1-18. doi: 10.1007/s42770-021-00675-0.
8. de Lucio A., Martínez-Ruiz R., Merino F.J. et al. Molecular Genotyping of Giardia duodenalis Isolates from Symptomatic Individuals Attending Two Major Public Hospitals in Madrid, Spain. PLoS One. 2015. № 10(12). Р. e0143981. doi: 10.1371/journal.pone.0143981/.
9. Bin Mohanna M.A., Al-Zubairi L.M., Sallam A.K. Prevalence of Helicobacter pylori and parasites in symptomatic children examined for Helicobacter pylori antibodies, antigens, and parasites in Yemen. Saudi Med. J. 2014. № 35(11). Р. 1408-1411.
10. Loderstädt U., Frickmann H. Antimicrobial resistance of the enteric protozoon Giardia duodenalis — A narrative review. Eur. J. Microbiol. Immunol. (Bp). 2021. № 11(2). Р. 29-43. doi: 10.1556/1886.2021.00009.
11. Dangtakot R., Pinlaor S., Itthitaetrakool U. et al. Coinfection with Helicobacter pylori and Opisthorchis viverrini Enhances the Severity of Hepatobiliary Abnormalities in Hamsters. Infect. Immun. 2017. № 85(4). Р. e00009-17.
12. Zajaczkowski P., Mazumdar S., Conaty S., Ellis J.T., Fletcher-Lartey S.M. Epidemiology and associated risk factors of giardiasis in a peri-urban setting in New South Wales Australia. Epidemiol. Infect. 2018. № 147. Р. e15. doi: 10.1017/S0950268818002637.
/31.jpg)
/33.jpg)

/32_2.jpg)
/32.jpg)