Журнал "Гастроэнтерология" Том 56, №1, 2022
Вернуться к номеру
Фруктоза: роль у формуванні кишкових симптомів
Авторы: N.N. Silivontchik
Belarusian Medical Academy of Postgraduate Education, Minsk, Belarus
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Фруктоза — це простий цукор, присутній у фруктах та меду, також вона є основним компонентом двох найбільш часто використовуваних підсолоджувачів — сахарози (столового цукру) та кукурудзяного сиропу з високим умістом фруктози. Споживання фруктози помітно зросло за останні кілька сотень років, і в даний час споживання додаткового цукру наближається до 15 відсотків загального споживання енергії в середньостатистичному європейському раціоні. Поширеність мальабсорбції фруктози відносно висока у здорових дорослих (~ 34 %), і цей показник більше у пацієнтів з функціональними розладами шлунково-кишкового тракту. Симптоми, що розвиваються після прийому фруктози у разі непереносимості фруктози, є поширеними у пацієнтів із синдромом подразненого кишечника (СПК). Через недостатність таргетної терапії СПК багато пацієнтів для лікування симптомів вдаються до модифікації дієти. В останні роки дієта з низьким вмістом FODMAP для лікування СПК набуває все більшої популярності. Абревіатура FODMAP означає «ферментовані олігосахариди, дисахариди, моносахариди та поліол» і включає продукти з умістом фруктози більше, ніж глюкози, олігосахариди, включаючи фруктани, галактоолігосахарид і цукрові поліоли, такі як сорбітолак і сорбітол. Склад дієт FODMAP та їх механізми дії при СПК були інтенсивно вивчені в останнє десятиліття, але їх зв’язок з фруктозою не є специфічним. Дієта FODMAP може посилити кишкові симптоми через збільшення об’єму води в тонкому кишечнику, утворення газів у товстому кишечнику та перистальтики кишечника. Дієтичні обмеження FODMAP пов’язані зі зниженням ферментації та значним покращенням симптомів у деяких пацієнтів із СПК.
Fructose is a simple sugar that is present in fruit and honey, but is also a major component in the two most commonly used sweeteners, sucrose (table sugar), and high fructose corn syrup (HFCS). Intake of fructose has increased markedly over the last several hundred years, and currently the intake of added sugars approaches 15 percent of overall energy intake in the average western diet. The prevalence of fructose malabsorption is relatively high in healthy adults (~ 34 %) and is even greater in patients with functional gastrointestinal disorders. Symptoms following fructose ingestion, or fructose intolerance, are common in patients with irritable bowel syndrome (IBS). Due to the paucity of targeted therapy for IBS, many patients turn to dietary modifications for symptom management. In recent years the low-FODMAPs diet for treatment of IBS has gained increasing popularity. The acronym FODMAP stands for “fermentable oligosaccharides, disaccharides, monosaccharides, and polyol” and includes foods with fructose in excess of glucose, oligosaccharides including fructans, galacto-oligosaccharide and sugar polyols such as sorbitol and mannitol and lactose. The composition of FODMAPs diets and their mechanisms of action in IBS have been intensively studied in the past decade, but since this link is not specific to fructose. Dietary FODMAP might exacerbate intestinal symptoms by increasing small intestinal water volume, colonic gas production, and intestinal motility. Dietary FODMAPs restriction is associated with reduced fermentation and significant symptom improvement in some IBS patients.
фруктоза; порушення всмоктування; FODMAP; синдром подразненої товстої кишки
fructose; malabsorption; FODMAP; irritable bowel syndrome
Introduction
General characteristics of fructose
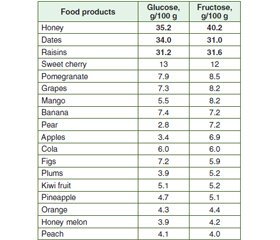
Sources of fructose
/60.jpg)
Absorption of fructose
Malabsorption of fructose
Irritable bowel syndrome
Conclusions
- Jensen T., Abdelmalek M.F., Sullivan S., et al. Fructose and sugar: A major mediator of nonalcoholic fatty liver disease. J. Hepatol. 2018. 68. 1063-1075. doi: 10.1016/j.jhep.2018.01.019.
- Roeb E., Weiskirchen R. Fructose and non-alkoholic steatohepatitis. Frontiers in Pharmacology. 2021. 08 February. doi.org/10.3389/fphar.2021.634344.
- Eslam M., Newsome P.N., Anstee Q.M., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. J. Hepatol. 2020. 73. 202-209. doi: 10.1016/j.jhep.2020.03.039.
- Miranda J., Vázquez-Polo M., Pérez-Junkera G. et al. FODMAP intake in spanish population: Open approach for risk assessment. Int. J. Environ. Res. Public Health. 2020. 17. 5882. doi: 10.3390/ijerph17165882.
- Dornas W.C., de Lima W.G., Pedrosa M.L., Silva M.E. Health implications of high-fructose intake and current research. Adv. Nutr. 2015. 6. 729-737. doi: 10.3945/an.114.008144.
- Kolderup A., Svihus B. Fructose metabolism and relation to atherosclerosis, type 2 diabetes, and obesity. J. Nutr. Met. 2015. 12 p. doi: 10.1155/2015/823081.
- Perederiy V.G., Sizenko A.K., Tkach S.M. Modern approaches to the diagnosis and correction of fructose malabsorption. Modern Gastroenterology. 2010. 3 (53). 113-120.
- Council Directive 2001/110/EC of 20 December 2001 relating to honey. Off. J. Eur. Commun. 2002. 10. 47-52.
- Bogdanov S., Jurendic T., Sieber R., Gallmann P. Honey for nutrition and health: A review. J. Am. Coll. Nutr. 2013. 27. 677-689. doi: 10.1080/07315724.2008.10719745.
- Nguyen H.T.L., Panyoyai N., Kasapis S., Pang E., Mantri N. Honey and its role in relieving multiple facets of atherosclerosis. Nutrients. 2019. 11. 167. doi.org/10.3390/nu11010167.
- Hengist A., Koumanov F., Gonzalez J.T. Fructose and metabolic health: governed by hepatic glycogen status? J. Physiol. 2019. 597. 3573-3585.
- Hills S.P., Mitchell P., Wells C., Russell M. Honey supplementation and exercise: A systematic review. Nutrients. 2019. 1. 1586. doi.org/10.3390/nu11071586.
- Caravaggio F., Borlido C., Hahn M., et al. Reduced insulin sensitivity is related to less endogenous dopamine at D2/3 receptors in the ventral striatum of healthy non abuse humans. Int. J. Neuropsychopharmacol. 2015. 18. 1-10. doi: 10.1093/ijnp/pyv014.
- Federico A., Rosato V., Masarone M., et al. The role of fructose in non-alcoholic steatohepatitis: Old relationship and new insight. Nutrients. 2021. 13. 1314. doi.org/10.3390/nu13041314.
- Pensabene L., Salvatore S., Turco R., et al. Low FODMAPs diet for functional abdominal pain disorders in children: critical review of current knowledge. J. Pediatr. (Rio J). 2019. 95. 642-656. doi: 10.1016/j.jped.2019.03.004.
- Dusilová T., Jan Kovář J., Drobný M., et al. Different acute effects of fructose and glucose administration on hepatic fat content. Am. J. Clin. Nutr. 2019. 109. 1519-1526. doi: 10.1093/ajcn/nqy386.
- Gonzalez J.T. Fructose and metabolic health: governed by hepatic glycogen status? J. Physiol. 2019. 597. 3573-3585. doi: 10.1113/JP277767.
- Perrar I., Buyken A.E., Penczynski K.J., et al. Relevance of fructose intake in adolescence for fatty liver indices in young adulthood. Eur. J. Nutr. 2021. 60. 3029-3041. doi: 10.1007/s00394-020-02463-2.
- Ferraris R.P., Choe J.-Y., Patel C.R. Intestinal absorption of fructose. Annu Rev. Nutr. 2018. 38. 41-67. doi: 10.1146/annurev-nutr-082117-051707.
- Douard V., Ferraris R. Regulation of the fructose transporter GLUT5 in health and disease. Am. J. Physiol. Endocrinol. Metab. 200. 295. 227-237. doi: 10.1152/ajpendo.90245.2008.
- Fuchs C.J., Gonzalez J.T., van Loon L.J.C. Fructose co-ingestion to increase carbohydrate availability in athletes. J. Physiol. 2019. 597. 3549-3560. doi: 10.1113/JP277116.
- Gomara R.E., Halata M.S., Newman L.J., et al. Fructose intolerance in children presenting with abdominal pain. J. Pediatr. Gastroenterol. Nutr. 2008. 47. 303-308. doi: 10.1097/MPG.0b013e318166cbe4.
- Jones H.F., Burt E., Dowling K., Davidson G., Brooks D.A., Butler R.N. Effect of age on fructose malabsorption in children presenting with gastrointestinal symptoms. J. Pediatr. Gastroenterol. Nutr. 2011. 52. 581-584.
- Barrett J.S., Irving P.M., Shepherd S.J., Muir J.G., Gibson P.R. Comparison of the prevalence of fructose and lactose malabsorption across chronic intestinal disorders. Aliment. Pharmacol. Ther. 2008. 30. 165-714. doi: 10.1111/j.1365-2036.2009.04018.x.
- Wilder-Smith C.H., Materna A., Wermelinger C., Schuler J. Fructose and lactose intolerance and malabsorption testing: the relationship with symptoms in functional gastrointestinal disorders. Aliment. Pharmacol. Ther. 2013. 37. 1074-1083. doi: 10.1111/apt.12306.
- Lacy B.E., Mearin F., Chang L., et al. Bowel disorders. Gastroenterology. 2016. 150. 1393-1407. doi.org/10.1053/j.gastro.2016.02.031.
- Gibson P.R., Shepherd S.J. Personal view: food for thought-western lifestyle and susceptibility to Crohn’s disease. The FODMAP hypothesis. Aliment. Pharmacol. Ther. 2005. 21. 1399-1409. doi: 10.1111/j.1365-2036.2005.02506.x.
- Miranda J., Vázquez-Polo M., Pérez-Junkera G., et al. FODMAP intake in spanish population: Open approach for risk assessment. Int. J. Environ. Res. Public Health. 2020. 17. 5882. doi: 10.3390/ijerph17165882.
- Mitchell H., Porter J., Gibson P.R., Barrett J., Garg M. Review article: implementation of a diet low in FODMAPs for patients with irritable bowel syndrome — directions for future research. Aliment. Pharmacol. Ther. 2019. 49. 124-139. doi: 10.1111/apt.15079.
- Catassi G., Lionetti E., Gatti S., Catassi C. The Low FODMAP diet: many question marks for a catchy acronym. Nutrients. 2017. 9. 292. doi: 10.3390/nu9030292.
- Turco R., Salvatore S., Miele E., Romano C., Marseglia G.L., Staiano A. Does a low FODMAPs diet reduce symptoms of functional abdominal pain disorders? A systematic review in adult and paediatric population, on behalf of Italian Society of Pediatrics. Italian J. Pediatr. 2018. 44. 53. doi: 10.1186/s13052-018-0495-8.
- Fodor I., Man S.C., Dumitrascu D.L. Low fermentable oligosaccharides, disaccharides, monosaccharides, and polyols diet in children. World J. Clin. Cases. 2019. 7. 2666-2674. doi: 10.12998/wjcc.v7.i18.2666.
- Wang X.J., Camilleri M., Vanner S., Tuck C. Biological mechanisms for symptom causation by individual FODMAP subgroups — the case for a more personalised approach to dietary restriction. Aliment. Pharmacol. Ther. 2019. 50. 517-529.
- Yamashita L.M., Corona L.P., da Silva E.D., et al. FODMAP project: Development, validation and reproducibility of a short food frequency questionnaire to estimate consumption of fermentable carbohydrates. Clin. Nutr. 2021. 40. 3409-3420. doi: 10.1016/j.clnu.2020.11.021.
- Albiac M.A., Di Cagno R., Filannino P., Cantatore V., Gobbetti M. How fructophilic lactic acid bacteria may reduce the FODMAPs content in wheat-derived baked goods: a proof of concept. Microb. Cell Fact. 2020. 19. 182.
- DiNicolantonio J.J., Berger A. Added sugars drive nutrient and energy deficit in obesity: a new paradigm. Open Heart. 2016. 3. e000469. doi: 10.1136/openhrt-2016-000469.
- Hyams J.S., Di Lorenzo C., Saps M., Shulman R.J., Staiano A., van Tilburg M. Functional gastrointestinal disorders: child/adolescent. Gastroenterology. 2016. 150. 1456-1468. doi: 10.1053/j.gastro.2016.02.015.
- Melchior C., Douard V., Coëffier M., Gourcerol G. Fructose and irritable bowel syndrome. Nutr. Res. Rev. 2020. 33. 235-243. doi: 10.1017/S0954422420000025.
- Gomara R.E., Halata M.S., Newman L.J., et al. Fructose intolerance in children presenting with abdominal pain. J. Pediatr. Gastroenterol. Nutr. 2008. 47. 303-308. doi: 10.1097/MPG.0b013e318166cbe4.
- Hutson J.M., Hynes M.C., Kearsey I., et al. ‘Rapid transit’ constipation in children: a possible genesis for irritable bowel syndrome. Pediatr. Surg. Int. 2020. 36. 11-10. doi: 10.1007/s00383-019-04587-x.
- Wilder-Smith C., Lee S.H., Olesen S.S., et al. Fructose intolerance is not associated with malabsorption in patients with functional gastrointestinal disorders. Neurogastroenterol. Motil. 2021. 33 (12). e14150. doi: 10.1111/nmo.14150.
- Chumpitazi B.P., Weidler E.M., Lu D.Y., Tsai C.V.T., Shulmanet R.J. Self-perceived food intolerances are common and associated with clinical severity in childhood irritable bowel syndrome. J. Acad. Nutr. Diet. 2016. 116. 1458-1464. doi: 10.1016/j.jand.2016.04.017.

/61.jpg)