Журнал «Медицина неотложных состояний» Том 18, №1, 2022
Вернуться к номеру
Чинники, що пов’язані з відновленням функції правого шлуночка хворих із тромбоемболією легеневої артерії при короткотривалому спостереженні
Авторы: Целуйко В.Й. (1), Яковлева Л.М. (1), Сухова С.М. (2), Радченко О.В. (1)
(1) — Харківський національний університет імені В.Н. Каразіна, м. Харків, Україна
(2) — КНП «Міська клінічна лікарня № 8» Харківської міської ради, м. Харків, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
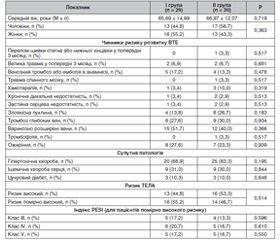
Мета роботи — дослідити можливий вплив препарату тіворель на покращення функції правого шлуночка у хворих на гостру тромбоемболію легеневої артерії (ТЕЛА). Матеріали та методи. Дослідження проведено в період з 1 вересня 2019 р. по 31 грудня 2020 р. на базі КНП «Міська клінічна лікарня № 8» Харківської міської ради. До аналізу було включено 59 хворих на тромбоемболію легеневої артерії, (середній вік — 66,34 ± 13,48 року) з наявною дисфункцією правого шлуночка (ПШ). Із них пацієнтів високого ризику було 29 (49,2 %) та помірно високого ризику — 30 (50,8 %). Усі пацієнти з ТЕЛА отримували антикоагулянтну терапію згідно з рекомендаціями ESC 2019. Методом конвертів обстежені хворі були розподілені на дві групи. До І групи ввійшло 29 пацієнтів, яким з першої по п’яту добу перебування у стаціонарі додатково до стандартної терапії призначали тіворель (42 мг аргініну гідрохлориду та 20 мг левокарнітину) 100 мл внутрішньовенно, виробництва компанії «Юрія-Фарм». У ІІ групу ввійшло 30 хворих, які отримували стандартну терапію щодо лікування ТЕЛА. Результати. За даними ЕхоКГ, в обох групах обстежених на ТЕЛА відбулися позитивні зміни показників, що свідчать про функцію ПШ: вірогідно зменшилися розмір та індекс об’єму правого передсердя (V ПП), розмір ПШ, а також середній тиск у легеневій артерії (Рсер ЛА), р < 0,05. До кінця періоду спостереження у І групі хворих, у яких розмір ПШ становив < 3,0 cм, було 23 (79,3 %), що вірогідно більше, ніж у ІІ групі — 17 (56,7 %), р = 0,01. Висновки. У 43,3 % % хворих на ТЕЛА високого та помірно високого ризику через 14–21 день стандартної антикоагулянтної терапії за даними ЕхоКГ зберігаються зміни показників, що свідчать про дисфункцію ПШ. За даними мультиваріантного регресійного логістичного аналізу, незалежними чинниками, що пов’язані з відновленням функції ПШ у хворих на ТЕЛА високого та помірно високого ризику протягом 14–21 діб, є Рсер ЛА, розмір ПП та призначення до стандартної терапії інфузій препарату тіворель (p < 0,05).
Background. The purpose was to study the possible influence of Tivorel on the improvement of the right ventricular (RV) function in patients with acute pulmonary embolism (PE). Materials and methods. The study was conducted between September 1, 2019 and December 31, 2020 at the premises of the Municipal Non-Profit Enterprise “City Clinical Hospital 8” of Kharkiv City Council. The analysis included 59 patients with RV dysfunction and PE, their average age was 66.34 ± 13.48 years. Twenty-nine (49.2 %) patients were at high risk and 30 (50.8 %) at moderate-to-high risk. All individuals with PE were treated with anticoagulants according to 2019 European Society of Cardiology guidelines. Patients were divided into 2 groups using the envelope method. Group 1 (29 people) were prescribed Tivorel (42 mg of arginine hydrochloride and 20 mg of levocarnitine) manufactured by Yuria-Pharm company — 100 ml intravenously during the first five days of hospital stay, in addition to the standard therapy. Group 2 (30 patients) received the standard PE treatment. Results. According to the cardiac ultrasound results, patients with PE had an improvement of right ventricular function parameters: a significant decrease in right atrial size and volume index, RV size and mean pulmonary artery pressure (р < 0.05). By the end of the observation period, the number of patients in group I whose RV size became < 3.0 cm was 23 (79.3 %) that was significantly higher than in group II — 17 (56.7 %) people, p = 0.01. Conclusions. 43.3 % of patients at high and moderate-to-high risk of PE have ultrasonic signs of RV dysfunction after 14–21 days of standard anticoagulation therapy. According to the multivariate regression logistic analysis results, independent factors related to the normalization of RV function in patients with high and moderate-to-high risk of PE after 14–21 days are: mean pulmonary artery pressure, right atrial size and prescription of Tivorel infusions in addition to the standard therapy (p < 0.05).
тромбоемболія легеневої артерії; аргінін; короткотерміновий прогноз; антикоагулянтна терапія
pulmonary embolism; arginine; short-term prognosis; anticoagulant therapy
Вступ
Матеріали та методи
/43.jpg)
Результати
Обговорення
Висновки
- Agnelli G., Anderson F., Arcelus J., Bergqvist D., Brecht J., Greer I. et al. Venous thromboembolism (VTE) in Europe. Thrombosis And Haemostasis. 2007. 98(10). 756-764. https://doi.org/10.1160/th07-03-0212
- Benjamin E., Muntner P., Alonso A., Bittencourt M., Callaway C., Carson A. et al. Heart Disease and Stroke Statistics — 2019 Update: A Report From the American Heart Association. Circulation. 2019. 139(10). e56-e528. https://doi.org/10.1161/cir.0000000000000659
- Cho J.H., Kutti S.G., Kim S.H., Kaw R., Abburi T., Irfan A., Kocheril A.G. Right ventricular dysfunction as an echocardiographic prognostic factor in hemodynamically stable patients with acute pulmonary embolism: a meta-analysis. BMC Cardiovascular Disorders. 2014. 14. 64-73. https://doi.org/10.1186/1471-2261-14-64
- Burrowes K.S., Clark A.R., Tawhai M.H. Blood flow redistribution and ventilation-perfusion mismatch during embolic pulmonary arterial occlusion. Pulmonary Circulation. 2011. 1(3). 365-376. https://doi.org/10.4103/2045-8932.87302
- Heit J. The Epidemiology of Venous Thromboembolism in the Community. Arteriosclerosis, Thrombosis, And Vascular Biology. 2008. 28(3). 370-372. https://doi.org/10.1161/atvbaha.108.162545
- Kempny A., McCabe C., Dimopoulos K., Price L., Wilde M., Limbrey R. et al. Incidence, mortality and bleeding rates associated with pulmonary embolism in England between 1997 and 2015. International Journal of Cardiology. 2019. 277. 229-234. https://doi.org/10.1016/j.ijcard.2018.10.001
- Potočnjak I., Radulović B., Degoricija V., Trbušić M., Pregartner G., Berghold A. et al. Serum concentrations of asymmetric and symmetric dimethylarginine are associated with mortality in acute heart failure patients. International journal of cardiology. 2018. 261. 109-113. https://doi.org/10.1016/j.ijcard.2018.03.037
- Klinger J.R., Kadowitz P.J. The Nitric Oxide Pathway in Pulmonary Vascular Disease. The American journal of cardiology. 2017. 120(8S). S71-S79. https://doi.org/10.1016/j.amjcard.2017.06.012
- Kiran G., Chandrasekhar P., Ali S. Association between 2D echocardiographic right atrial volume to left atrial volume (RAV/LAV) ratio and in-hospital prognosis in thrombolysed acute pulmonary thromboembolism patients. Indian Heart Journal. 2020. 72(6). 610-613. https://doi.org/10.1016/j.ihj.2020.09.008
- Jiménez D., Bikdeli B., Barrios D., Quezada A., del Toro J., Vidal G. et al. Epidemiology, patterns of care and mortality for patients with hemodynamically unstable acute symptomatic pulmonary embolism. International Journal of Cardiology. 2018. 269. 327-333. https://doi.org/10.1016/j.ijcard.2018.07.059
- Konstantinides S., Meyer G., Becattini C., Bueno H., Geersing G., Harjola V. et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). European Heart Journal. 2019. 41(4). 543-603. https://doi.org/10.1093/eurheartj/ehz405
- Zhao G., Zhang H., Wang Yi., Gao X. et al. Effects of levocarnitine on cardiac function, urinary albumin, hs-CRP, BNP, and troponin in patients with coronary heart disease and heart failure. Hellenic Journal of Cardiology. 2020. 61. 99-102. https://doi.org/10.1016/j.hjc.2018.08.006
- Laporte S., Mismetti P., Décousus H., Uresandi F., Otero R., Lobo J., Monreal M. Clinical Predictors for Fatal Pulmonary Embolism in 15 520 Patients With Venous Thromboembolism. Circulation. 2008. 117(13). 1711-1716. https://doi.org/10.1161/circulationaha.107.726232
- Atzler D., Cracowski J.L., Cordts K., Böger R.H., Humbert M., Schwedhelm E. Homoarginine predicts mortality in treatment-naive patients with pulmonary arterial hypertension. International journal of cardiology. 2016. 217. 12-15. https://doi.org/10.1016/j.ijcard.2016.04.161
- Rodionov R.N., Begmatov H., Jarzebska N., Patel K., Mills M.T., Ghani Z. et al. Homoarginine Supplementation Prevents Left Ventricular Dilatation and Preserves Systolic Function in a Model of Coronary Artery Disease. Journal of the American Heart Association. 2019. 8(14). e012486. https://doi.org/10.1161/JAHA.119.012486
- Sandqvist A., Schneede J., Kylhammar D., Henrohn D., Lundgren J., Hedeland M. et al. Plasma L-arginine levels distinguish pulmonary arterial hypertension from left ventricular systolic dysfunction. Heart and vessels. 2018. 33(3). 255-263. https://doi.org/10.1007/s00380-017-1055-7

/44.jpg)
/45.jpg)