Международный эндокринологический журнал Том 18, №3, 2022
Вернуться к номеру
Діагностичне значення антимюллерового гормону в дівчат-підлітків із синдромом полікістозних яєчників
Авторы: Сорокман Т.В., Макарова О.В., Остапчук В.Г.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
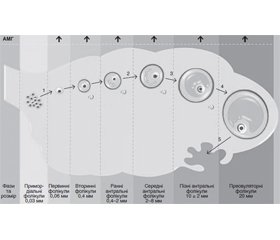
Актуальність. Тривалий час ведеться наукова дискусія щодо діагностичних критеріїв синдрому полікістозних яєчників у підлітків (СПКЯ). Проблема полягає в тому, що у підлітків зазначені критерії зумовлюють особливі діагностичні проблеми у зв’язку з тим, що характеристики нормального статевого дозрівання часто збігаються з ознаками та симптомами СПКЯ. Виникла необхідність у розробці діагностичних критеріїв СПКЯ у підлітків, які би могли бути використані на додаток до запропонованих. Ймовірним додатковим діагностичним критерієм може бути рівень антимюллерового гормону (АМГ). Мета — оцінити показники АМГ у крові дівчат-підлітків із синдромом полікістозних яєчників. Матеріали та методи. Проведено клініко-анамнестичне та лабораторне обстеження 27 дівчат-підлітків (12–18 років) із СПКЯ. Групу порівняння становили 25 дівчат аналогічного віку без порушень гінекологічного статусу. АМГ визначали в сироватці венозної крові (Gen II ELISA, Beckman Coulter). Результати. Проаналізовано анамнез дівчат-підлітків із СПКЯ: внутрішньоутробна гіпоксія траплялася майже у половини підлітків, патологічний перебіг постнатального періоду спостерігався у 25,9 %, інфекційний індекс становив 4,6, гіпертензійно-гідроцефальний синдром встановлено у 23,8 %, мінімальна церебральна дисфункція — у 28,5 %, вегетативні розлади — у 47,6 %. Більшість обстежених дівчат мали середні показники маси тіла та зросту, інвертований пубертат та дисгармонійний статевий розвиток. Найчастішими симптомами СПКЯ у дівчат були: гіпоменструальний синдром (86,9 %), дермопатія (82,6 %) та гірсутизм (60,8 %). Середній показник АМГ у дівчат із СПКЯ та у групі порівняння становив 3,67 ± 1,00 нг/мл (у дівчат із СПКЯ 4,8 ± 0,9 та у дівчат групи порівняння 3,1 ± 0,7 нг/мл, р < 0,05). У дівчат-підлітків із формою А СПКЯ рівень гормону був найвищий — 6,4 [4,8; 6,9] пг/мл, p < 0,01, що може вказувати на ймовірне діагностичне значення концентрації АМГ. Висновки. У дівчат-підлітків із підозрою на наявність синдрому полікістозних яєчників необхідно проводити повний комплекс обстежень із визначенням рівня антимюллерового гормону як додаткового маркера, особливо за відсутності клінічних проявів гіперандрогенемії.
Background. Scientific debate continues on the diagnostic criteria for polycystic ovary syndrome in adolescents (PCOS). In adolescents these criteria cause special diagnostic problems due to the fact that the characteristics of normal puberty often coincide with the signs and symptoms of PCOS. There is a need to develop diagnostic criteria for PCOS in adolescents, which could be used in addition to those proposed. A possible additional diagnostic criterion may be the level of anti-Mullerian hormone (AMH). The purpose of the study is to assess the levels of anti-Mullerian hormone in the blood of adolescent girls with polycystic ovary syndrome. Materials and methods. A clinical-anamnestic and laboratory study of 27 adolescent girls (12–18 years) with PCOS was conducted. The comparison group consisted of 25 girls of the same age without gynecological disorders. Determination of AMG was performed in venous serum (Gen II ELISA, Beckman Coulter). Results. The anamnesis of adolescent girls with PCOS was analyzed: intrauterine hypoxia occurred in almost half of adolescents, pathological course of the postnatal period was observed in 25.9 %, infectious index was 4.6, hypertensive-hydrocephalic syndrome was found in 23.8 %, minimal cerebral dysfunction 28.5 %, autonomic disorders — in 47.6 %, most of the surveyed girls had average body weight and height, inverted puberty and disharmonious sexual development. The most common symptoms of PCOS in girls were: hypomenstrual syndrome (86.9 %), dermopathy (82.6 %) and hirsutism (60.8 %). The mean AMG in girls with PCOS and in the comparison group was 3.67 ± 1.0 ng/ml (in girls with PCOS 4.8 ± 0.9 and in girls in the comparison group 3.1 ± 0.7 ng/ml, p < 0.05). Adolescent girls with form A PCOS had the highest hormone levels — 6.4 [4.8; 6.9] pg/ml, p < 0.01, which may indicate a probable diagnostic value of AMG concentration. Conclusions. Adolescent girls with suspected polycystic ovary syndrome should have a complete set of tests to determine the level of anti-Mullerian hormone as an additional marker, especially in the absence of clinical manifestations of hyperandrogenemia.
дівчата-підлітки; антимюллерів гормон; синдром полікістозних яєчників
adolescent girls; anti-Mullerian hormone; polycystic ovary syndrome
Вступ
Матеріали та методи
Результати
/32_2.jpg)
Обговорення
Висновки
- Mills M.C., Tropf F.C., Brazel D.M., van Zuydam N., Vaez A.; eQTLGen Consortium; BIOS Consortium; Human Reproductive Behaviour Consortium, Pers T.H., Snieder H., Perry J.R.B., Ong K.K., den Hoed M., Barban N., Day F.R. Identification of 371 genetic variants for age at first sex and birth linked to externalising behaviour. Nat. Hum. Behav. 2021. 5(12). 1717-1730. doi: 10.1038/s41562-021-01135-3.
- Sadeeqa S., Mustafa T., Latif S. Polycystic Ovarian Syndrome-Related Depression in Adolescent Girls: A Review. J. Pharm. Bioallied Sci. 2018. 10(2). 55-59. doi: 10.4103/JPBS.JPBS_1_18.
- Rosenfield R.L., Ehrmann D.A. The Pathogenesis of Polycystic Ovary Syndrome (PCOS): The Hypothesis of PCOS as Functio–nal Ovarian Hyperandrogenism Revisited. Endocr. Rev. 2016. 37(5). 467-520. doi: 10.1210/er.2015-1104.
- National Institutes of Health. Evidence-based methodology workshop on polycystic ovary syndrome. Bethesda, Maryland: NIH; 2012.
- Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum. Reprod. 2004. 19(1). 41-7. doi: 10.1093/humrep/deh098.
- The Rotterdam ESHRE/ASRM-Sponsored Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil. Steril. 2004. 81(1). 19-25. https://doi.org/10.1016/j.fertnstert.2003.10.004.
- Zhang H.Y., Zhu F.F., Xiong J., Shi X.B., Fu S.X. Characteristics of different phenotypes of polycystic ovary syndrome based on the Rotterdam criteria in a large-scale Chinese population. BJOG. 2009. 116(12). 1633-9. doi: 10.1111/j.1471-0528.2009.02347.x.
- Azziz R., Carmina E., Dewailly D., Diamanti-Kandarakis E., Escobar-Morreale H.F., Futterweit W., Janssen O.E., et al.; Task Force on the Phenotype of the Polycystic Ovary Syndrome of The Androgen Excess and PCOS Society. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Fertil. Steril. 2009. 91(2). 456-88. doi: 10.1016/j.fertnstert.2008.06.035.
- Sultan C., Paris F. Clinical expression of polycystic ovary syndrome in adolescent girls. Fertil. Steril. 2006. 86 Suppl. 1. S6. doi: 10.1016/j.fertnstert.2006.04.015. PMID: 16798287.
- Dumesic D.A., Oberfield S.E., Stener-Victorin E., Marshall J.C., Laven J.S., Legro R.S. Scientific Statement on the Diagnostic Criteria, Epidemiology, Pathophysiology, and Molecular Genetics of Polycystic Ovary Syndrome. Endocr. Rev. 2015. 36(5). 487-525. doi:10.1210/er.2015-1018.
- Rudnicka E., Kunicki M., Calik-Ksepka A., Suchta K., Duszewska A., Smolarczyk K., Smolarczyk R. Anti-Müllerian Hormone in Pathogenesis, Diagnostic and Treatment of PCOS. Int. J. Mol. Sci. 2021. 22(22). 12507. doi: 10.3390/ijms222212507.
- Silva M.S.B., Giacobini P. New insights into anti-Müllerian hormone role in the hypothalamic-pituitary-gonadal axis and neuroendocrine development. Cell Mol. Life Sci. 2021. 78(1). 1-16. doi:10.1007/s00018-020-03576-x.
- Caanen M.R., Peters H.E., van de Ven P.M., Jüttner A.M.F.M., Laven J.S.E., van Hooff M.H.A., Lambalk C.B. Anti-Müllerian Hormone Levels in Adolescence in Relation to Long-term Follow-up for Presence of Polycystic Ovary Syndrome. J. Clin. Endocrinol. Metab. 2021. 106(3). e1084-e1095. doi: 10.1210/clinem/dgaa949.
- Abbott D.H., Dumesic D.A., Levine J.E. Hyperandrogenic origins of polycystic ovary syndrome — implications for pathophysiology and therapy. Expert Rev. Endocrinol. Metab. 2019. 14(2). 131-143. doi:10.1080/17446651.2019.1576522.
- Yates A.P., Jopling H.M., Burgoyne N.J., Hayden K., Chalo–ner C.M., Tetlow L. Paediatric reference intervals for plasma anti-Müllerian hormone: comparison of data from the Roche Elecsys assay and the Beckman Coulter Access assay using the same cohort of samples. Ann. Clin. Biochem. 2019. 56(5). 536-547. doi: 10.1177/0004563219830733.
- Abdolahian S., Tehrani F.R., Amiri M., et al. Effect of lifestyle modifications on anthropometric, clinical, and biochemical parameters in adolescent girls with polycystic ovary syndrome: a systematic review and meta-analysis. BMC Endocr. Disord. 2020. 20(1). 71. doi:10.1186/s12902-020-00552-1.
- Sadeghi H.M., Adeli I., Calina D., Docea A.O., Mousavi T., Daniali M., Nikfar S., et al. Polycystic Ovary Syndrome: A Comprehensive Review of Pathogenesis, Management, and Drug Repurposing. Int. J. Mol. Sci. 2022. 23(2). 583. doi: 10.3390/ijms23020583.
- Bani Mohammad M., Majdi Seghinsara A. Polycystic Ovary Syndrome (PCOS), Diagnostic Criteria, and AMH. Asian Pac. J. Cancer Prev. 2017. 18(1). 17-21. doi: 10.22034/APJCP.2017.18.1.17.
- Rao P., Bhide P. Controversies in the diagnosis of polycystic ovary syndrome. Ther. Adv. Reprod. Health. 2020. 14. 2633494120913032. doi: 10.1177/2633494120913032.
- Kim K.W. Unravelling Polycystic Ovary Syndrome and Its Comorbidities. J. Obes. Metab. Syndr. 2021. 30(3). 209-221. doi:10.7570/jomes21043.
- Mimouni N.E.H., Paiva I., Barbotin A.L. Polycystic ovary syndrome is transmitted via a transgenerational epigenetic process. Cell Metab. 2021. 33(3). 513-530.e8. doi: 10.1016/j.cmet.2021.01.004.
- Cutillas-Tolín A., Arense-Gonzalo J.J., Mendiola J., et al. Are Dietary Indices Associated with Polycystic Ovary Syndrome and Its Phenotypes? A Preliminary Study. Nutrients. 2021. 13(2). 313. doi:10.3390/nu13020313.
- Rudnicka E., Kunicki M., Calik-Ksepka A. Anti-Müllerian Hormone in Pathogenesis, Diagnostic and Treatment of PCOS. Int. J. Mol. Sci. 2021. 22(22). 12507. doi: 10.3390/ijms222212507.
- Owens L.A., Kristensen S.G., Lerner A., et al. Gene Expression in Granulosa Cells From Small Antral Follicles From Women With or Without Polycystic Ovaries. J. Clin. Endocrinol. Metab. 2019. 104(12). 6182-6192. doi:10.1210/jc.2019-00780.
- Pellatt L., Hanna L., Brincat M. Granulosa cell production of anti-Mullerian hormone is increased in polycystic ovaries. J. Clin. Endocrinol. Metab. 2007. 92(1). 240-245. doi: 10.1210/jc.2006-1582.
- Guedikian A.A., Lee A.Y., Grogan T.R. Reproductive and metabolic determinants of granulosa cell dysfunction in normal-weight women with polycystic ovary syndrome. Fertil. Steril. 2018. 109(3. 508-515. doi: 10.1016/j.fertnstert.2017.11.017.
- Xing C., Zhang J., Zhao H., He B. Effect of Sex Hormone-Binding Globulin on Polycystic Ovary Syndrome: Mechanisms, Manifestations, Genetics, and Treatment. Int. J. Womens Health. 2022. 14. 91-105. doi:10.2147/IJWH.S344542.
- Ran Y., Yi Q., Li C. The Relationship of Anti-Mullerian Hormone in Polycystic Ovary Syndrome Patients with Different Subgroups. Diabetes Metab. Syndr. Obes. 2021. 14. 1419-1424. doi:10.2147/DMSO.S299558.
- Tata B., Mimouni N.E.H., Barbotin A.L., et al. Elevated prenatal anti-Müllerian hormone reprograms the fetus and induces polycystic ovary syndrome in adulthood. Nat. Med. 2018. 24(6). 834-846. doi:10.1038/s41591-018-0035-5.
- Kanakatti Shankar R., Dowlut-McElroy T., Dauber A., Gomez-Lobo V. Clinical Utility of Anti-Mullerian Hormone in Pediatrics. J. Clin. Endocrinol. Metab. 2022. 107(2). 309-323. doi:10.1210/clinem/dgab687.
- Zhou S., Lu D., Wen S., Sheng Y., Kang D., Xu L. Elevated Anti-Müllerian Hormone Levels in Newborns of Women with Polycystic Ovary Syndrome: a Systematic Review and Meta-analysis Based on Observational Studies. Reprod. Sci. 2022. 29(1). 301-311. doi:10.1007/s43032-021-00652-w.
- Ahmed N., Batarfi A.A., Bajouh O.S., Bakhashab S. Serum Anti-Müllerian Hormone in the Diagnosis of Polycystic Ovary Syndrome in Association with Clinical Symptoms. Diagnostics (Basel). 2019. 9(4). 136. doi: 10.3390/diagnostics9040136.
- Gorsic L.K., Kosova G., Werstein B., et al. Pathogenic Anti-Müllerian Hormone Variants in Polycystic Ovary Syndrome. J. Clin. Endocrinol. Metab. 2017. 102(8). 2862-2872. doi:10.1210/jc.2017-00612.
- Sahmay S., Atakul N., Aydogan B., Aydin Y., Imamoglu M., Seyisoglu H. Elevated serum levels of anti-Müllerian hormone can be introduced as a new diagnostic marker for polycystic ovary syndrome. Acta Obstet. Gynecol. Scand. 2013. 92. 1369-74. https://doi.org/10.1111/aogs.12247 PMid:23980726.
- Owens L.A., Kristensen S.G., Lerner A., et al. Gene Expression in Granulosa Cells From Small Antral Follicles From Women With or Without Polycystic Ovaries. J. Clin. Endocrinol. Metab. 2019. 104(12). 6182-6192. doi:10.1210/jc.2019-00780.
- Pigny P., Jonard S., Robert Y., Dewailly D. Serum anti-Mullerian hormone as a surrogate for antral follicle count for definition of the polycystic ovary syndrome. J. Clin. Endocrinol. Metab. 2006. 91. 941-945. https://doi.org/10.1210/jc.2005-2076 PMid:16368745.
- Dewailly D., Barbotin A.L., Dumont A., Catteau-Jonard S., Robin G. Role of Anti-Müllerian Hormone in the Pathogenesis of Polycystic Ovary Syndrome. Front. Endocrinol. (Lausanne). 2020. 11. 641. doi:10.3389/fendo.2020.00641.
- Hagen C.P., Aksglaede L., Sørensen K., et al. Individual levels of antimullerian hormone in the serum of healthy girls are maintained in childhood and adolescence: a longitudinal cohort study. Hum. Reprod. 2012. 27(3). 861-866. doi: 10.1093/humrep/der435.
- Hart R., Doherty D.A., Norman R.J., Franks S., Dickinson J.E., Hickey M., Sloboda D.M. Serum antimullerian hormone (AMH) levels are elevated in adolescent girls with polycystic ovaries and the polycystic ovarian syndrome (PCOS). Fertil. Steril. 2010. 94(3). 1118-21. doi: 10.1016/j.fertnstert.2009.11.002.
- Song D.K., Oh J.Y., Lee H., Sung Y.A. Differentiation between polycystic ovary syndrome and polycystic ovarian morphology by means of an anti-Müllerian hormone cutoff value. Korean J. Intern. Med. 2017. 32(4). 690-698. doi: 10.3904/kjim.2016.038.

/31.jpg)
/32.jpg)