Международный эндокринологический журнал Том 18, №3, 2022
Вернуться к номеру
Клінічний випадок масивної тромбоемболії легеневої артерії у молодого чоловіка з ожирінням
Авторы: Нетяженко В.З., Мальчевська Т.Й., Шкала Л.В., Пузанова О.Г., Алтуніна Н.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Тромбоемболія легеневої артерії (ТЕЛА) — один із небагатьох життєзагрозливих станів. На сьогодні за умов меншої рухливості людей в силу професійної їх діяльності (тривале сидіння за комп’ютером) і соціальної поведінки зросла кількість випадків венозного тромбоемболізму. Рекомендації Європейського товариства кардіологів з ТЕЛА (2008, 2014, 2019 рр.) стали потужним інструментом щодо діагностики, лікування і стратифікації ризику смертельних наслідків. Профілактика рецидиву тромбоемболічних ускладнень і її тривалість залежить від факту спровокованості ТЕЛА. Рекомендаціями у розвитку тромбоемболічних ускладнень враховується наявність серцевої недостатності, ішемічної хвороби серця, фібриляції передсердь, що певною мірою стирає відмінності між артеріальними і венозними тромбозами. Факт зростання випадків ТЕЛА з віком є незаперечним, проте на відміну від атеротромбозу венозні тромбози виникають набагато раніше, у молодшій популяції. Таким чином, венозні тромбози є дещо «молодшими» за артеріальні. Стосовно гендерних відмінностей, то з віком ТЕЛА частіше трапляється у чоловіків, у жінок спостерігається тенденція до «омолодження» ТЕЛА. Неабияку роль в цьому відіграють прийом контрацептивів, ризики венозного тромбоемболізму несуть вагітність, пологи. Хоча менш впливовими в розвитку венозного тромбоемболізму і ТЕЛА вважаються ліжковий режим (більше ніж три дні), знерухомлення у сидячому положенні (тривалий переліт, поїздка в автомобілі), похилий вік, у реальній клінічній практиці не слід нехтувати лапароскопічними операціями та супутніми станами — ожирінням, цукровим діабетом, артеріальною гіпертензією і варикозним розширенням вен. При найменшій підозрі на ТЕЛА важливим є врахування лікарем вищезазначених чинників. Чіткий алгоритм діагностики і своєчасне лікування забезпечать ефективність ведення таких хворих і процес їх одужання. Останніми роками ожиріння як чинник низькоінтенсивного запалення стали вважати причетним до процесів підвищеного тромбоутворення. І хоча з’ясовані певні механізми тромбоутворення при ожирінні, до кінця незрозумілими залишаються часті фатальні тромботичні наслідки тяжкого перебігу COVID-19, переважно у категорії пацієнтів із ожирінням, порушенням вуглеводного обміну, цукровим діабетом. Наведеним клінічним випадком автори продемонструвати сумарну стратифікацію чинників ризику навіть, на перший погляд, несуттєвого впливу ожиріння І ст., але в поєднанні із варикозною хворобою нижніх кінцівок, що стало причиною масивної ТЕЛА із зупинкою серця у молодого чоловіка.
Pulmonary artery thromboembolism is one of the few life-threatening conditions. Today, with less mobility due to their professional activities (prolonged sitting at a computer) and social behavior, the number of cases of venous thromboembolism has increased. The recommendations of the European Society of Cardiology for pulmonary embolism (2008, 2014, 2019) have become a powerful tool for diagnosing, treating and stratifying the risk of death. Prevention of recurrence of thromboembolic complications and its duration depends on the fact of provocation of pulmonary embolism. Recommendations for the development of thromboembolic complications take into account the presence of heart failure, coronary heart disease, atrial fibrillation (AF), which to some extent blurs the distinction between arterial and venous thrombosis. The fact that the incidence of pulmonary embolism increases with age is indisputable, but in contrast to atherothrombosis, venous thrombosis occurs much earlier, in the younger population. Thus, venous thrombosis is somewhat “younger” than arterial. Regarding gender differences, it is more common in men with age, and women tend to “rejuvenate”. Contraceptives play an important role in this, the risks of venous thromboembolism are pregnancy and childbirth. Although less influential in the development of venous thromboembolism and pulmonary embolism are bed rest (more than three days), immobilization in a sitting position (long flight, car trip), old age, in real clinical practice should not be neglected laparoscopic surgery and concomitant conditions — obesity, diabetes mellitus, hypertension and varicose veins. At the slightest suspicion of pulmonary embolism, it is important for the physician to consider the above factors. A clear algorithm for diagnosis and timely treatment will ensure the effectiveness of such patients and the process of their recovery. In recent years, obesity at the angle of low-intensity inflammation began to be considered involved in the processes of increased thrombosis. Although certain mechanisms of thrombosis in obesity have been elucidated, the frequent fatal thrombotic consequences of severe COVID-19 remain unclear, mainly in the category of patients with obesity, carbohydrate metabolism disorders, and diabetes. In this clinical case, the authors demonstrate the total stratification of risk factors, even at first glance insignificant effects of obesity of the first degree, but in combination with varicose veins of the lower extremities, which caused massive pulmonary embolism in young men.
тромбоемболія легеневої артерії; венозний тромбоз; високий ризик; тромболітична терапія; антикоагулянти; ожиріння
pulmonary embolism; venous thrombosis; high risk; thrombolytic therapy; anticoagulants; obesity
Вступ
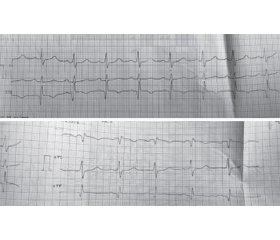
Опис клінічного випадку
Висновки
- Blokhin I.O., Lentz S.R. Mechanisms of thrombosis in obesity. Curr. Opin. Hematol. 2013 Sep. 20(5). 437-44. doi: 10.1097/MOH.0b013e3283634443.
- Ansell J., Hirsh J., Hylek E., Jacobson A., Crowther M., Palareti G. Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008. 133(6 Suppl). 160S-198S. doi: 10.1378/chest.08-0670.
- Bĕlohlávek J., Dytrych V., Linhart A. Pulmonary embolism, part I: Epidemiology, risk factors and risk stratification, pathophysiology, clinical presentation, diagnosis and nonthrombotic pulmonary embolism. Exp. Clin. Cardiol. 2013. 18(2). 129-38. PMID: 23940438; PMCID: PMC3718593.
- Witt D.M., Nieuwlaat R., Clark N.P., Ansell J., Holbrook A., Skov J., Shehab N., et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: optimal management of anticoagulation therapy. Blood Adv. 2018. 2(22). 3257-3291. doi: 10.1182/bloodadvances.2018024893.
- Darvall K.A.L., Sam R.C., Silverman S.H., Bradbury A.W., Adam D.J. Obesity and thrombosis. European Journal of Vascular and Endovascular Surgery. 2007. 33(2). 223-233. https://doi.org/10.1016/j.ejvs.2006.10.006.
- Hewitt M., Devine C., Gonzalez L. Pulmonary embolism in young adults (18-45 years). Eur. J. Intern. Med. 2018. 54. e23-e24. doi: 10.1016/j.ejim.2018.05.035.
- Goldhaber S.Z., Savage D.D., Garrison R.J., Castelli W.P., Kannel W.B., McNamara P.M., Gherardi G., Feinleib M. Risk factors for pulmonary embolism. The Framingham Study. Am. J. Med. 1983. 74(6). 1023-8. doi: 10.1016/0002-9343(83)90805-7.
- Holbrook A., Schulman S., Witt D.M., Vandvik P.O., Fish J., Kovacs M.J., Svensson P.J., et al. Evidence-based management of anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012. 141(2 Suppl). e152S-e184S. doi: 10.1378/chest.11-2295.
- Schünemann H.J., Cushman M., Burnett A.E., Kahn S.R., Beyer-Westendorf J., Spencer F.A., Rezende S.M., et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. Blood Adv. 2018. 2(22). 3198-3225. doi: 10.1182/bloodadvances.2018022954.
- Smythe M.A., Priziola J., Dobesh P.P., Wirth D., Cuker A., Wittkowsky A.K. Guidance for the practical management of the heparin anticoagulants in the treatment of venous thromboembolism. J. Thromb. Thrombolysis. 2016. 41(1). 165-86. doi: 10.1007/s11239-015-1315-2.
- Movahed M.R., Khoubyari R., Hashemzadeh M., Hashemzadeh M. Obesity is strongly and independently associated with a higher prevalence of pulmonary embolism. Respir. Investig. 2019. 57(4). 376-379. doi: 10.1016/j.resinv.2019.01.003.
- Plu-Bureau G., Maitrot-Mantelet L., Hugon-Rodin J., Canonico M. Hormonal contraceptives and venous thromboembolism: an epidemiological update. Best Pract. Res. Clin. Endocrinol. Metab. 2013. 27(1). 25-34. doi: 10.1016/j.beem.2012.11.002.
- Konstantinides S.V., Meyer G., Becattini C., Bueno H., Geersing G.J., Harjola V.P., Huisman M.V., et al.; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur. Heart J. 2020. 41(4). 543-603. doi: 10.1093/eurheartj/ehz405.
- Park M.J., Jeon G.H. Pulmonary embolism in a healthy woman using the oral contraceptives containing desogestrel. Obstet. Gynecol. Sci. 2017. 60(2). 232-235. doi: 10.5468/ogs.2017.60.2.232.

/57.jpg)