Журнал «Почки» Том 11, №3, 2022
Вернуться к номеру
Хронобіологічні аспекти діяльності видільної системи (огляд літератури)
Авторы: Безрук В.В. (1), Іванов Д.Д. (2), Шкробанець І.Д. (3)
(1) — Буковинський державний медичний університет, м. Чернівці, Україна
(2) — Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(3) — Національна академія медичних наук України, м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
У статті розглядаються питання функціонування циркадних ритмів і їх значення в регуляції фізіологічних процесів у видільній системі. Приділяється увага питанням десинхронозу, його причинам і впливу на фізіологічні процеси діяльності видільної системи в дітей. Показана практична значимість хронобіологічних аспектів, залежність їх від індивідуальних і популяційних факторів, динамічність таких порушень і їх актуальність у віковому аспекті. Підкреслено значущість хронобіологічних аспектів діяльності видільної системи й доцільність продовження науково-практичних досліджень у цьому напрямку медичної науки.
The paper examines the issues of circadian rhythms functioning and their significance in the regulation of physiological processes of the excretory system. The article deals with the issue of desynchronosis, its causes and effects on the physiological processes of the excretory system in children. The practical significance of chronobiological aspects, their dependence on both individual and population factors, the dynamism of such disturbances and their relevance in the age aspect are shown. The value of chronobiological aspects in the functioning of the excretory system and the expediency of continuing scientific and practical research in this direction of medical science were emphasized.
циркадні ритми; десинхроноз; видільна система; діти
circadian rhythms; desynchronosis; excretory system; children
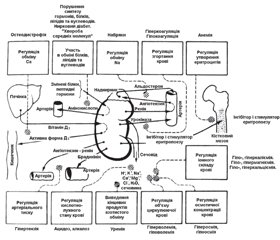
Висновки
- Krishtal N.V., Gozhenko A.I. Pathophysiology of The Kidneys. Pathophysiology: Textbook. Kyiv: AUS Medicine Publishing, 2017. P. 508-565.
- Ivanov D.D. When should we start using angiotensin converting enzyme ingibitors/angiotensin receptor blockers in diabetic kidney disease? Kidney. 2017. Vol. 6. № 1. P. 12-16.
- Woolf A.S. Growing a new human kidney. Kidney Int. 2019 Oct. 96(4). 871-882. doi: 10.1016/j.kint.2019.04.040. Epub 2019 May 25. PMID: 31399199; PMCID: PMC6856720.
- Zhang W.R., Parikh C.R. Biomarkers of Acute and Chronic Kidney Disease. Annu Rev. Physiol. 2019 Feb 10. 81. 309-333. doi: 10.1146/annurev-physiol-020518-114605. PMID: 30742783; PMCID: PMC7879424.
- Haffner D., Grund A., Leifheit-Nestler M. Renal effects of growth hormone in health and in kidney disease. Pediatr. Nephrol. 2021 Aug. 36(8). 2511-2530. doi: 10.1007/s00467-021-05097-6. Epub 2021 Jun 18. PMID: 34143299; PMCID: PMC8260426.
- Legrand M., Bell S., Forni L., Joannidis M., Koyner J.L., Liu K., Cantaluppi V. Pathophysiology of COVID-19-associated acute kidney injury. Nat. Rev. Nephrol. 2021 Nov. 17(11). 751-764. doi: 10.1038/s41581-021-00452-0. Epub 2021 Jul 5. PMID: 34226718; PMCID: PMC8256398.
- Imenez Silva P.H., Mohebbi N. Kidney metabolism and acid-base control: back to the basics. Pflugers Arch. 2022 Aug. 474(8). 919-934. doi: 10.1007/s00424-022-02696-6. Epub 2022 May 5. PMID: 35513635; PMCID: PMC9338915.
- Kuhlman S.J., Craig L.M., Duffy J.F. Introduction to Chronobiology. Cold Spring Harb. Perspect. Biol. 2018 Sep 4. 10(9). a033613. doi: 10.1101/cshperspect.a033613. PMID: 29038118; PMCID: PMC6120700.
- Ballesta A., Innominato P.F., Dallmann R., Rand D.A., Lévi F.A. Systems Chronotherapeutics. Pharmacol. Rev. 2017 Apr. 69(2). 161-199. doi: 10.1124/pr.116.013441. PMID: 28351863; PMCID: PMC5394920.
- Buijs F.N., León-Mercado L., Guzmán-Ruiz M., Guerrero-Vargas N.N., Romo-Nava F., Buijs R.M. The Circadian System: A Regulatory Feedback Network of Periphery and Brain. Physiology (Bethesda). 2016 May. 31(3). 170-81. doi: 10.1152/physiol.00037.2015. PMID: 27053731.
- Chang A.M., Bjonnes A.C., Aeschbach D., Buxton O.M., Gooley J.J., Anderson C. et al. Circadian gene variants influence sleep and the sleep electroencephalogram in humans. Chronobiol. Int. 2016. 33(5). 561-73. doi: 10.3109/07420528.2016.1167078. Epub 2016 Apr 18. PMID: 27089043; PMCID: PMC5267557.
- Dallmann R., Okyar A., Lévi F. Dosing-Time Makes the Poison: Circadian Regulation and Pharmacotherapy. Trends Mol. Med. 2016 May. 22(5). 430-445. doi: 10.1016/j.molmed.2016.03.004. Epub 2016 Apr 5. PMID: 27066876.
- Marcheva B., Ramsey K.M., Peek C.B., Affinati A., Maury E., Bass J. Circadian clocks and metabolism. Handb. Exp. Pharmacol. 2013. (217). 127-55. doi: 10.1007/978-3-642-25950-0_6.
- Baron K.G., Reid K.J. Circadian misalignment and health. Int. Rev. Psychiatry. 2014. 26(2). 139-154. doi: 10.3109/09540261.2014.911149.
- Burgess H.J., Emens J.S. Circadian-based therapies for circadian rhythm sleep- wake disorders. Curr. Sleep Med. Rep. 2016 Sep. 2(3). 158-165. Published online 2016 Jul 2. doi: 10.1007/s40675-016-0052-1.
- Zhou D., Wang Y., Chen L., Jia L., Yuan J. Evolving roles of circadian rhythms in liver homeostasis and pathology. Oncotarget. 2016 Feb 23. 7(8). 8625-8639. doi: 10.18632/oncotarget.7065.
- Ohdo S., Koyanagi S., Matsunaga N. Chronopharmacological strategies focused on chrono-drug discovery. Pharmacol. Ther. 2019 Oct. 202. 72-90. doi: 10.1016/j.pharmthera.2019.05.018. Epub 2019 Jun 5. PMID: 31173839.
- Dong D., Yang D., Lin L., Wang S., Wu B. Circadian rhythm in pharmacokinetics and its relevance to chronotherapy. Biochem. Pharmacol. 2020 Aug. 178. 114045. doi: 10.1016/j.bcp.2020.114045. Epub 2020 May 22. PMID: 32446886.
- Ohdo S. Chrono-Drug Discovery and Development Based on Circadian Rhythm of Molecular, Cellular and Organ Level. Biol. Pharm. Bull. 2021. 44(6). 747-761. doi: 10.1248/bpb.b21-00277. PMID: 34078807.
- Ayyar V.S., Sukumaran S. Circadian rhythms: influence on physiology, pharmacology, and therapeutic interventions. J. Pharmacokinet. Pharmacodyn. 2021 Jun. 48(3). 321-338. doi: 10.1007/s10928-021-09751-2. Epub 2021 Apr 1. PMID: 33797011; PMCID: PMC8015932.
- Zhang D., Pollock D.M. Circadian regulation of kidney function: finding a role for Bmal1. Am. J. Physiol. Renal Physiol. 2018 May 1. 314(5). F675-F678. doi: 10.1152/ajprenal.00580.2017. Epub 2017 Dec 20. PMID: 29357439; PMCID: PMC6031908.
- Johnston J.G., Pollock D.M. Circadian regulation of renal function. Free Radic. Biol. Med. 2018 May 1. 119. 93-107. doi: 10.1016/j.freeradbiomed.2018.01.018. Epub 2018 Jan 31. PMID: 29360554; PMCID: PMC6052790.
- Dan H., Ruan T., Sampogna R.V. Circadian Clock Regulation of Developmental Time in the Kidney. Cell. Rep. 2020 May 19. 31(7). 107661. doi: 10.1016/j.celrep.2020.107661. PMID: 32433970; PMCID: PMC7294772.
- Mace M.L., Olgaard K., Lewin E. New Aspects of the Kidney in the Regulation of Fibroblast Growth Factor 23 (FGF23) and Mineral Homeostasis. Int. J. Mol. Sci. 2020 Nov 20. 21(22). 8810. doi: 10.3390/ijms21228810. PMID: 33233840; PMCID: PMC7699902.
- Egstrand S., Mace M.L., Olgaard K., Lewin E. The Vascular Circadian Clock in Chronic Kidney Disease. Cells. 2021 Jul 13. 10(7). 1769. doi: 10.3390/cells10071769. PMID: 34359937; PMCID: PMC8306728.
- Costello H.M., Johnston J.G., Juffre A., Crislip G.R., Gumz M.L. Circadian clocks of the kidney: function, mechanism, and regulation. Physiol. Rev. 2022 Oct 1. 102(4). 1669-1701. doi: 10.1152/physrev.00045.2021. Epub 2022 May 16. PMID: 35575250; PMCID: PMC9273266.
- Costello H.M., Gumz M.L. Circadian Rhythm, Clock Genes, and Hypertension: Recent Advances in Hypertension. Hypertension. 2021 Nov. 78(5). 1185-1196. doi: 10.1161/HYPERTENSIONAHA.121.14519.
- Douma L.G., Gumz M.L. Circadian clock-mediated regulation of blood pressure. Free Radic. Biol. Med. 2018 May 1. 119. 108-114. doi: 10.1016/j.freeradbiomed.2017.11.024.
- Soliman R.H., Pollock D.M. Circadian Control of Sodium and Blood Pressure Regulation. Am. J. Hypertens. 2021 Jun 24. hpab100. doi: 10.1093/ajh/hpab100.
- Soliman R.H., Jin C., Taylor C.M., Moura Coelho da Silva E., Pollock D.M. Sex Differences in Diurnal Sodium Handling During Diet-Induced Obesity in Rats. Hypertension. 2022 Jul. 79(7). 1395-1408. doi: 10.1161/HYPERTENSIONAHA.121.18690.
- Douma L.G., Costello H.M., Crislip G.R., Cheng K.Y., Lynch I.J., Juffre A. et al. Kidney-specific KO of the circadian clock protein PER1 alters renal Na+ handling, aldosterone levels, and kidney/adrenal gene expression. Am. J. Physiol. Renal Physiol. 2022 Apr 1. 322(4). F449-F459. doi: 10.1152/ajprenal.00385.2021.
- Mitsnefes M., Flynn J., Cohn S., Samuels J. Masked hypertension associates with left ventricular hypertrophy in children with CKD. J. Am. Soc. Nephrol. 2010 Jan. 21(1). 137-144. doi: 10.1681/ASN.2009060609.
- Van DeVoorde R.G., Mitsnefes M.M. Hypertension in chronic kidney disease: role of ambulatory blood pressure monitoring. Prog. Pediatr. Cardiol. 2016 Jun. 41. 67-73. doi: 10.1016/j.ppedcard.2015.12.001.
- Gallibois C.M., Jawa N.A., Noone D.J. Hypertension in pediatric patients with chronic kidney disease: management challenges. Int. J. Nephrol. Renovasc. Dis. 2017. 10. 205-213. Published online 2017 Jul 26. doi: 10.2147/IJNRD.S100891.
- Nickel N.P., O’Leary J.M., Brittain E.L., Fessel J.P., Zamanian R.T., West J.D., Austin E.D. Kidney dysfunction in patients with pulmonary arterial hypertension. Pulm. Circ. 2017 Mar. 7(1). 38-54. Published online 2017 Mar 13. doi: 10.1086/690018.
- Samuels J., Ng D., Flynn J.T., Mitsnefes M. Ambulatory blood pressure patterns in children with chronic kidney disease. Hypertension. 2012 Jul. 60(1). 43-50. doi: 10.1161/HYPERTENSIONAHA.111.189266.
- Gupta D., Chaturvedi S., Chandy S., Agarwal I. Role of 24-h ambulatory blood pressure monitoring in children with chronic kidney disease. Indian J. Nephrol. 2015 Nov-Dec. 25(6). 355-361. doi: 10.4103/0971-4065.148305.
- Ješić M., Sajić S., Ješić M., Kostić M., Peco-Antić A. Microalbuminuria in relation to metabolic control and blood pressure in adolescents with type 1 diabetes. Arch. Med. Sci. 2011 Dec 31. 7(6). 1037-1041. doi: 10.5114/aoms.2011.26617.
- Tankeu A.T., Kaze F.F., Noubiap J.J., Chelo D., Dehayem M.Y., Sobngwi E. Exercise-induced albuminuria and circadian blood pressure abnormalities in type 2 diabetes. World J. Nephrol. 2017 Jul 6. 6(4). 209-216. doi: 10.5527/wjn.v6.i4.209.
- Rahman A., Hasan A.U., Nishiyama A., Kobori H. Altered circadian timing system-mediated non-dipping pattern of blood pressure and associated cardiovascular disorders in metabolic and kidney diseases. Int. J. Mol. Sci. 2018 Feb. 19(2). 400. doi: 10.3390/ijms19020400.
- Підмурняк О.Я. Особливості циркадіанних ритмів діяльності серцево-судинної системи у дітей з її патологією у патогенезі захворювань. Дис. … д-ра філософії за спец. 14.01.10 — педіатрія (222 — медицина). Чернівці: Буковинський державний медичний університет, 2021.
- Montgomery-Downs H.E., Crabtree V.M., Sans Capdevila O., Gozal D. Infant- feeding methods and childhood sleep-disordered breathing. Pediatrics. 2007. 120(5). 1030-5.
- Morris C.J., Purvis T.E., Hu K., Scheer F.A. Circadian misalignment increases cardiovascular disease risk factors in humans. Proc. Natl Acad. Sci USA. 2016 Mar 8. 113(10). E1402-E1411. doi: 10.1073/pnas.1516953113.
- Smith M.T., McCrae C.S., Cheung J., Martin J.L, Harrod C.G. Use of actigraphy for the evaluation of sleep disorders and circadian rhythm sleep-wake disorders: an American Academy of Sleep Medicine systematic review, meta-analysis, and GRADE assessment. J. Clin. Sleep Med. 2018 Jul 15. 14(7). 1209-1230. doi: 10.5664/jcsm.7228.
- Ivanov D.D., Kuryata O.V., Garmysh I.P. Renin angiotensin-aldosterone system blockers: chronic kidney disease and cardiovascular risk. Kidney. 2018. 7(2). 13-23.

/86.jpg)