Вступ
Діабетична ретинопатія (ДР) є одним з найчастіших ускладнень діабету й основною причиною сліпоти в людей працездатного віку [1]. Пацієнти з цукровим діабетом 2-го типу (ЦД2) зазвичай мають фонову ретинопатію на момент встановлення діагнозу діабету, але більше ніж у 60 % розвинеться та чи інша форма ретинопатії протягом 20 років [2]. За даними Міжнародної діабетичної федерації (IDF-Atlas, 4-те вид., 2009 р.), у даний час від ЦД страждають майже 285 млн осіб у всьому світі, і очікується, що до 2030 року це число сягне 438 млн [1]. Отже, проблема розвитку ДР і профілактики ускладнень не втрачає своєї актуальності.
Фолат є водорозчинним вітаміном В і критично важливий для здоров’я як кофактор у безлічі біохімічних реакцій, а головне, необхідний для біосинтезу нуклеотидів і метіоніну [3]. Фолієва кислота відіграє важливу роль донора L-вуглецю для метилювання й синтезу ДНК-РНК, і її дефіцит може впливати на стабільність і цілісність ДНК, а також підсилювати метилювання, з чим пов’язаний ризик розвитку діабетичної ретинопатії [3].
Дефіцит вітамінів групи В і фолієвої кислоти зазвичай пов’язаний з високим рівнем циркулюючого гомоцистеїну. Фолієва кислота і вітаміни групи В надходять до організму з їжею, особливо з фруктами й овочами. Дослідники вивчають різні напрямки дієти, які б сприяли підвищенню рівня фолатів і вітамінів. Planells і спів–авт. провели оцінку харчування за вітамінами B6, B12 і фолієвою кислотою серед дорослого населення Середземномор’я, щоб визначити варіанти харчування, групи ризику дефіциту і фактори, які можуть впливати на цей ризик [4]. Польські дослідники за результатами епідеміологічного дослідження дійшли висновку, що в населення було звичним явищем недостатнє споживання фолієвої кислоти (дефіцит відзначений майже у 80–90 % населення) і більшість суб’єктів не виконували рекомендації щодо споживання вітамінів B6 і B12 [5].
У попередніх дослідженнях нашої наукової школи ми аналізували за допомогою анкетування харчові звички й раціон харчування пацієнтів з різними стадіями ретинопатії порівняно зі здоровим населенням [6]. У групах здорових осіб і пацієнтів із ЦД2 була виявлена відмінність щодо звички вживання фруктів у щоденному раціоні. І також була доведена відмінність щодо вживання фруктів у групах пацієнтів із різними стадіями ДР. Звичка збагачувати фруктами свій раціон зменшувалася прямо пропорційно від здорових осіб до групи з найтяжкою формою ДР. Отримані дані дали нам підставу сформувати рекомендацію для пацієнтів із ДР при ЦД2 щодо збагачення раціону харчування фруктами й овочами і розглядати цю пораду як профілактичний засіб щодо розвитку захворювання [6]. Однак немає достатньо даних про те, що призначення препарату фолієвої кислоти, а також вітамінів цієї групи пацієнтам із ЦД2 ефективно знижує в них рівень гомоцистеїну. Водночас є дані про тісну асоціацію біохімічних порушень у вигляді гіпергомоцистеїнемії, дефіциту вітамінів В12, В6, фолієвої кислоти, вітаміну D3, гіперкреатинінемії, підвищення сироваткової концентрації лактатдегідрогенази і креатинфосфокінази з патогенними поліморфними замінами нуклеотидів у генах ензимів фолатного циклу [7–9].
Вивчення генетичних варіантів, що впливають на рівень циркулюючих вітамінів групи В, може дати підґрунтя для розуміння взаємозв’язку дієти, генетики і здоров’я людини. На сьогодні найбільш вивченим є поліморфізм С677Т гена rs1801133 (MTHFR). Вважають, що носії алелі T мають більш високі концентрації гомоцистеїну і нижчій рівень метилювання геномної ДНК [10]. Однак дані про генетичні варіації в інших генах, які вивчали в асоціації з концентрацією вітамінів B, фолієвої кислоти, гомоцистеїну, є суперечливими [8, 9, 11].
Мета дослідження: вивчити асоціації поліморфізмів основних генів, що кодують ферменти фолатного циклу: MTHFR C677T (rs1801133), MTHFR A1298C (rs1801131), MTR A2756G (rs1805087), з умістом у плазмі крові вітамінів групи В у пацієнтів з діабетичною ретинопатією і цукровим діабетом 2-го типу.
Матеріали та методи
Дослідження включало 83 пацієнтів (83 ока) із ЦД2, у яких за результатами офтальмологічного обстеження виявлено різні стадії ДР.
Усі дослідження виконували відповідно до етичних стандартів Гельсінської декларації (1964 р., з поправками) і з дозволу Комітету з біоетики Національного університету охорони здоров’я України імені П.Л. Шупика.
Усі пацієнти дали інформовану згоду на участь у дослідженні.
Усім пацієнтам були виконані обстеження відповідно до протоколу ETDRS: візометрія, рефрактометрія, статична периметрія Humphrey, тонометрія, біомікроскопія, за необхідності — гоніоскопія, офтальмоскопія за допомогою асферичних безконтактних лінз і лінзи Goldman, оптична когерентна томографія на OCT DRI Triton (Topcon, Японія) у режимі macula, також проводилось обстеження очного дна за допомогою фундус-камери. Флюоресцентну ангіографію виконували за показаннями.
Стадії ДР визначали за шкалою ETDRS, що дало нам змогу визначити дві групи спостереження, які відрізнялися за ступенем ушкодження: група НПДР (43 пацієнти, 43 ока), до якої включили пацієнтів з початковою, помірною і тяжкою непроліферативною ДР, і група ПДР (40 пацієнтів, 40 очей), у яку увійшли пацієнти з початковою, помірною, тяжкою і прогресуючою проліферативною ДР. У всіх пацієнтів досліджувався рівень гормонів щитоподібної залози для виключення наявності гормональних порушень.
Контрольну групу (КГ) становили 35 осіб без ЦД, які не мали діагностованих порушень метаболізму й звернулися з метою профілактичного огляду в клініко-діагностичну лабораторію Університетської клініки НМУ імені О.О. Богомольця.
Молекулярно-генетичні дослідження виконували в лабораторії Науково-дослідного інституту експериментальної і клінічної медицини НМУ імені О.О. Богомольця за стандартними методиками. Уміст фолатів і вітамінів В12, В6 визначали в плазмі крові методом твердофазного імуноферментного аналізу (ІФА, ELISA) на напівавтоматичному аналізаторі RT2100C (RAYTO) (Китай) із використанням інкубатора-шейкера для мікропланшетів PST-60HL-4 (BioSun) (Латвія) і автоматичного планшетного промивача — вошера Bio-Rad PW40 за допомогою наборів: тест-системи Фолати AccuBind® ІФА (Monobind, США, код набору 7525-300, чутливість 0,52 нг/мл); тест-системи Вітамін В12 AccuBind® ІФА (Monobind, США, код набору 7625-300, чутливість 70,13 пг/мл); тест-системи VB6 (Vitamin B6) ELISA Kit (Elabcsience, США, Catalog No: E-EL-0008, чутливість 0,94 нг/мл).
Для дослідження була використана венозна кров. Забір проводили в умовах маніпуляційного кабінету в пробірки з фіолетовою кришкою об’ємом 4 мл, що містили EDTA-К3 як антикоагулянт. Після центрифугування відбирали плазму в окрему пробірку типу Епендорф для дослідження ІФА, а осад (шар із клітинами) залишали для генетичних досліджень. Матеріал маркували й заморожували при температурі –20 °С. Для виділення геномної ДНК використовували набори PureLink® Genomic DNA Kits For purification of genomic DNA, виробник Invitrogen (США). На першому етапі проводили інкубацію з Digestion Buffer і протеїназою К і шляхом центрифугування позбавлялись продуктів денатурації і лізису, з метою запобігання контамінації додатково інкубували з РНКазою. Для аналізу поліморфних ДНК-локусів використовували уніфіковані тест-системи TaqMan Mutation Detection Assays Life-Technology (США). Досліджували поліморфізми наступної локалізації: MTHFR C677T (rs1801133), MTHFR A1298C (rs1801131), MTR A2756G (rs1805087). Інкубацію досліджуваного матеріалу проводили із системою праймерів, які фланкують ділянки ДНК генів, що аналізуються, у присутності ДНК-полімерази в автоматичному ампліфікаторі Gene Amp® PCR System 7500 (Applied Biosystems, США). За допомогою синхронізованої з ампліфікатором програми RealTime_PCR оброблялись одержані дані.
Статистичний аналіз даних проводився за допомогою пакета IBM SPSS Statistics 23 і програми MedStat. Перевірку розподілу кількісних показників по всій вибірці даних на відповідність закону Гауса проводили за допомогою одновибіркового критерію Шапіро — Уїлка. Більшість параметрів не відображали нормальний розподіл, тому використовували непараметричні критерії. Дані в групах порівнювали за допомогою рангового однофакторного аналізу за критерієм Крускала — Уолліса з урахуванням поправки Бонфероні. Відмінності в групах вказували у вигляді р із зазначенням рівня значущості. Вважали, що дані відрізняються при р < 0,05. Для опису даних у групах наводили значення медіани (Ме) і середньоквадратичного відхилення (σ). Для інтервальної оцінки медіани розраховували 95% довірчий інтервал (ДІ). Діаграми подавали у вигляді стовпчиків і вказували 95% ДІ або Box-and-Whisker plot, де центральна коробка являє собою значення від нижнього до верхнього квартиля (від 25-го до 75-го процентилів). Середня лінія становить собою медіану. Рядок простягається від мінімального до максимального значення, виключаючи значення «назовні» і «далеко», які відображаються як окремі точки.
Результати та обговорення
Аналіз розподілу частоти зустрічальності алелей і генотипів генів rs1801133, rs1805087, rs1801131 у дослідних групах показав відсутність зв’язку поліморфізмів основних генів, що кодують ферменти фолатного циклу, із розвитком ДР при ЦД2 порівняно з особами без діабету.
Виявлено, що в КГ переважають особи з поліморфізмом гена MTHFR C677T (rs1801133) і гетерогенним генотипом СТ (58 %), частка носіїв генотипу СС становить 25 %, а ТТ — 17 %. У групі пацієнтів зберігається перевага носіїв гетерогенного генотипу СТ (49 %), але їх частина зменшена порівняно з КГ за рахунок збільшення числа осіб з генотипом СС (45 %), і суттєво зменшена доля носіїв генотипу ТТ — 6 %.
В осіб КГ зустрічався лише мажорний генотип гена MTR A2756G (rs1805087) — АА у 70 %, а в 30 % — гетерогенний генотип АG. У хворих також переважав генотип АА (60 %), 35 % осіб мали генотип АG, але в 5 % пацієнтів із ДР/ЦД2 був виявлений генотип GG.
В осіб КГ переважним генотипом гена MTHFR A1298C (rs1801131) є гетерогенний генотип АС, який мають 50 % осіб. Генотип АА зустрічався у 45 % осіб, а генотип СС — у 5 %. У хворих розподіл був схожий, переважали особи з генотипом АС (53 %). Генотип АА спостерігали в 34 % пацієнтів із ДР, і 13 % мали генотип СС.
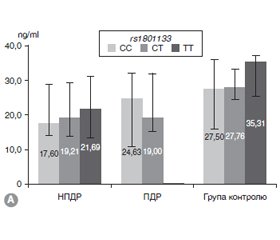
Аналіз умісту вітамінів групи В у крові досліджуваних осіб виявив вірогідне зниження в пацієнтів із ДР/ЦД2 фолатів у 1,4 раза (р < 0,05), вітаміну В12 — у 1,6 раза (р < 0,05), вітаміну В6 — у 1,6 раза (р < 0,05) відносно відповідних показників КГ. Значення вказаних показників наведені в табл. 1, де також вказані значення в групах пацієнтів, які розрізнялися за ступенем ушкодження сітківки від дуже м’якої НПДР до розвинутої ПДР. Як видно з табл. 1, практично за всіма показниками ми спостерігали тенденцію до збільшення дефіциту вітамінів відповідно до погіршення стану і розвитку ДР. Аналіз показників фолатів у крові пацієнтів показав зниження на 30 % (р < 0,05) у групі ПДР високого ризику і на 36 % (р < 0,05) — у групі розвинутої ПДР порівняно з КГ. Уміст вітаміну В12 був вірогідно зменшеним порівняно з контролем в усіх групах пацієнтів. За даними вмісту вітаміну В6, вірогідні відмінності на 50 % (р < 0,05) спостерігали в групі дуже м’якої НПДР.
/26.jpg)
Слід зазначити, що варіаційний ряд у кожній групі мав високу дисперсію, особливо в групі НПДР, що наочно відображають діаграми (рис. 1).
Отже, при ЦД2 у пацієнтів з ретинопатією виявлений дефіцит вітамінів групи В. Уміст фолатів більшою мірою знижувався при більш тяжких стадіях захворювання і розвитку ПДР. Зменшення вмісту вітаміну В12 відбувалося на всіх стадіях захворювання, а рівень В6 вірогідно зменшувався вже на початкових стадіях ретинопатії.
Розуміючи, що саме генетично детермінований дефіцит основних ферментів фолатного циклу може бути тісно пов’язаний з умістом вітамінів групи В, ми вивчали асоціації різних генотипів генів фолатного циклу з вмістом вказаних речовин у пацієнтів із НПДР, ПДР порівняно з контрольною групою (рис. 2).
Носіям максимально поширеного гетерогенного генотипу СТ гена rs1801133, у яких розвивалася ДР при ЦД2, було притаманне незначне зниження фолатів крові на 20 % (рис. 2А). У носіїв генотипу СС, який у групі хворих зустрічався частіше, ніж у КГ, рівень фолатів був нижче контролю на 20 % на стадії НПДР і на 30 % — при прогресуванні ДР. Суттєва відмінність спостерігалася у носів генотипу ТТ, яких було у 2 рази менше в групі хворих. У здорових носіїв генотипу ТТ спостерігався найвищий рівень фолатів — 6,07 ± 1,75 нг/мл, а на стадії НПДР був нижче у 2 рази (р < 0,05). Отже, виникнення ДР/ЦД2 у носіїв генотипу ТТ відзначається у 2 рази рідше й супроводжується вірогідним зниженням фолатів крові.
У носіїв мажорного генотипу АА гена rs1805087 рівень фолатів крові вірогідно знижувався на 20–26 % (р < 0,05) у групі пацієнтів. Аналогічна картина спостерігалася у носіїв гетерогенного генотипу АG, у яких у КГ рівень фолатів був максимальним — 5,29 ± 2,8 нг/мл і вірогідно знижувався у хворих. Серед пацієнтів із ДР/ЦД2 зустрічалися носії генотипу GG, у яких ми виявили дефіцит фолатів у крові — 2,17 ± 0,3 нг/мл і 2,71 ± 0,6 нг/мл при розвитку ретинопатії.
У пацієнтів — носіїв найпоширеніших генотипів гена rs1801131 АА і АС ми виявили зниження фолатів у крові на 25 % (р < 0,05) і 27 % відповідно при прогресуванні ретинопатії. Для носіїв рідкого генотипу СС було характерним максимальне значення фолатів у крові здорових осіб — 6,3 ± 1,7 нг/мл. Із розвитком ретинопатії вміст фолатів знижувався в 1,7–2,3 раза (р < 0,05).
Уміст фолатів у крові досліджуваних осіб різнився залежно від генотипу і був максимальним у здорових носіїв генотипу ТТ гена rs1801133, носіїв генотипу АG гена rs1805087 і носіїв генотипу СС гена rs1801131, у яких медіана в групі перевищувала значення в популяції в 1,4–1,5 раза.
За нашими даними (рис. 3), вміст вітаміну В12 у здорових осіб не залежав від генотипу основних генів ферментів фолатного циклу. Розвиток ретинопатії супроводжувався поступовим зниженням рівня вітаміну В12 у пацієнтів у групах НПДР і ПДР: у носіїв генотипу СС гена rs1801133 — на 27 % (р < 0,05) і 45 % (р < 0,05) відповідно, у носіїв генотипу СТ — на 30 % (р < 0,05) і 50 % (р < 0,05), у носіїв генотипу ТТ — на 42 % (р < 0,05). У пацієнтів — носіїв генотипів АА гена rs1805087 уміст вітаміну В12 аналогічно знижувався на 25 і 45 % (р < 0,05) і в носіїв генотипу AG — на 32 % (р < 0,05) і 50 % (р < 0,05). У пацієнтів був виявлений генотип GG із практично однаковим вмістом вітаміну В12 у плазмі, меншим у 1,3 раза, ніж середній у КГ.
/28.jpg)
Рівень вітаміну В12 у плазмі осіб КГ також не залежав від поліморфізмів гена rs1801131. У пацієнтів — носіїв генотипу АА гена rs1801131 при розвитку ретинопатії дефіцит вітаміну становив 34 % (р < 0,05) і 44 % (р < 0,05). Серед носіїв генотипу АС зменшення в пацієнтів із НПДР становило 17 %, що було найменшим, а в пацієнтів із ПДР — 50 % (р < 0,05). У носіїв генотипу СС зменшення становило 28 % (р < 0,05) і 40 % (р < 0,05).
Отже, найбільший дефіцит вітаміну В12 спостерігали в носіїв генотипу СТ гена rs1801133, генотипу AG гена rs1805087, у яких при ПДР вміст вітаміну зменшувався на 50 %, а найбільш протективним виявився генотип АС гена rs1801131 — зниження рівня вітаміну при розвитку ДР становило 17 %.
Уміст вітаміну В6 був максимальним у носіїв генотипу ТТ гена rs1801133 — в 1,2 раза більше від середнього значення в групі здорових осіб (рис. 4). Розвиток НПДР супроводжувався його зниженням на 38 %. У носіїв СС і СТ спостерігали невірогідне зниження вмісту В6 у плазмі крові в середньому на 27–30 %.
У здорових носіїв генотипу АА гена s1805087 спостерігали рівень вітаміну В6 більший, ніж середній у КГ. Розвиток ДР супроводжувався зниженням рівня вітаміну В6 на 37 %. У носіїв генотипу AG зниження вмісту вітаміну на стадії НПДР становило 1,8 раза (р = 0,056), поглиблення до ПДР знижувало його на 27 % відносно КГ. У носіїв GG, серед яких були лише хворі, ми виявили неочікувано високий рівень вітаміну В6, що дорівнював середнім значенням КГ.
Уміст вітаміну В6 різнився в здорових осіб залежно від поліморфізмів гена rs1801131: найбільшим він був у носіїв генотипу АА і при розвитку ретинопатії знижувався на 36 % незалежно від стадії. Аналогічно знижувався рівень вітаміну в носіїв генотипу АС — на 30 % відносно значень КГ. А в носіїв генотипу СС зниження рівня вітаміну спостерігали при розвитку НПДР — в 1,8 раза, водночас у пацієнтів із ПДР концентрація вітаміну дорівнювала значенням КГ.
Ми розуміємо, що наші дослідження в цьому напрямку мають певні обмеження, оскільки за рахунок значної дисперсії значень вказані відмінності не були підтверджені статистичними критеріями. Тому ми можемо говорити лише про тенденції, а для підтвердження спостережень необхідно збільшувати групи осіб з різними варіантами поліморфізмів вказаних генів.
Однак ми виявили, що вміст вітамінів групи В у крові досліджуваних осіб має значні коливання залежно від поліморфізмів генів, які кодують ферменти фолатного циклу. Відмінності спостерігаються, як правило, і в групі здорових осіб, хоча вказана варіабельність знаходиться в популяційних референтних межах. Розвиток ЦД2, як і виникнення судинних ускладнень у вигляді ДР із різним ступенем пошкодження сітківки, супроводжується дефіцитом вказаних вітамінів.
Отже, за нашими даними, у крові пацієнтів із ДР/ЦД2 вірогідно знижується вміст фолатів у 1,4 раза (р < 0,05), вітаміну В12 — в 1,6 раза (р < 0,05), вітаміну В6 — в 1,6 раза (р < 0,05) відносно відповідних показників здорових осіб. Це збігається з даними Malaguarnera і співавт., які також виявили значний дефіцит фолієвої кислоти в плазмі крові й еритроцитах у пацієнтів з ПДР і НПДР при діабеті порівняно зі здоровими особами й пацієнтами з діабетом без ретинопатії [12].
У більшості спостережень ми виявили прямий зв’язок дефіциту вітамінів з поглибленням стадії ретинопатії, що може пояснювати погіршення загального стану пацієнтів, біохімічних, метаболічних реакцій, у яких беруть участь вказані вітаміни, з процесами в сітківці й мікросудинах. Але в низці випадків ми виявили різні ступені недостатності вітамінів плазми залежно від поліморфізмів. З огляду на дуже значну поширеність варіацій вказаних генів вивчення зв’язку ступеня дефіциту вітамінів зі стадією ретинопатії може бути корисним як для розуміння патогенетичних ланцюгів пошкодження сітківки при генетичному дефіциті ферментів фолатного циклу, так і для ефективного ведення пацієнтів із ДР/ЦД2 і варіантів терапевтичної тактики. Як відомо, дефіцит вітамінів і ферментів, які задіяні в метаболізмі фолієвої кислоти в організмі, визначає порушення багатьох процесів, починаючи з дисбалансу імунологічної ланки, специфічного й неспецифічного антибактеріального захисту, схильності до інфекцій і розвитку нейрозапалення низького ступеня тощо.
З’являється все більше даних про підвищення загального циркулюючого гомоцистеїну, який індукує підвищення проліферації клітин, що може призвести до виснаження фолієвої кислоти й інактивації реметилювання. Гальмування репарації ДНК зазвичай призводить до підвищеної частоти мутацій і хромосомної нестабільності, що може ініціювати й прискорювати проліферативний процес. Високий рівень гомоцистеїну в плазмі є токсичним для ендотелію за рахунок утворення вільних радикалів і викликає ушкодження судин. Основними патогенетичними механізмами є активація тромбоцитів і окиснювальна модифікація ліпопротеїнів низької щільності.
За результатами Malaguarnera і співавт., метформін був найбільш постійним фактором ризику дефіциту фолієвої кислоти. Автори зауважують, що необхідне великомасштабне дослідження, вивчення поширеності й факторів, що сприяють дефіциту фолієвої кислоти. Згідно з гіпотезою дослідників, одужання або відстрочення діабетичної ретинопатії може відбуватися при лікуванні добавками фолієвої кислоти [12].
Дослідження потенційного зв’язку між мікросудинними змінами, що виникають при діабетичній ретинопатії, і дефіцитом фолієвої кислоти може бути корисним як предиктор ретинопатії. ДР на ранніх стадіях може не виявлятися клінічними проявами й скаргами. Але контроль цих ускладнень залежить від належного лікування і моніторингу стану сітківки й рівня глюкози в крові після раннього виявлення ретинопатії. Отже, фолатний статус може відігравати роль у розвитку й прогресуванні діабетичної ретинопатії. Розуміння й характеристика епігенетичних регуляторів і їх ролі в патогенезі діабетичної ретинопатії надає підставу визначити нові мішені для боротьби з захворюванням, що є основною причиною сліпоти в дорослих.
Висновки
1. У результаті проведених досліджень встановлена різниця в концентрації фолатів, вітамінів В6, В12 у крові досліджуваних осіб залежно від варіантів поліморфізмів генів основних ферментів фолатного циклу.
2. Уміст фолатів у крові досліджуваних осіб розрізнявся залежно від генотипу і був максимальним у здорових носіїв генотипу ТТ гена rs1801133, носіїв генотипу АG гена rs1805087 і носіїв генотипу СС гена rs1801131, у яких медіана в групі перевищувала значення в популяції в 1,4–1,5 раза.
3. Найбільший дефіцит вітаміну В12 спостерігали в носіїв генотипу СТ гена rs1801133, генотипу AG гена rs1805087, у яких при ПДР вміст вітаміну зменшувався на 50 %. Найбільш протективним виявився генотип АС гена rs1801131 — зниження рівня вітаміну становило 17 %.
4. Уміст вітаміну В6 різнився в здорових осіб залежно від поліморфізмів гена rs1801131: найбільшим він був у носіїв генотипу АА і при розвитку ретинопатії знижувався на 36 % незалежно від стадії. Аналогічно знижувався на 30 % рівень вітаміну В6 у носіїв генотипу АС відносно КГ. А в носіїв генотипу СС при розвитку НПДР спостерігали зниження вмісту вітаміну В6 в 1,8 раза.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 16.06.2022
Рецензовано/Revised 01.07.2022
Прийнято до друку/Accepted 14.07.2022
/28.jpg)
/29.jpg)

/26.jpg)
/27.jpg)