Журнал "Гастроэнтерология" Том 56, №3, 2022
Вернуться к номеру
Гісто- та морфометричні зміни слизової оболонки товстого кишечника при хворобі Крона залежно від наявності фіброзу
Авторы: Гайдар Ю.А., Стойкевич М.В., Милостива Д.Ф., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
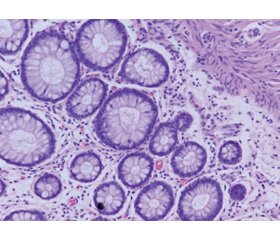
Актуальність. Одними із поширених ускладнень при хворобі Крона є розвиток фібротичних змін стінки товстого кишечника і, як наслідок, можливість виникнення стриктур. Морфометричне дослідження клітинного складу колонобіоптатів є однією з розширених ланок діагностичних критеріїв запальних захворювань кишечника, що дають можливість прогнозувати розвиток хвороби. Зміни чисельності фібробластів як складових мезенхімальних клітин можна вважати захисною реакцією на пошкодження тканин кишечника. Метою роботи було навести зміни гісто- та морфометричних показників слизової оболонки товстого кишечника залежно від розвитку фіброзу кишечника при хворобі Крона. Матеріали та методи. Гістологічно та морфометрично були досліджені колонобіоптати пацієнтів із хворобою Крона (n = 38). За даними морфологічних досліджень пацієнти були розподілені на дві групи: із фібротичними змінами стінки кишечника (n = 10) та без фіброзу (n = 28). Результати. Гістологічно спостерігались зміни слизової оболонки кишечника у вигляді зміни цілісності епітелію (78,3 %), архітектоніки крипт (34,2 %), набряку слизової оболонки (28,9 %), крипт-абсцесів (47,3 %). Фібротичні зміни слизової оболонки кишечника виявлялись у 26,3 % хворих. Запальний інфільтрат у своєму складі містив нейтрофіли, еозинофіли, лімфоцити, плазмоцити, фіброцити, макрофаги. У той же час в групі хворих на хворобу Крона з фіброзом чисельність представників запального інфільтрату була вищою, ніж у групі пацієнтів із хворобою Крона без фіброзу. Пацієнти з фіброзними змінами стінки кишечника характеризувалися більш високою щільністю запального інфільтрату, у складі якого переважали макрофаги та фібробласти. Також спостерігалось потовщення слизової оболонки кишечника у хворих із фіброзом. Причиною таких змін є активація механізму розвитку фіброзу на фоні запальних процесів. Також визначили низку прямих взаємозв’язків між фіброзом стінки товстої кишки та глибиною крипт (r = 0,35; р < 0,05); висотою епітелію крипт (r = 0,41; р < 0,05); клітинною щільністю інфільтрату (r = 0,45; р < 0,05); кількістю нейтрофілів (r = 0,47; р < 0,05); еозинофілів (r = 0,39; р < 0,05); фібробластів (r = 0,57; р < 0,05). Висновки. У колонобіоптатах пацієнтів при хворобі Крона із фіброзом кишечника відмічається більш щільний та підвищений рівень запального інфільтрату. Активний розвиток фіброзного процесу напряму пов’язаний із високим рівнем фібробластів в інфільтраті.
Background. One of the common complications of Crohn’s disease is the development of fibrotic changes in the wall of the large intestine, and, as a result, the risk of strictures. Morphometric study of the cellular composition of large intestine biopsy samples is one of the extended links of the diagnostic criteria for inflammatory bowel diseases, which make it possible to predict the development of the disease. Changes in the number of fibroblasts, as components of mesenchymal cells, can be considered a protective reaction to the intestinal tissue damage. The purpose of the study was to reveal changes in the histo- and morphometric parameters of the large intestine mucosa depending on the development of intestinal fibrosis in Crohn’s disease. Materials and methods. Colon biopsy samples from patients with Crohn’s disease (n = 38) were examined histologically and morphometrically. According to morphological studies, patients were divided into two groups: with fibrotic changes in the intestinal wall (n = 10) and without fibrosis (n = 28). Results. Histologically, changes in the intestinal mucosa were observed in the form of altered integrity of the epithelium (78.3 %), crypt architectonics (34.2 %), mucosal edema (28.9 %), crypt abscesses (47.3 %). Fibrotic changes of the intestinal mucosa were found in 26.3 % of patients. The inflammatory infiltrate contained neutrophils, eosinophils, lymphocytes, plasma cells, fibrocytes, and macrophages. At the same time, in the group of patients with Crohn’s disease and fibrosis, the number of representatives of the inflammatory infiltrate was higher than in the group of patients with Crohn’s disease without fibrosis. Patients with fibrotic changes in the intestinal wall were characterized by a higher density of inflammatory infiltrate the composition of which was dominated by macrophages and fibroblasts. Thickening of the intestinal mucosa was also observed in patients with fibrosis. The cause for such changes is the activation of the mechanism of fibrosis development against the background of inflammatory processes. Direct correlations were found between the fibrosis of the colon wall and the depth of crypts (r = 0.35; p < 0.05), the height of the crypt epithelium (r = 0.41; p < 0.05), cellular density of the infiltrate (r = 0.45; p < 0.05), the number of neutrophils (r = 0.47; p < 0.05), eosinophils (r = 0.39; p < 0.05), fibroblasts (r = 0.57; p < 0.05). Conclusions. In colon biopsy samples of patients with Crohn’s disease and intestinal fibrosis, a denser and increased level of inflammatory infiltrate is noted. The active development of the fibrotic process is directly related to the high level of fibroblasts in the infiltrate.
інфільтрат; фібробласти; запальні захворювання кишечника; клітини; епітелій; фіброз
infiltrate; fibroblasts; inflammatory bowel diseases; cells; epithelium; fibrosis
Вступ
Матеріали та методи
Результати та обговорення
/45.jpg)
/47_2.jpg)
Висновки
- Cushing К., Higgins Р.D.R. Management of Crohn Disease: A Review. JAMA. 2021. Vol. 325. № 1. Р. 69-80. doi: 10.1001/jama.2020.18936.
- Bane O., Gee M.S., Menys A., Dillman J.R., Taouli B. Emerging Imaging Biomarkers in Crohn Disease. Top Magn Reson Imaging. 2021. Vol. 30. № 1. Р. 31-41. doi: 10.1097/RMR.0000000000000264.
- Feuerstein J.D., Cheifetz A.S. Crohn Disease: Epidemiology, Diagnosis, and Management. Mayo Clin Proc. 2017. Vol. 92. № 7. Р. 1088-1103. doi: 10.1016/j.mayocp.2017.04.010.
- Chan W.P.W., Mourad F., Leong R.W. Crohn’s disease associated strictures. J Gastroenterol Hepatol. 2018. Vol. 33. № 5. Р. 998-1008. doi: 10.1111/jgh.14119.
- Stewart D.C., Berrie D., Li J., Liu X., Rickerson C., Mkoji D., Iqbal A., Tan S., Doty A.L., Glover S.C., Simmons C.S. Quantitative assessment of intestinal stiffness and associations with fibrosis in human inflammatory bowel disease. PLoS One. 2018. Vol. 13. № 7. Р. e0200377. doi: 10.1371/journal.pone.0200377.
- Schmoyer C.J., Saidman J., Bohl J.L., Bierly C.L., Kuemmerle J.F., Bickston S.J. The Pathogenesis and Clinical Management of Stricturing Crohn Disease. Inflamm Bowel Dis. 2021. Vol. 27. № 11. Р. 1839-1852. doi: 10.1093/ibd/izab038.
- Golusda L., Kühl A.A., Siegmund В., Paclik D. Extracellular Matrix Components as Diagnostic Tools in Inflammatory Bowel Disease. Biology (Basel). 2021. Vol. 10. № 10. Р. 1024. doi: 10.3390/biology10101024.
- Barnhoorn M.C., Hakuno S.K., Bruckner R.S., Rogler G., Hawinkels L.J.A.C., Scharl M. Stromal Cells in the Pathogenesis of Inflammatory Bowel Disease. J Crohns Colitis. 2020. Vol. 14. № 7. Р. 995-1009. doi: 10.1093/ecco-jcc/jjaa009.
- Zhan S., Li N., Liu C., Mao R., Wu D., Li T., Chen M., Zhuang X., Zeng Z. Intestinal Fibrosis and Gut Microbiota: Clues From Other Organs. Front Microbiol. 2021. Vol. 12. Р. 694967. doi: 10.3389/fmicb.2021.694967.
- Alfredsson J., Wick M.J. Mechanism of fibrosis and stricture formation in Crohn’s disease. Scand J Immunol. 2020. Vol. 92. № 6. Р. e12990. doi: 10.1111/sji.12990.
- Chen W., Lu C., Hirota C., Iacucci M., Ghosh S., Gui X. Smooth Muscle Hyperplasia/Hypertrophy is the Most Prominent Histological Change in Crohn’s Fibrostenosing Bowel Strictures: A Semiquantitative Analysis by Using a Novel Histological Grading Scheme. J Crohns Colitis. 2017. Vol. 11. № 1. Р. 92-104. doi: 10.1093/ecco-jcc/jjw126.
- D’Alessio S., Ungaro F., Noviello D., Lovisa S., Peyrin-Biroulet L., Danese S. Revisiting fibrosis in inflammatory bowel disease: the gut thickens. Nat Rev Gastroenterol Hepatol. 2022. Vol. 19. № 3. Р. 169-184. doi: 10.1038/s41575-021-00543-0.
- Hinz В. The myofibroblast: paradigm for a mechanically active cell. J Biomech. 2010. Vol. 43. № 1. Р. 146-55. doi: 10.1016/j.jbiomech.2009.09.020.
- Sahebally S.M., Burke J.P., Chang K.H., Kiernan M.G., O’Connell P.R., Coffey J.C. Circulating fibrocytes and Crohn’s disease. Br J Surg. 2013. Vol. 100. № 12. Р. 1549-56. doi: 10.1002/bjs.9302.
- Stidham R.W., Xu J., Johnson L.A., Kim K., Moons D.S., McKenna B.J., Rubin J.M., Higgins P.D.R. Ultrasound elasticity imaging for detecting intestinal fibrosis and inflammation in rats and humans with Crohn’s disease. Gastroenterology. 2011. Vol. 141. № 3. Р. 819-826.e1. doi: 10.1053/j.gastro.2011.07.027.
- Nighot M., Ganapathy A.S., Saha K., Suchanec E., Castillo E.F., Gregory A., Shapiro S., Ma T., Nighot P. Matrix Metalloproteinase MMP-12 Promotes Macrophage Transmigration Across Intestinal Epithelial Tight Junctions and Increases Severity of Experimental Colitis. J Crohns Colitis. 2021. Vol. 15. № 10. Р. 1751-1765. doi: 10.1093/ecco-jcc/jjab064.
- Zhou G.X., Liu Z.J. Potential roles of neutrophils in regulating intestinal mucosal inflammation of inflammatory bowel disease. J Dig Dis. 2017. Vol. 18. № 9. Р. 495-503. doi: 10.1111/1751-2980.12540.
- Ng S.C., Shi H.Y., Hamidi N., Underwood F.E., Tang W., Benchimol E.I., Panaccione R., Ghosh S., Justin C.Y., Wu J.C.Y., Chan F.K.L., Sung J.J.Y., Kaplan G.G. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. Lancet. 2017. Vol. 390. № 10114. Р. 2769-2778. doi: 10.1016/S0140-6736(17)32448-0.
- Valatas V., Eirini Е., Drygiannakis I., Kolios G. Stromal and immune cells in gut fibrosis: the myofibroblast and the scarface. Ann Gastroenterol. 2017. Vol. 30. № 4. Р. 393-404. doi: 10.20524/aog.2017.0146.
- Burke J.P., Mulsow J.J., O’Keane K., Docherty N.G., Watson R.W.G., O’Connell P.R. Fibrogenesis in Crohn’s disease. Am J Gastroenterol. 2007. Vol. 102. № 2. Р. 439-48. doi: 10.1111/j.1572-0241.2006.01010.x.
- Barnhoorn M.C., Hakuno S.K., Bruckner R.S., Rogler G., Hawinkels L.J.A.C., Scharl M. Stromal Cells in the Pathogenesis of Inflammatory Bowel Disease. J Crohns Colitis. 2020. Vol. 14. № 7. Р. 995-1009. doi: 10.1093/ecco-jcc/jjaa009.
- O’Sullivan S., Gilmer J.F., Medina С. Matrix metalloproteinases in inflammatory bowel disease: an update. Mediators Inflamm. 2015. Vol. 2015. Р. 964131. doi: 10.1155/2015/964131.
- Wynn Т.А. Cellular and molecular mechanisms of fibrosis. Pathol. 2008. Vol. 214. № 2. Р. 199-210. doi: 10.1002/path.2277.
- Fabián O., Kamaradová К. Morphology of inflammatory bowel diseases (IBD). Cesk Patol. 2022. Vol. 58. № 1. Р. 27-37.
- Feuerstein J.D., Cheifetz A.S. Crohn Disease: Epidemiology, Diagnosis, and Management. Mayo Clin Proc. 2017. Vol. 92. № 7. Р. 1088-1103. doi: 10.1016/j.mayocp.2017.04.010.
- Truffi M., Sorrentino L., Monieri M., Fociani P., Mazzucchelli S., Bonzini M., Zerbi P., Sampietro G.M., Sabatino A.D., Corsi F. Inhibition of Fibroblast Activation Protein Restores a Balanced Extracellular Matrix and Reduces Fibrosis in Crohn’s Disease Strictures Ex Vivo. Inflamm Bowel Dis. 2018. Vol. 24. № 2. Р. 332-345.doi: 10.1093/ibd/izx008.

/46.jpg)
/46_2.jpg)
/47.jpg)
/48.jpg)