Глобальна поширеність артеріальної гіпертензії (АГ) оцінюється в 1,13 млрд осіб, а підвищений артеріальний тиск (АТ) є провідним фактором передчасної смерті, зокрема, у 2015 році цей показник становив майже 10 млн смертей і більше ніж 200 млн років життя з інвалідністю [1, 2]. Тому пошук нових діагностичних методик, що сприяють розумінню фенотипу пацієнта, персоналізації діагностичної та лікувальної тактики та покращенню прогнозів для пацієнта з АГ, є надзвичайно актуальним та важливим.
Ортостатична артеріальна гіпертензія (ОАГ), тобто стійке підвищення АТ після перебування в положенні стоячи, є все більш поширеним серцево-судинним захворюванням, проте набагато менше дослідженим порівняно з ортостатичною гіпотензією (ОГ) [3], що є гемодинамічною протилежністю ОАГ. Однак як при ОАГ, так і при ОГ дисфункція вегетативної нервової системи (ВНС) вважається первинним патофізіологічним порушенням, при цьому спостерігаються значущі кореляції з есенціальною АГ [4, 21].
Регуляторні механізми, що беруть участь у формуванні ортостатичної відповіді організму, такі як активація симпатичного відділу ВНС, продукція катехоламінів, ендотеліальна функція, роблять істотний внесок у підтримання рівня АТ, а їх порушення відіграє активну роль у формуванні АГ, що дозволяє розглядати наявність ОАГ у пацієнта з АГ як маркер стратифікації серцево-судинного ризику (ССР) [5, 7, 8, 21].
Визначення та діагностичні критерії ОАГ
ОАГ — підвищення АТ при прийнятті вертикальної пози — є недостатньо оціненим і вивченим клінічним станом, хоча термін «ОАГ» використовується медичною спільнотою з 1940 року [6].
Нині не існує загальноприйнятого визначення клінічної ОАГ, термін «ОАГ» не визначений і не включений у чинні рекомендації з АГ [1, 9], поточні визначення використовуються в контексті окремих досліджень.
У 2019 році C. Finucane et al. запропонували два діагностичні критерії для визначення ОАГ: стійке підвищення (> 1 хв) систолічного АТ (САТ) ≥ 20 мм рт.ст. або > 140 і 90 мм рт.ст., якщо у пацієнта в горизонтальному положенні реєструються нормальні цифри АТ [7, 25].
У 2020 році J. Jordan et al. структурували діагностичні критерії ОАГ і подали їх у вигляді таблиці (табл. 1) [7]. Зокрема, у ній наведено огляд досліджень [10–25], що вперше в літературі запропонували і використали конкретні критерії ОАГ. У більшості із них [11–17, 21–25] як діагностичний критерій використовувалася абсолютна різниця САТ та/або діастолічного АТ (ДАТ) у горизонтальному та вертикальному положеннях, в інших [10, 18, 23, 25] ОАГ визначалась як перехід АТ від нормальних цифр у горизонтальному положенні до підвищених цифр в ортостазі (вертикальне положення, тобто положення стоячи).
K. Kario (2013) [21] припустив, що діагностованою ОАГ може вважатись при підвищенні САТ ≥ 20 мм рт.ст., а якщо ортостатична проба (ОП) проводиться у домашніх умовах — при підвищенні САТ ≥ 10 мм рт.ст.
У нещодавніх великих дослідженнях, відповідно до визначення ОАГ, ортостатичне підвищення ДАТ не менше ніж 10 мм рт.ст. також було включено у критерії ОАГ [22]. Однак J. Jordan et al. (2020) вважають, що підвищення ДАТ в ортостазі є менш надійним діагностичним критерієм ОАГ, оскільки у вертикальному положенні за рахунок периферичної вазоконстрикції та зниження ударного об’єму підвищення ДАТ на 5–10 мм рт.ст. вважається фізіологічною реакцією [7, 26]. Також дослідники звертають увагу на важливий та рідко обговорюваний аспект зміни АТ у пацієнта під час виконання ОП: коли саме в ортостазі має підвищуватися АТ і як довго він має залишатися підвищеним для підтвердження ОАГ.
Для виявлення ОАГ використовується ОП, що є простим у виконанні та легкодоступним методом оцінки стану серцево-судинної системи та її вегетативної регуляції. ОП може здійснюватися в амбулаторних умовах лікарем будь-якої спеціальності, не займає багато часу та не потребує додаткового обладнання [8, 21]. Виконання того ж тесту вдома у пацієнта може виключити небажаний ефект «білого халата», який призведе до хибного діагнозу ОАГ при вимірюванні АТ в амбулаторних умовах. Також вимірювання АТ в домашніх умовах дає більше можливостей зафіксувати раніше не виявлену ОАГ [21, 27].
Як альтернативу можна використовувати добовий моніторинг АТ, що надає додаткові переваги, включаючи оцінку короткострокової варіабельності АТ [21, 27], та різноманітні тілт-тести [21, 28].
ОАГ переважно перебігає безсимптомно, хоча можуть виникати такі симптоми, як запаморочення, стан передзомління, головний біль, серцебиття, нудота, пітливість і рідко непритомність [21].
Епідеміологія ОАГ
ОАГ значно менше досліджена порівняно з ОГ. На жаль, відсутність прийнятого у всьому світі визначення ОАГ робить порівняння між дослідженнями як мінімум проблематичним. У дослідженнях, що визначали ОАГ як підвищення САТ ≥ 20 мм рт.ст., поширеність ОАГ варіювала від 1,1 % у популяції молодих пацієнтів до 28 % у популяції літніх осіб [8, 26, 29, 30]. У дослідженнях, які використовували менші цифри підвищення САТ як діагностичні критерії, поширеність ОАГ очікувано була вищою.
Серед факторів ризику вік, мабуть, є основною детермінантою ОАГ. Повідомлялося також про більшу поширеність ОАГ серед пацієнтів з цукровим діабетом та ослаблених осіб, тоді як інші дослідження виявляли зв’язок як з ожирінням, так і з метаболічним синдромом.
Патогенетичні механізми ОАГ
Класичним поясненням патогенетичного механізму ОАГ вважається вихідна підвищена активність симпатичної нервової системи та надмірна симпатична відповідь, що викликана зниженням серцевого викиду у результаті ортостазу [8, 10, 14, 21, 26, 31].
У 2019 році N. Magkas et al. вперше запропонували своє бачення патогенетичного механізму ОАГ у вигляді алгоритму (рис. 1) [8].
Патогенез ОАГ може бути обумовлений дисфункцією вегетативної нервової системи (порушенням чутливості барорецепторів та/або нездатністю барорефлексу адаптуватися до «нормальних» значень АТ), α-адренергічною судинною гіперактивністю, підвищеною концентрацією норепінефрину, активацією ренін-ангіотензин-альдостеронової системи (РААС) та підвищеною секрецією вазопресину [8, 10, 21, 26].
До факторів, що сприяють розвитку ОАГ, відносять артеріальну жорсткість та ремоделювання дрібних артерій, надмірне депонування венозної крові [7, 8, 10, 21, 33]. АГ разом із старінням, цукровим діабетом, неврологічними розладами та станами, що підсилюють дегенерацію ВНС та активацію симпатикотонії, розглядається як провокуючий фактор ОАГ [13, 19, 21, 33]. Структурні та/або функціональні порушення ниркової судинної системи, як і при АГ, також можуть зумовлювати патогенетичні механізми ОАГ. Зниження ниркового кровотоку активує РААС, викликаючи вазоконстрикцію, затримку води і солі та підвищення АТ (реноваскулярна АГ, нефро-птоз) [7, 8, 32, 34].
До інших рідкісних причин ОАГ відносять судинну мієлопатію, дефіцит транспортера норепінефрину, барорефлекторну недостатність, мутацію гена, що кодує фосфодіестеразу 3A, феохромоцитому, розлад активації тучних клітин, порушення постави [7, 8, 26, 35]. У дітей як патогенетичні механізми ОАГ також виділяють пошкодження ендотелію і пов’язане з ним зменшення плазмових концентрацій оксиду азоту та синтази оксиду азоту, дефіцит вітаміну D та його участь у регуляції ВНС та РААС [26, 36, 37].
Стани, що обумовлюють патогенетичні механізми ОАГ
Первинні хронічні захворювання:
— артеріальна гіпертензія у похилому віці;
— артеріальна гіпертензія (добовий профіль over-dipper);
— артеріальна гіпертензія з ортостатичним депонуванням;
— цукровий діабет 2-го типу;
— периферійна нейропатія;
— мутація гена, що кодує фосфодіестеразу 3А.
Дизавтономії:
— синдром постуральної (ортостатичної) тахікардії;
— порушення активації тучних клітин;
— дефіцит транспортера норадреналіну;
— барорефлекторна недостатність;
— центральна вегетативна дизрегуляція.
Стани, які потенційно корегуються хірургічними методами:
— феохромоцитома;
— реноваскулярна гіпертензія;
— нефроптоз;
— судинна мієлопатія;
— порушення постави.
Взаємозв’язок ОАГ з АГ та серцево-судинним ризиком
ОАГ не є доброякісним станом, проте її діагностика з погляду стратифікації серцево-судинного ризику та клінічного ведення не до кінця з’ясована та зрозуміла [7, 8, 14, 16–20, 29, 33].
Патофізіологічні передумови та клінічні характеристики ОАГ відрізняються залежно від віку і мають різне значення: у молодого пацієнта можуть вказувати на підвищений ризик розвитку АГ у майбутньому [7, 8, 19, 21, 26, 33], а у літнього пацієнта є самостійним фактором ССР [14, 21].
У численних дослідженнях виявлено, що ОАГ і АГ є патогенетично взаємозв’язаними [8, 11, 14, 17, 19, 22, 29, 37]. Зокрема, ОАГ взаємозв’язана з усіма компонентами серцево-судинного континууму АГ: факторами ризику, безсимптомним ураженням органів, що опосередковані АГ, та асоційованими станами (див. вище). Виявлено взаємозв’язок ОАГ з маскованою АГ [29, 30].
Видається правдоподібним, що ОАГ може бути незалежним фактором ризику несприятливих подій, оскільки підвищений АТ у вертикальному положенні може спричинити пошкодження органів-мішеней аналогічно есенціальній АГ, особливо якщо ОАГ дійсно є формою замаскованої гіпертензії або передгіпертензії [38].
До того ж ОАГ взаємопов’язана не тільки з АГ, але і з коливаннями АТ протягом доби: величиною ранкового підйому АТ, варіабельністю АТ та надмірним зниженням АТ у нічний час (добовий профіль оver-dipper), які є відомими маркерами інсульту [14, 16, 21]. Пацієнти з АГ та з профілем over-dipper мають більшу поширеність «німого» інсульту, що діагностується за даними магнітно-резонансної томографії, порівняно з пацієнтами з АГ та з профілем dipper. Окрім того, пацієнти з АГ та профілем over-dipper мають більший ризик розвитку інсульту з клінічними проявами і у разі останнього мають найгірший прогноз. ОАГ може бути фактором ризику у пацієнтів із АГ, оскільки 2/3 інсультів у пацієнтів з АГ та з профілем over-dipper відбуваються в ранковий час, коли у пацієнтів відзначається ранковий підйом АТ [16].
У 1997 році K. Matsubayashi et al. [12] виявили незалежний від наявності АГ взаємозв’язок ОАГ з інсультом та нейрокогнітивним дефіцитом. Взаємозв’язок ОАД з частотою лакунарних інсультів підтверджено пізніше даними ARIC Study [39] та W.N. Nibouche-Hattab et al. (2017) [33].
K. Kario et al. (2002) [14] вказали, що гіпертоніки з ОАГ мали вищу частоту «німих» церебральних інфарктів та виражених глибоких уражень білої речовини порівняно з гіпертоніками без ОАГ. X.H. Fan et al. (2010) [40] виявили, що ОАГ була пов’язана з інсультом в анамнезі. Окрім того, у популяційних дослідженнях ОАГ була пов’язана зі зниженням когнітивних функцій, поганою швидкістю мовлення, лейкоареозом та порушенням нейроповедінкової функції.
У деяких дослідженнях продемонстровано взаємозв’язок ОАГ з ураженнями органів, що опосередковані АГ: підвищенням натрійуретичних пептидів та співвідношення альбумін/креатинін [20], гіпертрофією лівого шлуночка [14, 33], товщиною комплексу інтима-медіа [13]; а також з асоційованими клінічними станами: ураженням периферичних артерій [40] та ішемічною хворобою серця [15], що дозволяє розглядати гіпотезу про можливе використання діагностованої ОАГ як фактора стратифікації ССР у хворих на АГ.
У 2019 році W.J. Kostis et al. [24], за підсумками дослідження SHEP (Systolic Hypertension in the Elderly Program), виявили взаємозв’язок ОАГ з вищим ризиком серцево-судинної смертності та смертності від усіх причин після поправки на вік, стать і вихідний САТ. Однак після врахування серцево-судинних факторів ризику та інших супутніх захворювань взаємозв’язок втратив свою значущість. У 2021 році M. Rahman et al. опубліковали дані ретроспективного аналізу дослідження SPRINT (Systolic Blood Pressure Intervention Trial): у групі пацієнтів, які приймали інтенсивну антигіпертензивну терапію, ОАГ асоціювалася з більш високим ризиком серцево-судинних наслідків [41].
Продемонстровано взаємозв’язки ОАГ із різними клінічними станами, включаючи гіпертригліцеридемію [8, 18, 33], цукровий діабет 2-го типу [8, 18, 39], індекс маси тіла, ожиріння та метаболічний синдром [17, 22, 26, 33].
Основні клінічні дослідження, що вивчали ОАГ та АГ за останні 5 років
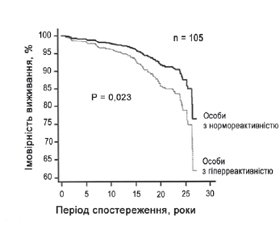
1. Palatini P. et al. (2022) [42] у статті «Гіперреактивність артеріального тиску у положенні стоячи як прогностичний фактор несприятливих наслідків у молодих осіб із АГ» (Blood Pressure Hyperreactivity to Standing: a Predictor of Adverse Outcome in Young Hypertensive Patients) проаналізували дані 1207 учасників проспективного когортного дослідження HARVEST (Hypertension and Ambulatory Recording Venetia) віком від 18 до 45 років (середній вік 33,1 ± 8,6 року) із нелікованою АГ 1-го ступеня (САТ 140–159 мм рт.ст. і ДАТ 90–99 мм рт.ст.). Метою дослідження було оцінити зв’язок між ортостатичною гіперреактивністю та ризиком тяжких ускладнень ССЗ та ускладнень захворювань нирок у когорті молодих осіб з АГ. Ортостатичну зміну АТ розраховували як різницю між 6 показаннями АТ у положенні стоячи і 6 — у положенні лежачи, що визначали під час 2 окремих візитів (рис. 2). Середня різниця у всій групі становила 2,5 ± 7,3/4,6 ± 5,4 мм рт.ст. (рис. 3).
/15.jpg)
Амбулаторна гіпертензія, оцінена за допомогою 24-годинної реєстрації, частіше зустрічалася в осіб з гіперреактивністю, ніж з нормореактивністю (90,8 проти 76,4 %, р = 0,001). Серед 630 учасників, у яких оцінювали вміст катехоламінів у сечі протягом 24 годин, співвідношення адреналін/креатинін було вищим в осіб з гіперреактивністю (118,4 ± 185,6 нмоль/моль проти 77,0 ± 90,1 нмоль/моль в осіб з нормореактивністю, р = 0,005). За 17,2 року спостереження було зареєстровано 105 серйозних несприятливих серцево-судинних і ниркових подій (табл. 2).
У багатофакторній моделі Кокса гіперреактивність у положенні стоячи була незалежним предиктором серйозних серцево-судинних і ниркових ускладнень із коефіцієнтом ризику 1,97 (95% ДІ 1,10–3,52) (рис. 4, 5). Гіперреактивність залишалася незалежним предиктором небажаних подій, навіть коли в модель Кокса були включені дані амбулаторного АТ і АГ, що виникла під час спостереження (відношення ризиків 1,94; 95% ДI 1,10–3,44).
Висновки дослідження:
— В осіб молодого та середнього віку з АГ підвищена реакція систолічного АТ у положенні стоячи зв’язана з гіперреактивністю симпатичного відділу вегетативної нервової системи та може вважатись прогностичним фактором розвитку тяжких ускладнень ССЗ та ниркових подій.
— Оцінка ортостатичної реакції рівня АТ є легко використовуваним методом, який надає додаткову прогностичну інформацію до амбулаторного вимірювання АТ.
2. Rahman M. et al. (2021) [41]; n = 9329. Вторинний ретроспективний аналіз дослідження SPRINT (Systolic Blood Pressure Intervention Trial). Середній вік пацієнтів становив 67,86 ± 9,4 року, серед них 35,6 % осіб негроїдної раси, 31,6 % — жінки. Критерії ОАГ: підвищення САТ ≥ 20 мм рт.ст. або ДАТ ≥ 10 мм рт.ст. Результати дослідження: виявлено 21,2 % пацієнтів з ОАГ; особи жіночої статі, негроїдної раси та з більш високим індексом маси тіла мали більшу схильність до ОАГ (р < 0,001). ОАГ супроводжувалася вищим ризиком розвитку серцево-судинних ускладнень (ССУ) у групі пацієнтів, що приймали інтенсивну антигіпертензивну терапію (досягнення цільового рівня САТ < 120 мм рт.ст.), але не у групі пацієнтів із стандартною антигіпертензивною терапією (досягнення цільового рівня САТ < 140 мм рт.ст.). Інтенсивна антигіпертензивна терапія порівняно із стандартною не призводила до зниження ризику ССУ у пацієнтів з ОАГ.
3. Kostis W.J. et al. (2019) [24]. Експериментальне контрольоване рандомізоване дослідження SHEP (Systolic Hypertension in the Elderly Program Study). Пацієнти (n = 4736) з ізольованою систолічною АГ, вік > 60 років. Критерій ОАГ: підвищення САТ ≥ 15 мм рт.ст. Результати дослідження: ОАГ була пов’язана з вищою серцево-судинною смертністю та смертністю від усіх причин після врахування віку, статі та вихідного САТ, проте після врахування факторів ризику ССЗ та інших супутніх захворювань взаємозв’язок втратив значущість.
4. Barochiner J. et al. (2018) [43]. Наглядове одномоментне проспективне дослідження. Пацієнти з АГ (n = 186), які отримували антигіпертензивну терапію. Критерій діагностики ОАГ: підвищення САТ ≥ 20 мм рт.ст. або ДАТ ≥ 10 мм рт.ст. Результати дослідження: ОАГ була пов’язана з вищою варіабельністю загального периферичного судинного опору (ЗПСО), серцевим ритмом в ортостазі та нижчим рівнем ДАТ у положенні лежачи. Пацієнти з ОАГ мали нижчий ЗПСО у горизонтальному положенні порівняно з пацієнтами з ортостатичною гіпотензією.
5. Nibouche-Hattab W.N. et al. (2017) [33]. Наглядове проспективне когортне дослідження. Пацієнти з нормальним АТ та нещодавно діагностованим ЦД 2-го типу (n = 108), вік 40–70 років, період спостереження — 1 рік. Нормальний АТ в ортостазі (n = 74), ортостатична гіпотензія (n = 12), ОАГ (n = 22). Критерії діагностики ОАГ: збільшення САТ ≥ 20 мм рт.ст. та/або ДАТ ≥ 10 мм рт.ст. Результати дослідження: пацієнти з ОАГ мали більш високі цифри САТ у горизонтальному положенні (p = 0,029), більшу окружність талії (p = 0,022), холестерин ліпопротеїнів низької щільності (p = 0,041). У них частіше спостерігалося ожиріння (p = 0,036), гіпертрофія лівого шлуночка (p = 0,024), метаболічний синдром (p = 0,042), цереброваскулярні події (p = 0,050) порівняно з пацієнтами з нормальним АТ в ортостазі. Через рік поширеність АГ була більшою у групі пацієнтів з ОАГ (p = 0,0008).
Лікування
Немає конкретних рекомендацій щодо лікування ОАГ. Переконливі прямі докази того, що лікування ОАГ покращує прогноз, також відсутні [4, 21]. Тобто лікування ОАГ повинно бути індивідуалізованим залежно від симптомів і супутніх захворювань [4, 8].
З огляду на те, що ОАГ пов’язана з маскованою та майбутньою АГ [39, 45, 46], пацієнти з ОАГ повинні перебувати під ретельним наглядом для швидкого виявлення есенціальної АГ, яка повинна лікуватись відповідно до рекомендацій [1, 9].
Насамперед пацієнтам з ОАГ слід рекомендувати уникати різких змін пози.
K. Kario et al. (2008) продемонстрували непрямі докази сприятливого ефекту лікування ОАГ альфа-блокаторами. У рандомізованому дослідженні Japan Morning Surge-1, у якому взяли участь 611 гіпертоніків із ранковим САТ > 135 мм рт.ст., було доведено, що 6-місячне лікування доксазозином, який приймали перед сном і додавали до стандартної терапії, значно знижувало співвідношення альбумін/креатинін у сечі [46]. У групі пацієнтів з ортостатичним підвищенням САТ > 7,8 мм рт.ст. лікування доксазозином зменшувало ортостатичне підвищення САТ в домашніх умовах порівняно з контрольною групою, тоді як впливу на САТ у сидячому положенні не спостерігалося. Результати дослідження підтверджують, що гіперактивність альфа-адренергічних судин може частково опосередковувати відповідь ОАГ.
Клонідин (клофелін) також може бути корисним [5] завдяки його симпатолітичним властивостям при тяжкій симптоматичній ОАГ, як показано в невеликому дослідженні за участю 11 пацієнтів із недостатністю барорефлексів [47].
Однак питання про те, чи слід замінювати препарати першої лінії блокаторами α-адренорецепторів, які особливо ефективні у зниженні АТ у пацієнтів з ОАГ, або симпатолітиками, залежить від індивідуального клінічного рішення.
Бета-блокатори мають пресорний ефект у положенні стоячи, що було зареєстровано у великому обсерваційному дослідженні [48], однак залишається дискусійним питання про те, чи може це погіршити ОАГ.
Оскільки пусковим механізмом нейрогуморальної активації під час стояння є зменшення перед-навантаження на серце [5, 21], діуретики, які посилюють центральну гіповолемію, є не найкращим вибором антигіпертензивних препаратів.
Наявні дані, що торакальна симпатектомія усунула ОАГ у п’яти пацієнтів, але за рахунок виникнення ОГ після операції [49]. Реваскуляризація нирки може бути терапевтичним варіантом лікування ОАГ у разі супутнього значного стенозу ниркових артерії [50].
Висновки
— ОАГ — підвищення АТ при прийнятті вертикальної пози є недостатньо оціненим і вивченим клінічним станом.
— Оскільки немає «офіційного» визначення ОАГ у чинних рекомендаціях з АГ, більшість дослідників запропонували визначати ОАГ як стійке підвищення САТ ≥ 20 мм рт.ст. або > 140 і 90 мм рт.ст., якщо у пацієнта в горизонтальному положенні реєструються нормальні цифри АТ. Хоча деякі дослідники пропонують інші критерії (табл. 1).
— Класичним поясненням патогенетичного механізму ОАГ вважається вихідна підвищена активність симпатичної нервової системи та надмірна симпатична відповідь, що викликана зниженням серцевого викиду у результаті ортостазу.
— У численних дослідженнях виявлено, що ОАГ і АГ є патогенетично взаємозв’язаними. Зокрема, ОАГ взаємозв’язана з усіма компонентами серцево-судинного континууму АГ: факторами ризику, безсимптомним ураженням органів, що опосередковане АГ, та асоційованими станами.
— У нещодавно проведеному проспективному когортному дослідженні HARVEST (Hypertension and Ambulatory Recording Venetia), що включало 1207 пацієнтів віком від 18 до 45 років (середній вік 33,1 ± 8,6 року) із нелікованою АГ 1-го ступеня (САТ 140–159 мм рт.ст. і ДАТ 90–99 мм рт.ст.), було доведено, що в осіб молодого та середнього віку з АГ підвищена реакція систолічного АТ у положенні стоячи зв’язана з гіперреактивністю симпатичного відділу вегетативної нервової системи та може вважатись прогностичним фактором розвитку тяжких ускладнень ССЗ та ниркових подій.
— Оцінка ортостатичної реакції рівня АТ є легко використовуваним методом, який надає додаткову прогностичну інформацію до амбулаторного вимірювання АТ. Оскільки як ортостатична гіпотензія, так і ортостатична гіпертензія вказують на підвищений ризик серцево-судинних захворювань, видається доцільним проводити скринінг пацієнтів на аномальні реакції ортостатичного АТ за допомогою простого ортостатичного тестування.
— Оскільки немає конкретних рекомендацій щодо лікування ОАГ, воно повинно бути індивідуалізованим залежно від симптомів і супутніх захворювань відповідно до рекомендацій із лікування АГ. Наявні непрямі докази сприятливого ефекту лікування ОАГ альфа-блокаторами (доксазозин).
— Необхідні рандомізовані дослідження для виявлення ОАГ як у когортах пацієнтів з АГ, так і в когортах без неї, щоб з’ясувати, чи є ОАГ окремим захворюванням чи підтипом есенціальної АГ, а також визначити прогностичну роль ОАГ та ефективність терапії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 01.07.2022
Рецензовано/Revised 14.07.2022
Прийнято до друку/Accepted 21.07.2022
Список литературы
1. Williams B., Mancia G., Spiering W., et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J. Hypertens. 2018. 36(10). 1953-2041. doi: 10.1097/HJH.0000000000001940. Erratum in: J. Hypertens. 2019. 37(1). 226. doi: 10.1097/HJH.0000000000002017.
2. NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in blood pressure from 1975 to 2015: a pooled analysis of 1479 population-based measurement studies with 19•1 million participants. Lancet. 2017 Jan 7. 389(10064). 37-55. doi: 10.1016/ S0140-6736(16)31919-5. Erratum in: Lancet. 396(10255). 886. doi: 10.1016/S0140- 6736(20)31972-3.
3. Ricci F., De Caterina R., Fedorowski A. Orthostatic hypotension: epidemiology, prognosis, and treatment. J. Am. Coll. Cardiol. 2015. 66(7). 848-860.
4. Fessel J., Robertson D. Orthostatic hypertension: when pressor reflexes overcompensate. Nat. Clin. Pract. Nephrol. 2006. 2(8). 424-431.
5. Hoshide S., Matsui Y., Shibasaki S., et al. Orthostatic hypertension detected by self-measured home blood pressure monitoring: a new cardiovascular risk factor for elderly hypertensives. Hypertens. Res. 2008. 31. 1509-1516.
6. Mccann W.S., Romansky M.J. Orthostatic hypertension: the effect of nephroptosis on the renal blood flow. JAMA. 1940. 115. 573-578.
7. Jordan J., Ricci F., Hoffmann F., et al. Orthostatic Hypertension: Critical Appraisal of an Overlooked Condition. Hypertension. 2020. 75(5). 1151-8. doi: 10.1161/ HYPERTENSION-AHA.120.14340.
8. Magkas N., Tsioufis C., Thomopoulos C., et al. Orthostatic hypertension: From pathophysiology to clinical applications and therapeutic considerations. J. Clin. Hypertens. (Greenwich). 2019. 21(3). 426-33. doi: 10.1111/jch.13491.
9. Whelton P.K., Carey R.M., Aronow W.S., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018. 71(6). e13-e115. doi: 10.1161/HYP.0000000000000065. Erratum in: Hypertension. 2018. 71(6). e140-e144. doi: 10.1161/HYP.0000000000000076.
10. Streeten D.H., Auchincloss J.H. Jr., Anderson G.H. Jr. et al. Orthostatic hypertension. Pathogenetic studies. Hypertension. 1985. 7. 196-203. doi: 10.1161/01.hyp.7.2.196.
11. Vriz O., Soon G., Lu H., et al. Does orthostatic testing have any role in the evaluation of the young subject with mild hypertension? An insight from the HARVEST study. Am. J. Hypertens. 1997. 10(5 pt 1). 546-51. doi:10.1016/s0895-7061(96)00489-x.
12. Matsubayashi K., Okumiya K., Wada T., et al. Postural dysregulation in systolic blood pressure is associated with worsened scoring on neurobehavioral function tests and leukoaraiosis in the older elderly living in a community. Stroke. 1997. 28. 2169-73. doi: 10.1161/01.str.28.11.2169.
13. Kohara K., Tabara Y., Yamamoto Y., Miki T. Orthostatic hypertension: another orthostatic disorder to be aware of. J. Am. Geriatr. Soc. 2000. 48. 1538-9. doi: 10.1111/ jgs.2000.48.11.1538.
14. Kario K., Eguchi K., Hoshide S., et al. U-curve relationship between orthostatic blood pressure change and silent cerebrovascular disease in elderly hypertensives: orthostatic hypertension as a new cardiovascular risk factor. J. Am. Coll. Cardiol. 2002. 40. 133-41. doi: 10.1016/s0735-1097(02)01923-x.
15. Nardo C.J., Chambless L.E., Light K.C., et al. Descriptive epidemiology of blood pressure response to change in body position. The ARIC study. Hypertension. 1999. 33. 1123-9. doi: 10.1161/01.hyp.33.5.1123.
16. Kario K., Eguchi K., Nakagawa Y., et al. Relationship between extreme dippers and orthostatic hypertension in elderly hypertensive patients. Hypertension. 1998. 31. 77-82. doi: 10.1161/01.hyp.31.1.77.
17. Alagiakrishnan K., Masaki K., Schatz I., et al. Postural hypertension in elderly men — the Honolulu Heart Program. Hawaii Med. J. 2000. 59. 48-50.
18. Yoshinari M., Wakisaka M., Nakamura U., et al. Orthostatic hypertension in patients with type 2 diabetes. Diabetes Care. 2001. 24. 1783-6. doi: 10.2337/diacare.24.10.1783.
19. Thomas R.J., Liu K., Jacobs D.R. Jr., et al. Positional change in blood pressure and 8-year risk of hypertension: the CARDIA Study. Mayo Clin. Proc. 2003. 78. 951-8. doi: 10.4065/78.8.951.
20. Hoshide S., Matsui Y., Shibasaki S., et al.; Japan Mor-ning Surge-1 Study Group. Orthostatic hypertension detected by self-measured home blood pressure monitoring: a new cardiovascular risk factor for elderly hypertensives. Hypertens. Res. 2008. 31. 1509-16. doi:10.1291/hypres.31.1509.
21. Kario K. Orthostatic hypertension — a new haemodynamic cardiovascular risk factor. Nat. Rev. Nephrol. 2013. 9(12). 726-38. doi: 10.1038/nrneph.2013.224.
22. Townsend R.R., Chang T.I., Cohen D.L., et al.; SPRINT Study Research Group. Orthostatic changes in systolic blood pressure among SPRINT participants at baseline. J. Am. Soc. Hypertens. 2016. 10. 847-56. doi: 10.1016/j.jash.2016.08.005.
23. Weiss A., Beloosesky Y., Grossman A., et al. The association between orthostatic hypertension and all-cause mortality in hospitalized elderly persons. J. Geriatr. Cardiol. 2016. 13. 239-43. doi: 10.11909/j.issn.1671-5411.2016.03.004.
24. Kostis W.J., Sargsyan D., Mekkaoui C., et al. Association of orthostatic hypertension with mortality in the systolic hypertension in the elderly program. J. Hum. Hypertens. 2019. 33. 735-40. Doi: 10.1038/s41371-019-0180-4.
25. Finucane C., van Wijnen V.K., Fan C.W., et al. A practical guide to active stand testing and analysis using continuous beat-to-beat non-invasive blood pressure monitoring. Clin. Auton. Res. 2019. 29. 427-41. doi: 10.1007/s10286-019-00606-y.
26. Hu Y., Jin H., Du J. Orthostatic Hypertension in Children: An Update. Front Pediatr. 2020. 8. 425. doi: 10.3389/fped.2020.00425.
27. Tochikubo O., Ikeda A., Miyajima, et al. Effects of insufficient sleep on blood pressure monitored by a new multibiomedical recorder. Hypertension. 1996. 27. 1318-1324.
28. Brignole M., Moya A., de Lange F.J., et al. 2018 ESC Guidelines for the diagnosis and management of syncope. Eur. Heart J. 2018. 39(21). 1883-1948.
29. Wu J.S., Yang Y.C., Lu F.H., et al. Population-based study on the prevalence and correlates of orthostatic hypotension/hypertension and orthostatic dizziness. Hypertens. Res. 2008. 31(5). 897-904. doi: 10.1291/hypres.31.897.
30. Barochiner J., Cuffaro P.E., Aparicio L.S., et al. Predictors of masked hypertension among treated hypertensive patients: an interesting association with orthostatic hypertension. Am. J. Hypertens. 2013. 26(7). 872-8. doi: 10.1093/ajh/hpt036.
31. Lee H., Kim H.A. Orthostatic hypertension: An underestimated cause of orthostatic intolerance. Clin. Neurophysiol. 2016. 127(4). 2102-7. doi: 10.1016/j.clinph.2015.12.017.
32. Wijkman M., Länne T., Östgren C.J., Nystrom F.H. Diastolic orthostatic hypertension and cardiovascular prognosis in type 2 diabetes: a prospective cohort study. Cardiovasc. Diabetol. 2016. 15. 83. doi: 10.1186/s12933-016-0399-0.
33. Nibouche-Hattab W.N., Lanasri N., Zeraoulia F., et al. Orthostatic hypertension in normotensive type 2 diabetics: What characteristics? Ann. Cardiol. Angeiol. (Paris). 2017. 66(3). 159-64. doi: 10.1016/j.ancard.2017.04.003.
34. Schiefer J., Amthauer H., Genseke P., et al. Position-related renal perfusion disturbances as a possible under-estimated mechanism in patients with resistant hypertension: a case vignette. Int. Urol. Nephrol. 2017. 49(10). 1823-33. doi: 10.1007/s11255-017-1656-1.
35. Tabara Y., Masaki M., Ikezoe T., et al. Small Degree of Lumbar Lordosis as an Overlooked Determinant for Orthostatic Increases in Blood Pressure in the Elderly: The Nagahama Study. Am. J. Hypertens. 2019. 32(1). 61-9. doi: 10.1093/ajh/hpy137.
36. Sun X., Zou R., Luo X., et al. Changes in 25 hydroxyvitamin D level in school-aged children with orthostatic hypertension. Chin. J. Appl. Clin. Pediatr. 2018. 33. 32-5. doi: 10.3760/ cma.j.issn.2095-428X.2018.01.008.
37. Zhao J., Du S., Yang J., et al. Changes in plasma nitric oxide and nitric oxide synthase activity in children with orthostatic hypertension. Chin. Appl. Clin. Pediatr. 2014. 29. 971-3. doi: 10.3760/j.issn.2095-428X.2014.13.005.
38. Tabara Y., Igase M., Miki T., et al. Orthostatic hypertension as a predisposing factor for masked hypertension: the J-SHIPP study. Hypertens. Res. 2016. 39(9). 664-9. doi: 10.1038/ hr.2016.43.
39. Yatsuya H., Folsom A.R., Alonso A., et al.; ARIC Study Investigators. Postural changes in blood pressure and incidence of ischemic stroke subtypes: the ARIC study. Hypertension. 2011. 57(2). 167-73. doi: 10.1161/HYPERTENSION-AHA.110.161844.
40. Fan X.H., Wang Y., Sun K., et al. Disorders of orthostatic blood pressure response are associated with cardiovascular disease and target organ damage in hypertensive patients. Am. J. Hypertens. 2010. 23(8). 829-37. doi: 10.1038/ajh.2010.76.
41. Rahman M., Pradhan N., Chen Z., et al. Orthostatic Hypertension and Intensive Blood Pressure Control; Post-Hoc Analyses of SPRINT. Hypertension. 2021. 77(1). 49-58. doi: 10.1161/HYPERTENSIONAHA.120.15887.
42. Palatini P., Mos L., Saladini F., Rattazzi M. Blood Pressure Hyperreactivity to Standing: a Predictor of Adverse Outcome in Young Hypertensive Patients. Hypertension. 2022. 79. 984-992. https://doi.org/10.1161/HYPERTENSIONAHA.121.18579.
43. Barochiner J., Aparicio L.S., Alfie J., et al. Hemodynamic characterization of hypertensive patients with an exaggerated orthostatic blood pressure variation. Clin. Exp. Hypertens. 2018. 40(3). 287-91. doi:10.1080/10641963.2017.1368539.
44. Thomas R.J., Liu K., Jacobs D.R. Jr., Bild D.E., Kiefe C.I., Hulley S.B. Positional change in blood pressure and 8-year risk of hypertension: the CARDIA study. Mayo Clin. Proc. 2003. 78(8). 951-958.
45. Barochiner J., Cuffaro P.E., Aparicio L.S., et al. Predictors of masked hypertension among treated hypertensive patients: an interesting association with orthostatic hypertension. Am. J. Hypertens. 2013. 26(7). 872-878.
46. Kario K., Matsui Y., Shibasaki S., et al. An alpha-adre-nergic blocker titrated by self-measured blood pressure recordings lowered blood pressure and microalbuminuria in patients with morning hypertension: the Japan Morning Surge-1 Study. J. Hypertens. 2008. 26(6). 1257-1265.
47. Robertson D., Hollister A.S., Biaggioni I., Netterville J.L., Mosqueda-Garcia R., Robertson R.M. The diagnosis and treatment of baroreflex failure. N. Engl. J. Med. 1993. 329(20). 1449-1455.
48. Cleophas T.J., Grabowsky I., Niemeyer M.G., Mäkel W.M., van der Wall E.E.; Nebivolol Follow-Up Study Group. Paradoxical pressor effects of beta-blockers in standing elderly patients with mild hypertension: a beneficial side effect. Circulation. 2002. 105(14). 1669-1671.
49. Suzuki T., Masuda Y., Nonaka M., Kadokura M., Hosoyamada A. Endoscopic thoracic sympathectomy attenuates reflex tachycardia during head-up tilt in lightly anesthetized patients with essential plamar hyperhidrosis. J. Anesth. 2002. 16(1). 4-8.
50. Schiefer J., Amthauer H., Genseke P., Mertens P.R., Chatzikyrkou C. Position-related renal perfusion disturbances as a possible underestimated mechanism in patients with resistant hypertension: a case vignette. Int. Urol. Nephrol. 2017. 49(10). 1823-1833.
/15.jpg)
/15_2.jpg)

/13.jpg)
/16.jpg)
/11.jpg)
/12.jpg)