Международный эндокринологический журнал Том 18, №7, 2022
Вернуться к номеру
Медикаментозне лікування первинного гіперпаратиреозу
Авторы: Гончарова О.А.
Харківський національний медичний університет, м. Харків, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
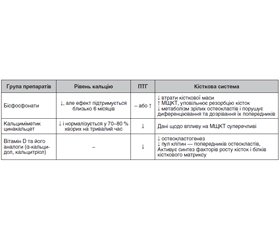
Первинний гіперпаратиреоз (ПГПТ) — це не спровоковане зниженням рівня кальцію у крові гіперпродукування паратгормону (ПТГ), яке призводить до порушення гомеостазу кальцію. Поширеність ПГПТ упродовж останнього 10-річчя зростає у зв’язку з покращенням його діагностики. Сьогодні він посідає третє місце за цим показником після цукрового діабету та тиреоїдної патології. Провідними клінічними проявами ПГПТ є демінералізація та резорбція кісткової тканини, а також нефролітіаз і розвиток ниркової недостатності. Встановлено, що зниження швидкості гломерулярної фільтрації зворотно корелює з рівнем ПТГ та асоціюється з більшим зниженням мінеральної щільності кісткової тканини. Крім того, на тлі значного стійкого підвищення кальціємії підвищується частота гіпертрофії лівого шлуночка серця. Хворі із вказаною симптоматикою внаслідок невстановленого ПГПТ перебувають під наглядом ортопедів, кардіологів, сімейних лікарів. Моніторинг ПГПТ є сьогодні не до кінця відрегульованою проблемою. Це, зокрема, пов’язано з тим, що функціонуюча організаційна система діагностики цієї патології сприяла значному підвищенню як кількості виявлених хворих, так і частки серед них асимптомного ПГПТ. Частина хворих відмовляється від хірургічного втручання, яке зараз визнано оптимальним варіантом лікування ПГПТ. Ще у певної групи хворих мають місце протипоказання до операції у зв’язку з тяжкою коморбідною патологією. Ці фактори підвищують актуальність розробки принципів медикаментозної терапії патології, що потребує серйозного аналізу існуючих на сьогодні медикаментозних препаратів, їх терапевтичних можливостей, ризику ускладнень для відпрацювання клінічних рекомендацій. Саме ці питання й стали основою даної оглядової статті. Проаналізовано базу наукових публікацій за темою ПГПТ і фармакологічні аспекти дії лікарських засобів у хворих на цю патологію. Встановлено, що у повнотекстових статтях з аналізом результативності терапії найчастіше препаратами вибору були бісфосфонати, кальциміметик цинакальцет і вітамін D та його аналоги. Ретельно розглянуто їх перспективи щодо впливу на провідну симптоматику ПГПТ. Результати аналізу дадуть змогу клініцистам вибрати індивідуальну тактику лікування конкретного хворого.
Primary hyperparathyroidism (PHPT) is a hyperproduction of parathyroid hormone that is not provoked by a decrease in the blood calcium level, which leads to a violation of calcium homeostasis. The prevalence of PHPT has been increasing over the past 10 years due to improvements in its diagnosis. Currently, it ranks third by this indicator after diabetes and thyroid pathology. The leading clinical manifestations of PHPT are demineralization and resorption of bone tissue, as well as nephrolithiasis and the development of renal failure. It was found that a decrease in the glomerular filtration rate is inversely correlated with the level of parathyroid hormone and is associated with a greater decrease in bone mineral density. In addition, the frequency of left ventricular hypertrophy increases against the background of a significant persistent increase in calcium. Patients with the indicated symptoms due to an unestablished PHPT are under the supervision of orthopedists, cardiologists, and family doctors. Monitoring of PHPT is not a fully addressed issue today. This, in particular, is due to the fact that the functioning organizational system for the diagnosis of this pathology has significantly increased both the number of identified patients and the proportion of asymptomatic PHPT among them. Some people refuse surgery, which is currently recognized as the best option for the treatment of PHPT. Other patients have contraindications to surgery due to severe comorbid pathology. These factors increase the relevance for the development of the principles of medicinal treatment of pathology, which requires a serious analysis of existing drugs, their therapeutic potential, and the risk of complications in order to develop clinical recommendations. These questions became the basis of this review article. The base of scientific publications on PHPT and pharmacological aspects of the action of drugs in patients with this pathology were analyzed. It was found that among the full-text articles with the analysis of therapy effectiveness, the most common drugs of choice were bisphosphonates, calcimimetic cinacalcet, vitamin D and its analogues. Their prospects for the impact on the main symptoms of PHPT are carefully considered. The results of the analysis will allow clinicians to choose individual treatment approach to a particular patient.
первинний гіперпаратиреоз; бісфосфонати; кальциміметик; вітамін D
primary hyperparathyroidism; bisphosphonates; calcimimetic; vitamin D
- Bilezikian J.P. Primary Hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism. 2018. 103(11). 3993-4004. https://doi.org/10.1210/jc.2018-01225.
- Alore E.A., Suliburk J.W., Ramsey D.J., et al. Diagnosis and Management of Primary Hyperparathyroidism Across the Veterans Affairs Health Care System. JAMA Intern. Med. 2019. 179 (9). 1220-1227. doi: 10.1001/jamainternmed.2019.1747.
- Seib C.D., Meng T., Suh I., Cisco R.M., Lin D.T., Morris A.M., Trickey A.W., Kebebew E. Undertreatment of primary hyperparathyroidism in a privately insured US population: Decreasing utilization of parathyroidectomy despite expanding surgical guidelines. Surgery. 2021. 169 (1). 87-93. doi: 0.1016/j.surg.2020.04.066.
- El-Kishawi A.M., El-Nahas A.M. Renal osteodystrophy: review of the disease and its treatment. Saudi J. Kidney Dis. Transpl. 2006. 17(3). 373-82. PMID: 16970258.
- Dombrowsky A., Borg B., Xie R., Kirklin J.K., Chen H., Balentine C.J. Why Is Hyperparathyroidism Underdiagnosed and Undertreated in Older Adults? Clin. Med. Insights Endocrinol. Diabetes. 2018. 1211. 1179551418815916. doi: 10.1177/1179551418815916.
- Wilhelm S.M., Wang T.S., Ruan D.T., et al. The American Association of Endocrine Surgeons Guidelines for definitive management of primary hyperparathyroidism. JAMA Surg. 2016. 151. 959-968. doi: 10.1001/jamasurg.2016.2310.
- Leere J.S., Karmisholt J., Robaczyk M., Vestergaard P. Contemporary Medical Management of Primary Hyperparathyroidism: A Systematic Review. Front. Endocrinol. 2017. 79 (8). doi: 10.3389/fendo.2017.00079.
- Idris A.I., Rojas J., Greig I.R. et al. Aminobisphosphonates cause osteoblast apoptosis and inhibit bone nodule formation in vitro. Calcif. Tissue Int. 2008. 82 (3). 191-201. DOI: 10.1007/s00223-008-9104-y.
- Gong L., Altman R.B., Klein T.E. Bisphosphonates pathway. Pharmacogenet. Genomics. 2011. 21 (1). 50-3. DOI: 10.1097/FPC.0b013e328335729c.
- Rogers M.J., Crockett J.C., Coxon F.P. et al. Biochemical and molecular mechanisms of action of bisphosphonates. Bone. 2011. 49 (1). 34-41. DOI: 10.1016/j.bone.2010.11.008.
- Jung S.-M., Han S., Kwon H.-Y. Dose-Intensity of Bisphosphonates and the Risk of Osteonecrosis of the Jaw in Osteoporosis Patients. Front. Pharmacol. 2018. 9. 796. DOI: 10.3389/fphar.2018.00796.
- Meyyur Aravamudan V., Er C. Osteonecrosis of the Jaw and Concomitant Atypical Femoral Fractures with Bisphosphonates: A Comprehensive Literature Review. Cureus. 2019. 11 (7). e5113. DOI: 10.7759/cureus.5113.
- Brown J.P., Morin S., Leslie W., Papaioannou A., Cheung A.M., Davison K.S., Goltzman D., et al. Bisphosphonates for treatment of osteoporosis: expected benefits, potential harms, and drug holidays. Can. Fam. Physician. 2014. 60 (4). 324-33. PMID: 24733321; PMCID: PMC404654.
- Langdahl B.L. Overview of treatment approaches to osteoporosis. Br. J. Pharmacol. 2021. 178(9). 1891-1906. doi: 10.1111/bph.15024.
- Wang Y.-K., Zhang Y.-M., Qin S.-Q. et al. Effects of alendronate for treatment of glucocorticoid-induced osteoporosis: A meta-analysis of randomized controlled trials. Medicine (Baltimore). 2018. 97 (42). e12691. DOI: 10.1097/MD.0000000000012691.
- Eastell R., Hannon R.A., Wenderoth D., Rodriguez-Moreno J., Sawicki A. Effect of stopping risedronate after long-term treatment on bone turnover. J. Clin. Endocrinol. Metab. 2011. 96 (11). 3367-3373. doi:10.1210/jc.2011-0412.
- Reid I.R., Horne A.M., Mihov B. et al. Fracture Prevention with Zoledronate in Older Women with Osteopenia. N. Engl. J. Med. 2018. 379 (25). 2407-16. DOI: 10.1056/NEJMoa1808082.
- Jeon H.-L., Oh I.-S., Baek Y.-H. et al. Zoledronic acid and skeletal-related events in patients with bone metastatic cancer or multiple myeloma. J. Bone Miner. Metab. 2020. 38 (2). 254-63. DOI: 10.1007/s00774-019-01052-6.
- Diab D.L., Watts N.B. Bisphosphonate drug holiday: who, when and how long. Ther. Adv. Musculoskelet. Dis. 2013. 5 (3). 107-111. doi: 10.1177/1759720X13477714.
- Maraka S., Kennel K.A. Bisphosphonates for the prevention and treatment of osteoporosis. BMJ. 2015. 351. h3783. doi: 10.1136/bmj.h3783. PMID: 26333528.
- McClung M., Harris S.T., Miller P.D., Bauer D.C., Davison K.S., Dian L., Hanley D.A., et al. Bisphosphonate therapy for osteoporosis: benefits, risks, and drug holiday. Am. J. Med. January 2013. 126 (1). 13-20. doi: 10.1016/j.amjmed.2012.06.023.
- Bauer D.C., Abrahamsen B. Bisphosphonate Drug Holidays in Primary Care: When and What to Do Next? Curr. Osteoporos Rep. 2021. 19(2). 182-188. doi: 10.1007/s11914-021-00660-4.
- Rolighed L., Rejnmark L., Sikjaer T., Heickendorff L., Vestergaard P., Mosekilde L., et al. Vitamin D treatment in primary hyperparathyroidism: a randomized placebo controlled trial. J. Clin. Endocrinol. Metab. 2014. 99. 1072-80. DOI: 10.1210/jc.2013-3978.
- Tsuruta Y., Okano K., Kikuchi K., Tsuruta Y., Akiba T., Nitta K. Effects of cinacalcet on bone mineral density and bone markers in hemodialysis patients with secondary hyperparathyroidism. Clin. Exp. Nephrol. 2013. 17 (1). 120-6. doi: 10.1007/s10157-012-0665-8.
- Díaz-Tocados J.M., Rodríguez-Ortiz M.E., Almadén Y., Pineda C., Martínez-Moreno J.M., Herencia C., Vergara N., et al. Calcimimetics maintain bone turnover in uremic rats despite the concomitant decrease in parathyroid hormone concentration. Kidney Int. 2019. 95 (5). 1064-1078. doi: 10.1016/j.kint.2018.12.015.
- Faggiano A., Di Somma C., Ramundo V., Severino R., Vuolo L., Coppola A., Panico F., et al. Cinacalcet hydrochloride in combination with alendronate normalizes hypercalcemia and improves bone mineral density in patients with primary hyperparathyroidism. Endocrine. 2011. 39 (3). 283-7. doi: 10.1007/s12020-011-9459-0.
- Brardi S., Cevenini G., Verdacchi T., Romano G., Ponchietti R. Use of cinacalcet in nephrolithiasis associated with normocalcemic or hypercalcemic primary hyperparathyroidism: results of a prospective randomized pilot study. Arch. Ital. Urol. Androl. 2015. 87 (1). 66-71. DOI 10.4081/aiua.2015.1.66.
- Kaminskyi O.V., Pankiv V.I., Pankiv I.V., Afanasyev D.E. Vitamin D content in population of radiologically contaminated areas in Chernivtsi oblast (pilot project). Probl. Radiac. Med. Radiobiol. 2018. 23. 442-451. doi: 10.33145/2304-8336-2018-23-442-451. PMID: 30582861.
- Souberbielle J.-C., Bienaimé F., Cavalier E., Cormier C. Vitamin D and primary hyperparathyroidism (PHPT). Annales d’Endocrinologie. 2012. 73 (3). 165-169. doi.org/10.1016/j.ando.2012.04.008.
- Walker M.D., Bilezikian J.P. Vitamin D and primary hyperparathyroidism: more insights into a complex relationship. Endocrine. 2017. 55. 3-5. doi.org/10.1007/s12020-016-1169-1.
- Akkawi I., Zmerly H. Osteoporosis: Current Concepts. Joints. 2018. 6 (2). 122-127. doi: 10.1055/s-0038-1660790.
- Föger-Samwald U., Dovjak P., Azizi-Semrad U., Kerschan-Schindl K., Pietschmann P. Osteoporosis: Pathophysiology and therapeutic options. EXCLI J. 2020. 19. 1017-1037. doi: 10.17179/excli2020-2591.
- Rajković J., Stojanović S., Dorđević L., Cvetković T., Stevo Najman. Locally applied cholecalciferol and alfacalcidol act differently on healing of femur defects filled with bone mineral matrix and platelet-rich plasma in ovariectomized rats. Biotechnology & Biotechnological Equipment. 2015. 29 (5). 963-969. DOI: 10.1080/13102818.2015.1055702.
- Nakamura Y., Suzuki T., Kamimura M., Murakami K., Ikegami S., Uchiyama S., Kato H. Vitamin D and calcium are required at the time of denosumab administration during osteoporosis treatment. Bone Res. 2017. 5. 17021. doi: 10.1038/boneres.2017.21.
- Kobayakawa T., Miyazaki A., Takahashi J., Nakamura Y. Effects of romosozumab with and without active vitamin D analog supplementation for postmenopausal osteoporosis. Clinical Nutrition Espen. 2022. 48. 267-274. DOI: https://doi.org/10.1016/j.clnesp.2022.02.002.
- Walker M.D., Cong E., Lee J.A., et al. Low vitamin D levels have become less common in primary hyperparathyroidism. Osteoporos Int. 2015. 26 (12). 2837-2843. doi:10.1007/s00198-015-3199-6.
- Lindeman B.M., Pesce C.E., Tsai H.L., et al. Lower vitamin D levels in surgical hyperparathyroidism versus thyroid patients. Am. Surg. 2014. 80 (5). 505-510. PMID: 24887732; PMCID: PMC4362715.
- Liu Y., Guo S., Wu J., et al. Changes in clinical patterns of Chinese patients with primary hyperparathyroidism in the past 12 years: a single-center experience. Endocr. Connect. 2021. 10(11). 1428-1434. doi:10.1530/EC-21-0382.
- Aydoğan N.H., Özel İ., İltar S., Kara T., Özmeriç A., Alemdaroğlu K.B. The effect of vitamin D and bisphosphonate on fracture healing: An experimental study. J. Clin. Orthop. Trauma. 2016. 7 (2). 90-94. doi: 10.1016/j.jcot.2016.01.003.
- Innao V., Allegra A., Ginaldi L., Pioggia G., De Martinis M., Musolino C., Gangemi S. Reviewing the Significance of Vitamin D Substitution in Monoclonal Gammopathies. Int. J. Mol. Sci. 2021. 22. 4922. https://doi.org/10.3390/ ijms22094922.
- Yao P., Bennett D., Mafham M., et al. Vitamin D and Calcium for the Prevention of Fracture: A Systematic Review and Meta-analysis. JAMA Netw. Open. 2019. 2 (12). e1917789. doi: 10.1001/jamanetworkopen.2019.17789.

/57.jpg)