Журнал «Медицина неотложных состояний» Том 18, №6, 2022
Вернуться к номеру
Гострий коронарний синдром у хворих на цукровий діабет: клінічні характеристики і діагностика болю
Авторы: Галушко О.А., Болюк М.В.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
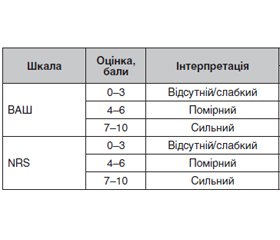
Актуальність. Гострий коронарний синдром (ГКС) залишається частою причиною госпіталізації хворих на цукровий діабет (ЦД). Через частий розвиток діабетичної нейропатії вважається, що для даної категорії пацієнтів характерна висока частота атипового перебігу гострого коронарного синдрому, але дані про це досить суперечливі. Мета дослідження: визначити особливості перебігу больового синдрому та ступінь його вираженості у пацієнтів з гострим коронарним синдромом та супутнім цукровим діабетом. Матеріали та методи. У дослідженні взяли участь 36 пацієнтів з ЦД (22 чоловіки та 14 жінок) віком 44–86 років, госпіталізованих ургентно з приводу ГКС. Оцінка больового синдрому проводилася на момент госпіталізації та одразу після реваскуляризації коронарних артерій за наступними критеріями: візуально-аналоговою шкалою (ВАШ), цифровою оцінювальною шкалою (NRS), клінічними даними і біохімічними маркерами. Результати. Більша частина пацієнтів (91,67 %) на момент госпіталізації скаржилася на біль у грудях, решту не турбував жоден біль. Під час опитування хворі описували біль як «печіння» (30,56 %), «стискання» (30,56 %), «здавлення» (25,0 %), «поколювання» (5,56 %). Також були скарги на тяжкість під час дихання (13,89 %), відчуття нестачі повітря (11,1 %), серцебиття (41,67 %). Появу надмірного потовиділення відзначили 16,67 % пацієнтів. Статистично значущої відмінності між результатами оцінки болю за ВАШ та NRS не виявлено (p > 0,1). Середній рівень глікемії на момент госпіталізації становив 8,19 ± 3,45 ммоль/л (у чоловіків — 8,17 ± 3,61 ммоль/л, у жінок — 8,28 ± 3,13 ммоль/л). Глікемія більше ніж 10,0 ммоль/л виявлена у 8 пацієнтів, що становило 22,22 % усіх хворих. Серед цієї категорії пацієнтів переважали хворі із сильним больовим синдромом (62,5 %). Висновки. У пацієнтів з інфарктом міокарда та цукровим діабетом переважала типова клінічна картина ГКС (91,67 % пацієнтів) над безбольовою формою. До реваскуляризації помірний та сильний біль зустрічався з однаковою частотою; відсутня статистична відмінність між рівнями артеріального тиску, частотою серцевих скорочень та глікемії (p > 0,1) у пацієнтів з сильним та помірним больовим синдромом. Гіперглікемія (≥ 10,0 ммоль/л) виявлена у 22,22 % хворих, серед яких переважали хворі із сильним больовим синдромом.
Background. Acute coronary syndrome (ACS) remains a common cause of hospitalization in patients with diabetes mellitus. Due to the frequent development of diabetic neuropathy, it is believed that this category of patients is characterized by a high frequency of atypical acute coronary syndrome, but data on this are quite contradictory. The objective: to determine the features of pain syndrome and its severity in people with acute coronary syndrome and concomitant diabetes. Materials and methods. The study involved 36 patients with diabetes (22 men and 14 women) aged 44–86 years who were hospitalized urgently for ACS. Pain syndrome was assessed upon admission and immediately after coronary artery revascularization according to the following criteria: visual analog scale, numerical rating scale, clinical data, and biochemical markers. Results. Most patients (91.67 %) at the time of hospitalization complained of chest pain, the rest were not bothered by any pain. During the survey, patients described pain as “burning” (30.56 %), “squeezing” (30.56 %), “pressing” (25.0 %), “tingling” (5.56 %). There were also complaints of difficulty breathing (13.89 %), shortness of breath (11.1 %), palpitations (41.67 %). The appearance of excessive sweating was noticed in 16.67 % of cases. There was no statistically significant difference between the results of pain assessment by visual analog scale and numerical rating scale (p > 0.1). The average value of glycemia at the time of hospitalization was 8.19 ± 3.45 mmol/l (men — 8.17 ± 3.61 mmol/l, women — 8.28 ± 3.13 mmol/l). Glycemia greater than 10.0 mmol/l was detected in 8 patients, which was 22.22 % of all patients. Most people (62.5 %) in this category had severe pain. Conclusions. In patients with ACS and diabetes, the typical clinical picture of ACS prevailed (91.67 % of cases) over the painless form. Before revascularization, moderate and severe pain occurred with equal frequency; there is no statistical difference between blood pressure, heart rate and glycemia (p > 0.1) in patients with severe and moderate pain. Hyperglycemia (≥ 10.0 mmol/l) was found in 22.22 % of patients; among them, people with severe pain prevailed.
цукровий діабет; гострий коронарний синдром; больовий синдром
diabetes mellitus; acute coronary syndrome; pain syndrome
Матеріали та методи
Результати
Обговорення
Висновки
- IDF Diabetes Atlas 2021 — 10th edition. Access: www.diabetesatlas.org.betesatlas.org.
- Chen L., Islam R.M., Wang J., Hird T.R., Pavkov M.E., et al. A systematic review of trends in all-cause mortality among people with diabetes. Diabetologia. 2020 Sep. 63(9). 1718-1735. doi: 10.1007/s00125-020-05199-0. Epub 2020 Jul 6. PMID: 32632526.
- Feldman E.L., Callaghan B.C., Pop-Busui R., Zochodne D.W., Wright D.E., Bennett D.L., Bril V., Russell J.W., Viswanathan V. Diabetic neuropathy. Nat. Rev. Dis. Primers. 2019 Jun 13. 5(1). 41. doi: 10.1038/s41572-019-0092-1. PMID: 31197153.
- Iqbal Z., Azmi S., Yadav R., Ferdousi M., Kumar M., Cuthbertson D.J., Lim J., Malik R.A., Alam U. Diabetic Peripheral Neuropathy: Epidemiology, Diagnosis, and Pharmacotherapy. Clin. Ther. 2018 Jun. 40(6). 828-849. doi: 10.1016/j.clinthera.2018.04.001. Epub 2018 Apr 30. PMID: 29709457.
- Sloan G., Selvarajah D., Tesfaye S. Pathogenesis, diagnosis and clinical management of diabetic sensorimotor peripheral neuropathy. Nat. Rev. Endocrinol. 2021 Jul. 17(7). 400-420. doi: 10.1038/s41574-021-00496-z. Epub 2021 May 28. PMID: 34050323.
- Ängerud K.H., Thylén I., Sederholm Lawesson S., Eliasson M., Näslund U., Brulin C.; SymTime Study Group. Symptoms and delay times during myocardial infarction in 694 patients with and without diabetes; an explorative cross-sectional study. BMC Cardiovasc. Disord. 2016 May 26. 16(1). 108. doi: 10.1186/s12872-016-0282-7. PMID: 27386934; PMCID: PMC4937542.
- Canto J.G., Shlipak M.G., Rogers W.J., Malmgren J.A., Fre–derick P.D., Lambrew C.T., Ornato J.P., Barron H.V., Kiefe C.I. Prevalence, clinical characteristics, and mortality among patients with myocardial infarction presenting without chest pain. JAMA. 2000 Jun 28. 283(24). 3223-9. doi: 10.1001/jama.283.24.3223. PMID: 10866870.
- Berman N., Jones M.M., De Coster D.A. 'Justlike a normalpain', what do people with diabetes mellitus experience when having a myocardial infarction: a qualitative study recruited from UK hospitals. BMJ Open. 2017 Sep 15. 7(9). e015736. doi: 10.1136/bmjopen-2016-015736. PMID: 28918410; PMCID: PMC5640147.
- Halushko O., Boliuk M. The risks and difficulties of diagno–sing myocardial infarction in diabetic patients (review and own experience). Emergency Medicine. 2020. 16(2). 37-41. doi: 10.22141/ 2224-0586.16.2.2020.203139.
- Johnson C.A.H., Pitta N.C., Dessotte C.A.M., Dantas R.A.S., Rossi L.A. Knowledge, attitudes, and beliefs about acute coronary syndrome among patients with type 2 diabetes. Rev. Lat. Am. Enfermagem. 2021 Nov 19. 29. e3503. doi: 10.1590/1518-8345.5435.3503. PMID: 34816872; PMCID: PMC8616171.
- Neumann F.J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U., et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Euro Intervention. 2019 Feb 20. 14(14). 1435-1534. doi: 10.4244/EIJY19M01_01. PMID: 30667361.
- Unifikovanyy klinichnyy protocol ekstrenoyi, pervynnoyi, vtorynnoyi (spetsializovanoyi), tretynnoyi (vysokospetsializovanoyi) medychnoyi dopomohy ta kardioreabilitatsiyi «hostryy koronarnyy syndrom z elevatsiyeyu sehmenta ST». Approved by the Order of the Ministry of Health of Ukraine of September 14, 2021 № 1936. Available at: https://zakon.rada.gov.ua/rada/show/v1936282-21#Text.
- Sung Y.T., Wu J.S. The Visual Analogue Scale for Rating, Ranking and Paired-Comparison (VAS-RRP): A new technique for psychological measurement. Behav. Res. Methods. 2018 Aug. 50(4). 1694-1715. doi: 10.3758/s13428-018-1041-8. PMID: 29667082; PMCID: PMC6096654.
- Heller G.Z., Manuguerra M., Chow R. How to analyze the Visual Analogue Scale: Myths, truths and clinical relevance. Scand. J. Pain. 2016 Oct. 13. 67-75. doi: 10.1016/j.sjpain.2016.06.012. Epub 2016 Jul 27. PMID: 28850536.
- Shafshak T.S., Elnemr R. The Visual Analogue Scale Versus Numerical Rating Scale in Measuring Pain Severity and Predicting Disability in Low Back Pain. J. Clin. Rheumatol. 2021 Oct 1. 27(7). 282-285. doi: 10.1097/RHU.0000000000001320. PMID: 31985722.
- Kim Y.S., Park J.M., Moon Y.S., Han S.H. Assessment of pain in the elderly: A literature review. Natl. Med. J. India. 2017 Jul-Aug. 30(4). 203-207. doi: 10.4103/0970-258X.218673. PMID: 29162753.
- Williamson A., Hoggart B. Pain: a review of three commonly used pain rating scales. J. Clin. Nurs. 2005 Aug. 14(7). 798-804. doi: 10.1111/j.1365-2702.2005.01121.x. PMID: 16000093.
- Fu R., Li S.-D., Song C.-X., Yang J.-A., Xu H.-Y., Gao X.-J., et al. Clinical significance of diabetes on symptom and patient delay among patients with acute myocardial infarction — an analysis from China Acute Myocardial Infarction (CAMI) registry. J. Geriatr. Cardiol. May 2019. 16(5). 395-400. doi: 10.11909/j.issn.1671-5411.2019.05.002. PMID: 31217792; PMCID: PMC6558571.
- Arnold S.V., Spertus J.A., Lipska K.J., Tang F., Goyal A., McGuire D.K., et al. Association between diabetes mellitus and angina after acute myocardial infarction: analysis of the TRIUMPH prospective cohort study. Eur. J. Prev. Cardiol. 2015 Jun. 22(6). 779-87. doi: 10.1177/2047487314533622. Epub 2014 Apr 16. PMID: 24740679; PMCID: PMC4199926.
- Read S.H., Fischbacher C.M., Colhoun H.M., Gasevic D., Kerssens J.J., McAllister D.A., et al. Trends in incidence and case fatality of acute myocardial infarction, angina and coronary revascularization in people with and without type 2 diabetes in Scotland between 2006 and 2015. Diabetologia. 2019 Mar. 62(3). 418-425. doi: 10.1007/s00125-018-4796-7. Epub 2019 Jan 17. PMID: 30656362; PMCID: PMC7019674.
- Draman M.S., Thabit H., Kiernan T.J., O’Neill J., Sreenan S., McDermott J.H. A silent myocardial infarction in the diabetes outpatient clinic: case report and review of the literature. Endocrinol. Diabetes Metab. Case Rep. 2013. 2013. 130058. doi: 10.1530/EDM-13-0058. Epub 2013 Oct 28. PMID: 24616778; PMCID: PMC3921998.
- Tracey I., Woolf C.J., Andrews N.A. Composite Pain Biomarker Signatures for Objective Assessment and Effective Treatment. Neuron. 2019 Mar 6. 101(5). 783-800. doi: 10.1016/j.neuron.2019.02.019. PMID: 30844399; PMCID: PMC6800055.
- Cowen R., Stasiowska M.K., Laycock H., Bantel C. Assessing pain objectively: the use of physiological markers. Anaesthesia. 2015 Jul. 70(7). 828-47. doi: 10.1111/anae.13018. Epub 2015 Mar 14. PMID: 25772783.
- Cosentino F., Grant P.J., Aboyans V., Bailey C.J., Ceriello A., Delgado V., et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur. Heart J. 2020 Jan 7. 41(2). 255-323. doi: 10.1093/eurheartj/ehz486. Erratumin: Eur. Heart J. 2020 Dec 1. 41(45). 4317. PMID: 31497854.
- Hirsch I.B., O’Brien K.D. How to best manage glycemia and non-glycemia during the time of acute myocardial infarction. Diabetes Technol. Ther. 2012 Jun. 14 Suppl. 1 (Suppl. 1). S22-32. doi: 10.1089/dia.2012.0095. PMID: 22650221; PMCID: PMC3388496.

/26.jpg)
/27.jpg)