Вступ
Поширеність шлункових вариксів (ШВ) у хворих із портальною гіпертензією коливається від 17 до 25 % [1]. Вони можуть кровоточити при низькому тиску, і кровотеча, як правило, інтенсивна, що викликає більшу потребу в переливанні крові, складність у контролюванні, рецидив та смертність [2]. На відміну від стравохідних вариксів (СВ) кровотеча зі ШВ більше пов’язана з їх розміром, товщиною стінки та наявністю ознак червоного кольору. СВ зазвичай наявні у власній пластинці слизової оболонки та підслизовому шарі, тоді як ШВ лежать глибоко в підслизовій оболонці, тому їх складно відрізнити від помітних шлункових складок за допомогою стандартної ендоскопії, необхідне проведення ендосонографії (ЕСГ).
Через тяжкість варикозної кровотечі та високий ризик рецидиву з’явилися різні ендоскопічні та інтервенційні радіологічні методи лікування. Лікування під контролем ЕСГ стало багатообіцяючим втручанням із високим рівнем клінічного та технічного успіху та низькою частотою повторної кровотечі. Дана стаття присвячена огляду літератури, отриманої з бази MedLine, із застосування ЕСГ для різноманітних втручань у хворих із варикозно розширеними венами шлунка.
Лікування під контролем EСГ
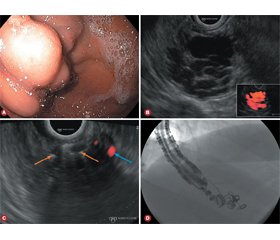
ЕСГ є цінним інструментом для діагностики, планування й оцінки ефективності лікування ШВ, визначення небезпеки повторної кровотечі, а також допомагає візуалізувати варикозне розширення вен, перфорантні і колатеральні вени та дозволяє прогнозувати варикси високого ризику. Під час стандартної ендоскопії верхніх відділів наявність ШВ часто складно визначити, особливо при активній кровотечі [3]. Крім того, не завжди легко оцінити розмір та наявність живлячих судин. Це особливо важливо, оскільки фактори ризику повторної кровотечі зі ШВ включають розмір варикозного розширення і наявність парашлункових вен [4]. Із цієї причини EСГ може мати переваги в лікуванні ШВ, оскільки вона може краще візуалізувати стінку шлунка та пов’язану з нею судинну мережу, навіть в умовах активної кровотечі [5] (рис. 1). Перевагою EСГ перед стандартною ендоскопією також є можливість негайної післялікувальної допплерівської оцінки варикозного ложа та його аферентних притоків, щоб забезпечити повну облітерацію [6, 7].
Останнім часом досягнення в ендоваскулярній терапії під контролем EСГ дозволили впроваджувати нові втручання [8]. Хоча EСГ може бути корисною як діагностичний допоміжний засіб, її терапевтичний потенціал набув більшого визнання останнім часом. Під контролем EСГ різні гемостатичні адгезиви та пристрої можуть бути введені в ШВ, включаючи ціаноакрилат (EСГ-ЦA) (рис. 2), спіралі (EСГ-СП), спіралі і ЦA (EУСГ-СП/ЦА), тромбін (EСГ-ТР) і спіралі з желатиновою губкою, що розсмоктується (EУСГ-СП/РЖГ) [9].
Використання ЦА і тромбіну
Не можна нехтувати побічними ефектами, пов’язаними з ін’єкцією ціаноакрилату, такими як церебральна або легенева емболія, інфаркт селезінки, кровотеча з післяін’єкційних виразок та пошкодження ендоскопа, особливо в пацієнтів із великим портосистемним шунтом. Ризик потенційно смертельної емболії збільшується з підвищенням кількості введеного ЦA [10]. Потенційним недоліком прямої ендоскопічної ін’єкції ЦA (ПЕІ-ЦА) є те, що підтвердження облітерації варикозних вен стандартною ендоскопією є суб’єктивним і залежить від визначення «затвердіння» варикозного розширення вен після ін’єкції [11].
Хоча ін’єкція ЦА під контролем EСГ знижує частоту емболічних ускладнень внаслідок зменшення об’єму ЦА, що вводиться, його використання під час гострої кровотечі зі ШВ обмежене в більшості центрів через відсутність ендоскопістів, які мають досвід роботи з EСГ. У двох частинах обсерваційного порівняльного дослідження, проведеного Y.T. Lee зі співавт. [12], порівнювалися двотижневі ін’єкції ЦА під контролем EСГ пацієнтам із гострою кровотечею від будь-якого типу ШВ із терапією «на вимогу», при цьому стандартна ендоскопія та ін’єкція ЦА проводилися лише під час повторної кровотечі. Значне зменшення повторної кровотечі було продемонстровано в групі активного ендоскопічного лікування (35 проти 70 %, P = 0,0006). Не було впливу на смертність, найімовірніше, через невелику кількість пацієнтів у дослідженні. R. Romero-Castro зі співавт. у невеликій серії випадків вводили ЦА-ліпіодол у ШВ на рівні перфорантних вен під контролем EСГ [13]. Усі процедури пройшли успішно, без повторних кровотеч та інших ускладнень під час спостереження. Вони постулювали, що націлювання на перфорантні вени призведе до максимального блокування кровотоку, при цьому необхідна менша кількість ЦА, що може знизити рівень потенційних місцевих і системних ускладнень. M.C. Franco зі співавт. розглядали 20 пацієнтів, яким було проведено EСГ-ЦA для первинної профілактики, і облітерація була успішною у всіх пацієнтів. Лише 1 із 20 пацієнтів мав рецидив ШВ та повторні кровотечі [14]. Для лікування гострої кровотечі зі ШВ J.M. Gonzalez зі співавт. описали 3 пацієнтів, яким було проведено EСГ-ЦA з успішним гемостазом [15]. У 2013 році R. Romero-Castro зі співавт. описали когорту з 10 пацієнтів з активною кровотечею зі ШВ, яким було проведено EСГ-ЦA з успішним гемостазом у всіх випадках [16]. B.L. Bick зі співавт. порівняли ін’єкцію ЦА під контролем EСГ із прямою ендоскопічною ін’єкцією в ретроспективній когорті з 104 пацієнтів зі ШВ [17]. Техніка під контролем EСГ потребувала меншого середнього об’єму ЦА (2,0 проти 3,3 мл), який вводився у більшу кількість варикозних вен (1,6 проти 1,1) із подібними побічними явищами порівняно з прямою ендоскопічною ін’єкцією. Крім того, повторні кровотечі зі ШВ та шлунково-кишкові кровотечі, не пов’язані зі ШВ (9 проти 24 %, P = 0,045, і 19 проти 50 %, P < 0,001, відповідно), були менш частими в групі під контролем ЕСГ.
В останньому метааналізі B.P. Mohan зі співавт. порівняли лікування під контролем ЕСГ із прямою ендоскопічною ін’єкцією ЦА, використовуючи дані 23 досліджень (851 пацієнт) та 28 досліджень (3467 пацієнтів) відповідно [18]. Загалом 28 % включених пацієнтів мали шлунково-стравохідні варикси 1-го типу, 48 % — шлунково-стравохідні варикси 2-го типу і 24 % — ізольовані шлункові варикси 1-го типу. Не було жодної різниці в ефективності загального лікування (94 проти 91 %), об’єднаній частоті рецидивів (9 проти 18 %), ранніх повторних кровотеч (7 проти 5 %) або об’єднаній частоті пізніх кровотеч, повторної кровотечі (12 проти 17 %) між лікуванням під контролем EСГ та прямою ендоскопічною ін’єкцією ЦА. Об’єднана частота облітерації ШВ була значно вищою в групі під контролем EСГ (84 проти 63 %). Однак терапія під контролем EСГ є складною, дорогою та вимагає спеціальної підготовки, а це всі фактори, які можуть обмежувати її широку корисність.
EСГ-ЦA має подібний профіль побічних ефектів, як і ПEI-ЦA. Біль у животі спостерігався у 8–15 %, лихоманка — у 8–9 % та транзиторна бактеріємія — у 2–6 % пацієнтів [17]. Виразка в місці ін’єкції визначалася в 3 % пацієнтів, які проходили цю процедуру [19]. Системна емболія також відмічається навіть під контролем EСГ. R. Romero-Castro зі співавт. відзначили тромбоемболію легеневої артерії в 9 з 19 пацієнтів (47 %), які перенесли EСГ-ЦA; вона перебігала безсимптомно і була виявлена під час рутинної візуалізації, виконаної як частина протоколу дослідження [16]. В інших дослідженнях тромбоемболію легеневої артерії відзначали у 2–6 % пацієнтів, а інфаркти селезінки — у 2–6 % [17].
Ін’єкція тромбіну під контролем EСГ була вперше описана J. Frost і S. Hebbar у 2018 р. Восьми пацієнтам зі ШВ вводили тромбін. П’ять із 8 пацієнтів пройшли EСГ-ТР для первинної профілактики з облітерацією, що спостерігалася у 4 пацієнтів, і жодної повторної кровотечі не діагностували. Із 3 пацієнтів з активною кровотечею EСГ-ТР призвів до успішного гемостазу у 2 пацієнтів. На жаль, в іншого пацієнта зміни кровообігу не було. Ця процедура була безпечною в цій когорті без ускладнень, пов’язаних із процедурою [20].
Використання спіралей
Ідея розгортання емболізаційних спіралей у аферентних судинах ШВ була однією з останніх розробок в ендоваскулярній терапії під контролем EСГ. Ці емболізаційні спіралі діють як сітка, що індукує агрегацію тромбоцитів і ще більше перешкоджає потоку в живильній судині, що призводить до повної облітерації варикозних вен [21] (рис. 3). Введення спіралі у ШВ було вперше описане R. Romero-Castro зі співавт. у 2010 році [22]. Вони провели первинну профілактику ШВ за допомогою спіралі в 4 пацієнтів і виявили, що розміщення спіралі знищило варикозне розширення вен у 3 пацієнтів без ускладнень і міграцій [22]. K.F. Binmoeller та співавт. [23] були першими, хто опублікував дані про ефективність та безпеку комбінованої ін’єкції ЦА у ШВ під контролем EСГ, переважно в пацієнтів, які одужали після гострої кровотечі зі ШВ (n = 28/30). Ця ж група повідомила про ширшу когорту пацієнтів (n = 152) через кілька років із високим рівнем облітерації (93 %) під час наступної ендоскопії, низьким рівнем повторної кровотечі (16 з 50 % випадків повторної кровотечі неварикозного походження) і небагато побічних ефектів, пов’язаних із процедурою (7 %; 4/9 пацієнтів з болем у животі, 1/9 пацієнтів із тромбоемболією легеневої артерії) [24]. Слід зазначити, що 26 % пацієнтів у цьому дослідженні проходили лікування як первинну профілактику, що є унікальним у базі доказів лікування ШВ.
/42.jpg)
Як і у разі з EСГ-ЦA, стандартизованого підходу до цієї процедури не існує. Ехоендоскоп розташовують або в дистальному відділі стравоходу для трансстравохідного транскрурального доступу [24], або в шлунку для трансшлункового доступу [25] для ін’єкції спіралі. Спіралі діаметром від 5 до 20 мм [25] вводяться у варикс через голку для аспірації, використовуючи стилет як штовхач. Кольоровий допплер застосовується, щоб підтвердити відсутність потоку всередині варикса.
T. Khoury зі співавт. обстежили 10 пацієнтів зі ШВ, яким була проведена EСГ-СП або для первинної профілактики, або при активній кровотечі [26]. У 7 пацієнтів була майже повна ерадикація, тоді як решта (3 пацієнти) потребувала повторних введень спіралі [26]. L.L. Fujii-Lau зі співавт. описали 2 пацієнтів, яким була проведена EСГ-СП з облітерацією ШВ, відзначеною в обох хворих [27].
У ретроспективному багатоцентровому дослідженні R. Romero-Castro зі співавт. [16] порівнювали результати 30 пацієнтів, яким була проведена спіралізація під контролем EСГ (n = 11), із тими, хто проходив ін’єкцію ЦА у ШВ під контролем ЕСГ (n = 19), які раніше мали кровотечу (n = 23) або були без кровотечі (n = 7), обидва методи були високоефективними в облітерації варикозних вен (96,7 % кумулятивно) без різниці в частоті повторної кровотечі. Групі із ЦА було потрібно більше сеансів для досягнення облітерації (29 сеансів проти 14 сеансів, P = 0,29), і вона мала меншу частку пацієнтів, які досягли облітерації варикозно розширених вен після одного ендоскопічного сеансу (18 проти 82 %), а також мали більшу кількість зареєстрованих побічних ефектів (58 проти 9 %, P < 0,01). Проте більшістю небажаних явищ були безсимптомні тромбоемболії легеневої артерії, виявлені під час рутинної комп’ютерної томографії (КТ) грудної клітки пацієнтів після процедури, без різниці в частоті симптоматичних побічних явищ між групами. Варто також зазначити, що в цьому дослідженні в групі ЦА була представлена статистично значуща більша частка пацієнтів із кровоточивими варикозними венами та цирозом із статусом Child-Pugh C.
Двадцять п’ять відсотків пацієнтів зі ШВ можуть мати портосистемні шунти, такі як шлунково-ниркові шунти, що є умовою, яка пов’язана з високим ризиком системної емболії, коли ЦА вводиться окремо; отже, ці пацієнти можуть отримати користь від спіральної терапії без ін’єкції ЦА [5].
Якщо спіралі мають відповідний розмір, тобто коли вони перевищують 120 % діаметра варикса, ризик міграції зводиться до мінімуму. Однак можуть виникнути побічні явища, такі як перфорація, кровотеча та видавлювання спіралі.
Комбінована терапія під контролем ЕСГ
Замість того, щоб вводити ін’єкційні спіралі, кілька груп виступають за поєднання ін’єкції спіралі та клею, сподіваючись, що ці два способи діють синергічно, щоб зупинити кровотечу, мінімізуючи дистальну емболію. Введення металевих емболізаційних мікроспіралей можна поєднати з введенням ціаноакрилатного клею у процедурі, яка має на меті запобігти системній емболії ЦА, оскільки спіралі можуть служити каркасом для полімеризації, а також потребують меншого об’єму клею в результаті точної доставки в цільову притоку [7, 28] (рис. 4).
/43.jpg)
Y.M. Bhat зі співавт. опублікували велику серію випадків за участю 151 пацієнта зі ШВ, яким було проведено успішне EСГ-СП/ЦА, з яких 125 мали клінічне або ендоскопічне/EСГ подальше спостереження. Двадцять пацієнтів (16 %) мали ранню (n = 12) або пізню (n = 8) кровотечу після лікування. Із 100 пацієнтів із подальшим ЕСГ 73 хворі мали повну облітерацію за одну процедуру, 14 — потребували додаткових процедур для успішної облітерації, у трьох — не вдалося видалити, а у 4 — ШВ були спочатку облітеровані із залишковими варикозними розширеннями, виявленими під час спостереження [24]. Це велике дослідження показало, що EСГ-СП/ЦА ефективна при лікуванні ШВ.
Аналогічно S. Kozieł зі співавт. виконували EСГ-СП/ЦА для первинної профілактики в 6 пацієнтів із задокументованою облітерацією у всіх пацієнтів [25]. Для лікування ШВ, що активно кровоточать, Y.M. Bhat зі спів–авт. виконали EСГ-СП/ЦА 7 пацієнтам з успішним гемостазом у всіх пацієнтів [24]. X.M. Wang зі співавт. описали 1 пацієнта [5], а K.F. Binmoeller зі співавт. — 2 пацієнтів [23] з активною кровотечею, які успішно вилікувалися за цією методикою. У своїй когорті K.F. Binmoeller зі співавт. також виявили, що з 24 пацієнтів, направлених на вторинну профілактику, у 23 була повна облітерація ШВ після одного сеансу лікування EСГ-СП/ЦА. У 1 пацієнта з успішним повторним лікуванням спостерігалася повторна кровотеча [23]. Аналогічно S. Kozieł зі співавт. описали EСГ-СП/ЦА для вторинної профілактики в 10 пацієнтів із повною облітерацією у всіх пацієнтів [25]. L.L. Fujii-Lau зі співавт. також описали EСГ-СП/ЦА для вторинної профілактики в 3 пацієнтів без задокументованих епізодів повторної кровотечі [27].
Розміщення спіралі з ЦA або без нього може мати супутні несприятливі наслідки. R. Romero-Castro зі спів–авт. спостерігали видавлювання спіралей у просвіт шлунка з рубцюванням слизової в 1 з 11 пацієнтів (9 %) [16]. Про незначну шлунково-кишкову кровотечу з місця проколу повідомлялося в 6–50 % випадків [25], а про незначну кровотечу зі спіралі або екструзії ЦA — у 3 % випадків [24]. Дистальна емболія залишається проблемою при EСГ-СП/ЦА; Y.M. Bhat зі спів–авт. спостерігали тромбоемболію легеневої артерії в 1 із 125 пацієнтів (0,8 %) [24]; а M.R. De Almeida Lôbo зі співавт. — у 4 із 16 пацієнтів (25 %) [11].
Метааналіз, що включав дані про 3 ендоваскулярні методи лікування під контролем EСГ, а саме ін’єкції ЦА, тільки спіралі та комбіновану терапію з емболізацією спіраллю та ін’єкцією ЦА, показав, що комбіноване лікування є кращим. Крім того, автори повідомили про нижчу частоту небажаних явищ для комбінованої терапії під контролем EСГ, ніж для ін’єкції ЦА (10 проти 21 %, P < 0,01), тоді як подібні показники побічних явищ були відзначені для комбінованої терапії під контролем EСГ та лише спіралі (10 проти 3 %, P = 0,06) [29].
Було проведено єдине рандомізоване дослідження, в якому оцінювали комбінацію спіралі та ін’єкції ЦА з використанням тільки спіралі, повідомляючи про більшу частоту зникнення варикозної вени безпосередньо після процедури (87 проти 13 %, P < 0,001) та нижчу частоту повторних кровотеч (3,3 проти 20 %, P = 0,04), частоту повторної появи варикозного розширення вен під час наступної ендоскопії через 3 місяці (13 проти 47 %, P < 0,001) і частоту повторного втручання (17 проти 40 %, P = 0,045) при комбінованій терапії [30]. Сукупний рівень смертності у 28 % у цьому дослідженні, незважаючи на відносно збережену функцію печінки в учасників (90 % Child-Pugh A, медіана MELD 9,5 на момент реєстрації), викликає занепокоєння і є дещо незрозумілим, особливо враховуючи, що 10/17 пацієнтів померли від неконтрольованої кровотечі і 9/10 з них мали варикозну природу.
Повторні ендоскопічні ін’єкції ЦА до досягнення облітерації варикозно розширених вен і нещодавно розроблену комбіновану терапію під контролем EСГ з емболізацією спіралями та ін’єкцією ЦА порівнювали в одноцентровому ретроспективному аналізі економічної ефективності. Дослідники повідомили, що, незважаючи на те, що комбінована терапія під контролем ЕСГ була дорожчою, загальна вартість лікування, яка включала втручання при повторних кровотечах та госпіталізації, була значно вищою в групі ендоскопічного лікування ЦА [31].
Іншим синтетичним адгезивом для тканин, що має потенціал для лікування ШВ, є желатинова губка, що розсмоктується (РЖГ). РЖГ готується з очищеного свинячого желатину і може поглинати до 45 разів більше своєї ваги в цільній крові. Розміщення спіралі під контролем EСГ із наступною ін’єкцією РЖГ мало позитивні результати в невеликих серіях випадків [32, 33]. P.S. Ge зі співавт. описали випадок 1 пацієнта, в якого з’явилася активна кровотеча зі ШВ і була проведена EСГ-СП/РЖГ зі трансстравохідним транскруральним розміщенням 8 спіралей. Потім із РЖГ готували рідку суспензію і вводили 5 см3 для посилення ерадикації. Цей пацієнт добре переніс цю процедуру з успішним гемостазом та з облітерацією, що зберігалася під час подальшої ЕСГ [32] (рис. 5). A.N. Bazarbashi зі співавт. описали 10 пацієнтів, яким було проведено EСГ-СП/РЖГ при активній кровотечі або для вторинної профілактики, та відзначили відсутність будь-яких епізодів повторної кровотечі зі ШВ після середнього спостереження протягом 6 місяців. У 9 з 10 пацієнтів була проведена контрольна ЕСГ, яка виявила майже повну облітерацію ШВ у всіх випадках. Ця процедура, як правило, переносилася добре, про біль у животі повідомлялося у 1 з 10 пацієнтів, а транзиторна субфебрильна температура спостерігалася у 2 із 10 пацієнтів [33].
/44.jpg)
Перспективи
Наявні на сьогодні дані підкреслюють обмеження ендоскопічного введення ЦА не тільки з точки зору можливості під час активної кровотечі зі ШВ, але також із точки зору запобігання раннім і пізнім повторним кровотечам; однак ця терапія включена в чинні клінічні рекомендації та є найдоступнішою у всьому світі. Ендоваскулярні втручання під контролем EСГ дали багатообіцяючі результати за їх клінічною ефективністю та профілем безпеки; однак ці методики вимагають складного навчального процесу. Крім того, обмежена кількість установ пропонує пацієнтам цю терапевтичну альтернативу. У майбутньому розробка встановленого навчального плану для ендоваскулярної терапії під контролем EСГ та збільшення кількості експертів-ендосонографістів у всьому світі мають стати пріоритетами для клінічних товариств. Крім того, наявні надійні докази підтверджують оновлення поточних рекомендацій щодо включення ендоваскулярної терапії під контролем EСГ із комбінованою емболізацією спіралями та ін’єкцією ЦА як терапії першої лінії в тих установах, які пропонують цю процедуру. Ендоскопічну ін’єкцію ЦА слід пропонувати лише у відділеннях, у яких недоступна ендоваскулярна терапія під контролем EСГ. Пропозиція використовувати ін’єкцію тромбіну замість ін’єкції ЦА для ендоскопічного лікування ШВ є багатообіцяючою альтернативою, яка може покращити профіль безпеки.
Висновки
Лікування ШВ під контролем EСГ є новою технікою, що може значно покращити лікування цього стану [9]. EСГ дає змогу чітко візуалізувати та точно націлитися на живильні судини навіть в умовах активної кровотечі, що не завжди можливо під час звичайної ендоскопії. Крім того, це зображення варикозного розширення вен зменшує кількість терапевтичних засобів, необхідних для досягнення облітерації, що, зі свого боку, може зменшити супутні побічні ефекти. ЕСГ дозволяє проводити цілеспрямовану судинну ін’єкційну терапію на додаток до оцінки за допомогою допплерівського потоку, який забезпечує контроль щодо гемостазу в реальному часі. Роль EСГ у лікуванні ШВ має певні обмеження, які заслуговують подальшого обговорення. Як і при прямій ендоскопічній ін’єкції, лікування під контролем EСГ вимагає значного досвіду і може бути доступним не в усіх центрах. Крім того, точний метод ін’єкції варикозного розширення вен під контролем EСГ не стандартизований. Іншим важливим обмеженням є інституційна та регіональна доступність необхідних матеріалів для ендоскопічних ін’єкцій, зокрема тканинних адгезивів, таких як ЦА.
Хоча потенційні переваги лікування ШВ під контролем EСГ є багатообіцяючими, необхідні майбутні дослідження, щоб продемонструвати перевагу над звичайними медичними та радіологічними методами лікування [9]. Подальші зусилля мають продовжувати зосереджуватися на демонстрації безпеки та ефективності ін’єкції тканинних адгезивів під контролем EСГ.
Внесок авторів. Чуклін С.М. — первинний пошук літератури, переклад літературних джерел, написання статті, загальне редагування; Чуклін С.С. — первинний пошук літератури, переклад літературних джерел, написання статті; Посівнич М.М., Кристопчук С.А. — переклад літературних джерел, написання статті. Усі автори прочитали і погодили остаточний варіант тексту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 14.08.2022
Рецензовано/Revised 23.08.2022
Прийнято до друку/Accepted 02.09.2022

/41.jpg)
/42.jpg)
/43.jpg)
/44.jpg)