Газета «Новости медицины и фармации» №11 (781), 2022
Вернуться к номеру
Коли лікар повинен стати трішки нефрологом?
Авторы: Тетяна Чистик
Рубрики: Семейная медицина/Терапия
Разделы: Справочник специалиста
Версия для печати
Хронічна хвороба нирок (ХХН) являє собою прогресуюче ураження нирок, яке частіше зустрічається у літніх людей, жінок, пацієнтів з цукровим діабетом (ЦД) і/або артеріальною гіпертензією. На сьогодні ХХН визнана однією з провідних причин смерті в усьому світі. Використання при лікуванні ХХН методів нефропротекції дозволяє істотно поліпшити прогноз у хворих як з факторами ризику розвитку ниркової дисфункції, так і з уже наявним захворюванням нирок.
28 жовтня 2022 року відбулася науково-практична конференція з міжнародною участю «Досягнення та розвиток сімейної медицини в Україні та світі», у рамках якої були розглянуті актуальні питання запальних захворювань кишечника, неалкогольної жирової хвороби печінки, мозкового інсульту, цукрового діабету, хронічної хвороби нирок.
З доповіддю «Коли лікар повинен стати трішки нефрологом?» виступила доктор медичних наук, професор кафедри нефрології і нирково-замісної терапії Національного університету охорони здоров’я України імені П.Л. Шупика Кушніренко Стелла Вікторівна.
Хронічна хвороба нирок викликає більше смертей, ніж рак молочної залози або рак простати. За оцінками, від неї страждають приблизно 37 мільйонів людей у США, що становить 15 % дорослого населення (більше ніж 1 із 7 дорослих). Приблизно 90 % людей з ХХН навіть не підозрюють про наявність у них цієї патології. Частіше ХХН зустрічається у жінок (14 %), ніж у чоловіків (12 %), у віці старше за 65 років 38 % людей мають хронічну хворобу нирок.
При ХХН серцево-судинна смертність підвищується за умови зниження розрахункової швидкості клубочкової фільтрації (рШКФ). При рШКФ 45–59 мл/хв/1,73 м2 серцево-судинна смертність збільшується у 4,3 раза, при рШКФ 30–44 мл/хв/1,73 м2 — у 5,2 раза, при рШКФ 15–29 мл/хв/1,73 м2 — у 14 разів, що диктує необхідність спостереження та звернення до спеціалістів.
ХХН класифікується на основі причини, категорії ШКФ та альбумінурії. Причина ХХН визначається на підставі наявності або відсутності системного захворювання і присутності його ознак в нирках із існуючими або передбачуваними патологоанатомічними характеристиками.
Прогресування ХХН визначається на підставі значення ШКФ (категорія G), згідно з якими виділяють 5 стадій:
- G1: ШКФ ≥ 90 мл/хв/1,73 м2, нормальна або висока;
- G2: ШКФ 60–89 мл/хв/1,73 м2, незначно знижена;
- G3a: ШКФ 45–59 мл/хв/1,73 м2, незначно або помірно знижена;
- G3b: ШКФ 30–44 мл/хв/1,73 м2, помірно або виражено знижена;
- G4: ШКФ 15–29 мл/хв/1,73 м2, виражено знижена;
- G5: ШКФ < 15 мл/хв/1,73 м2, ниркова недостатність.
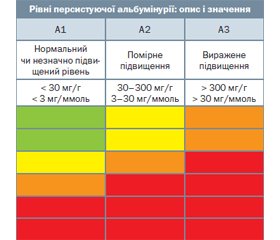
Також визначають категорію альбумінурії або співвідношення альбумін/креатинін (САК). За рекомендаціями KDIGO виділяють:
- А1 (альбумін < 30 мг/г, САК < 3 мг/ммоль) — нормальна або незначно підвищена;
- А2 (альбумін 30–300 мг/г, САК — 3–30 мг/ммоль) — помірно підвищена;
- А3 (альбумін > 300 мг/г, САК > 30 мг/ммоль) — виражено підвищена.
Ризики серцево-судинної смертності, розвитку термінальної ХХН і прогресування ХХН в будь-якому діапазоні ШКФ істотно розрізняються залежно від рівня альбумінурії або співвідношення альбумін/креатинін (рис. 1).
При G1 (А1, А2), G2 (А1 та А2) та G3а (А1) частота спостереження пацієнтів становить 1 раз на рік; при G1 (А3), G2 (А3), G3а (А2) та G3b (А1) — 2 рази на рік; при G3а (А3) та G3b (А2, А3), G4 (А1, А2) — 3 рази на рік; при G4 (А3), G5 (А1, А2, А3) — 4 і більше рази на рік.
До нефролога необхідно звернутися при G2 (А3), G3а (А3), G3b (А2, А3), а також при G4 (А1, А2, А3) і G5 (А1, А2, А3). В інших випадках може бути достатньо моніторингу рівнів рШКФ та альбумінурії.
Згідно з даними регістра ERA-EDTA, провідними причинами виникнення хронічної хвороби нирок у дорослих пацієнтів є цукровий діабет (27,7 %) та артеріальна гіпертензія (16,4 %). Інші місця займають захворювання нирок — гломерулонефрит (15,9 %), пієлонефрит (7,3 %), полікістозна хвороба нирок (6,8 %) та ниркові судинні захворювання (2,1 %). У дітей < 15 років, які почали нирково-замісну терапію, причинами ХХН є САКUT-синдром (40,1 %), гломерулонефрит (18,1 %), кістозні хвороби нирок (12,9 %), метаболічні й тубулоінтерстиціальні порушення (3,2 %), гемолітико-уремічний синдром (5,5 %), токсична/ішемічна ниркова недостатність (3,0 %).
Таким чином, у пацієнтів з групи ризику на артеріальну гіпертензію та цукровий діабет припадає більше половини всіх випадків ХХН, що потребує моніторингу цієї патології. Крім того, моніторинг на ХХН слід проводити при ожирінні, сімейному анамнезі ХХН, серцево-судинних захворюваннях (ССЗ), серцевій недостатності (СН), гострому ураженні нирок та у віці старше 60 років.
Ці відображено у настановах KDIGO, які рекомендують регулярне тестування груп високого ризику, у тому числі хворих на цукровий діабет, гіпертонію та ССЗ, що може сприяти ранньому виявленню пошкодження нирок. У рекомендаціях NICE тестування на ХХН, використовуючи рШКФ та САК, слід проводити у пацієнтів з гіпертонією, діабетом, гострим ураженням нирок, ССЗ (ІХС, хронічна СН, периферичні або церебральні судинні захворювання), структурною хворобою ниркових шляхів, рецидивуючими нирковими конкрементами, гіпертрофією передміхурової залози, мультисистемними захворюваннями з можливим ураженням нирок (наприклад, системний червоний вовчак), сімейним анамнезом ХХН або спадкової хвороби нирок. Американська діабетологічна асоціація рекомендує один раз на рік оцінювати альбумін у сечі та рШКФ у пацієнтів з ЦД 1-го типу тривалістю більше ніж 5 років, ЦД 2-го типу та супутньою гіпертензією.
У міру зниження рШКФ відмічається зріст ускладнень ХХН: анемії, гіпертензії, дефіциту 25(ОН)D3, ацидозу, гіперфосфатемії, гіпоальбумінемії та гіперпаратиреозу. При рШКФ ≥ 90 мл/хв/1,73 м2 гіпертензія фіксується у 18,3 % хворих, анемія — у 4,0 %, гіперпаратиреоз — у 5,5 %, при рШКФ < 30 мл/хв/1,73 м2 ці показники становлять 82,1; 51,5 та 72,5 % відповідно.
Клінічно ХХН характеризується гіперактивністю симпатичної нервової системи; артеріальної гіпертензією; предіабетом, діабетом; надлишковою масою тіла, ожирінням, безсонням, хропінням; безсимптомною і симптомною гіперурикемією (подагра, сечокам’яна хвороба); симптомами нижніх сечових шляхів (гіперактивний сечовий міхур); еректильною дисфункцією (за наявності СНСШ поширеність коливається від 58 до 80 %).
Усе це обумовлює необхідність ренопротекції, призначення антигіпертензивної терапії, стабільної цукрознижувальної та уратзнижувальної терапії.
У рекомендаціях ESC/EASD підсумовувалися клінічно значущі дослідження серцево-ниркової взаємодії, опубліковані в 2021 і 2022 роках. У цих дослідженнях доведено, що фінеренон ефективний і безпечний для пацієнтів із хронічною діабетичною хворобою нирок середнього та тяжкого ступеня. Дапагліфлозин і емпагліфлозин знижують смертність і захворюваність у пацієнтів із СН та ХХН. Хлорталідон також ефективний і безпечний при лікуванні артеріальної гіпертензії у пацієнтів із тяжкою ХХН. Інфекційний ендокардит у пацієнтів, які отримують хронічний гемодіаліз, пов’язаний з високою смертністю, особливо за наявності певних факторів ризику (таких як емболія центральної нервової системи, стійка бактеріємія, інша емболія та ХСН). Етелькальцетамід знижує рівень FGF23, медіатора ремоделювання серця, і таким чином може зменшити прогресування гіпертрофії лівого шлуночка у пацієнтів із термінальною стадією ниркової недостатності.
У клінічних настановах KDIGO пацієнтам із ХХН рекомендується внести зміни до способу життя: підтримувати рівень споживання білка до 0,8 г/кг маси тіла/добу для дорослих з ЦД та без, ХХН, які не знаходяться на діалізі. Пацієнти, які отримують гемодіаліз, зокрема перитонеальний діаліз, мають підтримувати рівень споживання білка 1,0–1,2 г/кг/добу.
Цільовий рівень вживання натрію має бути < 2 г (< 90 ммоль натрію або < 5 г натрію хлориду) на добу для пацієнтів із високим артеріальним тиском (АТ) та ХХН, якщо немає протипоказань. Пацієнтам треба рекомендувати фізичну активність помірної інтенсивності протягом 150 хвилин на тиждень, або її рівень має корелювати з переносимістю з боку серцево-судинної системи. Лікарі мають заохочувати пацієнтів із ожирінням, цукровим діабетом та ХХН зменшити масу тіла, зокрема це стосується пацієнтів із рШКФ ≥ 30 мл/хв/1,73 м2.
У рекомендаціях KDIGO-2022 для лікування цукрового діабету при хронічній хворобі нирок як медикаментозна терапія першої лінії рекомендується метформін, при рШКФ ≥ 30 мл/хв/1,73 м2 — інгібітори НЗКТГ-2, прийом яких продовжують до діалізу або трансплантації нирки, інгібітори РААС та статини. Як цільову терапію при ЦД 2-го типу, глікемії — арГПП-1, при ЦД 2-го типу, залишковій альбумінурії — нестероїдні антагоністи мінералокортикоїдних рецепторів (АМР). При підвищеному артеріальному тиску — блокатори кальцієвих каналів (БКК), дигідропіридин або діуретик, при резистентній гіпертензії — стероїдні АМР.
Рекомендації KDIGO-2021 для пацієнтів з високим АТ і ХХН пропонують досягнення цільового рівня систолічного АТ < 120 мм рт.ст., якщо добре переноситься, за даними стандартизованого вимірювання офісного АТ (2В). При ХХН та ЦД 2-го типу за наявності альбумінурії < 30 мг/день систолічний АТ (САТ) ≤ 140 мм рт.ст., при альбумінурії ≥ 30 мг/день — САТ ≤ 130 мм рт.ст.
Згідно з даними Європейської асоціації урологів рекомендується взяти до уваги, що прийом пацієнтом декількох лікарських препаратів може викликати сумарне антихолінергічне навантаження. Тому необхідно враховувати їх кумулятивний вплив на когнітивну функцію, особливо у літніх пацієнтів. Антихолінергічне навантаження мають препарати, які приймаються при захворюваннях нервової системи (флоуоксетин, амітриптилін, рисперидон, діазепам, карбамазепин), хворобах ШКТ (атропін, фамотидин, домперидон, метоклопрамід, лоперамід), антигістамінні препарати (цетиризин, лоратадин), при серцево-судинних захворюваннях (фуросемід, атенолол, метопролол, дигоксин, дилтіазем, ніфедипін, каптоприл) та інші (теофілін, трамадол, циклоспорин, варфарин, дексаметазон, метотрексат, ампіцилін, гентаміцин).
Рекомендації KDIGO-2021 пропонують у дорослих пацієнтів із високим артеріальним тиском та хронічною хворобою нирок знижувати САТ до цільового рівня < 120 мм рт.ст. В осіб із високим АТ, ХХН та вираженою альбумінурією (G1-G4, A3) без цукрового діабету розпочинати терапію з інгібіторів ренін-ангіотензин-альдостеронової системи (РААС), ангіотензинперетворювального ферменту (іАПФ) або блокаторів рецепторів ангіотензину (БРА) (1В). Також ця стартова терапія призначається особам із високим АТ, ХХН та помірною альбумінурією (G1-G4, A2) без діабету (2С). Особам із високим артеріальним тиском, хронічною хворобою нирок, помірною/вираженою альбумінурією (G1-G4, А2 або А3) із діабетом рекомендовано призначати як стартову терапію іАПФ або БРА (1В).
Ірбесартан належить до класу БРА ІІ, призначається у дозі 150–300 мг та має привабливі фармакодинамічні особливості: найвищу біодоступність — 60–80 %, відсутність зв’язку з їжею, тривалий період напіввиведення — 11–15 годин, відсутність активного метаболіту, виведення нирки/печінка — 20 : 80 %. Ступінь спорідненості до рецепторів ангіотензину ІІ 1-го типу в порядку зменшення має такий вигляд: ірбесартан > олмесартан > кандесартан > епросартан > валсартан > лозартан.
На фармацевтичному ринку України ірбесартан представлений препаратом Ірбетан (Київський вітамінний завод, Україна). Ірбетан забезпечує гарантоване збереження ефекту протягом 24 годин при одноразовому прийомі. Низка публікацій демонструють зручність його прийому та ефективність, що є залогом прихильності до антигіпертензивної терапії.
Дослідження IDNT включало хворих на ЦД (n = 1715) з добовою екскрецією альбуміну > 900 мг/дл та АГ (середні цифри АТ — 156/85 мм рт.ст.). У більшості учасників спостерігалося зниження ниркової функції (середня креатинемія — 1,7 мг/дл), а протеїнурія досягала нефротичного рівня (4,2 г/добу); відзначалася надмірна маса тіла. При цьому 16,5 % пацієнтів на момент включення в дослідження вже перенесли гострий інфаркт міокарда. Хворі отримували ірбесартан 300 мг/добу, або амлодипін 10 мг/добу, або плацебо. Тривалість спостереження становила 2,6 року.
У результаті проведеного лікування у хворих, які отримували ірбесартан, було відмічено зниження ризику термінальної ниркової недостатності на 23 % порівняно з тими, хто лікувався амлодипіном або плацебо (р = 0,07). При порівнянні з групою плацебо виявилося, що ризик подвоєння рівня креатиніну сироватки крові з призначенням ірбесартану зменшується на 33 % (р = 0,003).
Це дослідження має велике значення. По-перше, воно ще раз продемонструвало корисність досягнення цільових рівнів АТ. Цей факт сам по собі сприяє поліпшенню ниркового прогнозу. По-друге, було встановлено, що ірбесартан вірогідно гальмує темпи зниження ШКФ, причому незалежно від її початкового рівня, показників АТ і протеїнурії. Таким чином, дослідження IDNT показало нефропротекторні можливості ірбесартану в пацієнтів із поєднанням ЦД та АГ.
У дослідженні IRMA II взяли участь 590 хворих на ЦД з АГ і мікроальбумінурією. Усі пацієнти були рандомізовані на 3 групи лікування: ірбесартан 150 мг/добу, або ірбесартан 300 мг/добу, або плацебо. За результатами цього дослідження, ірбесартан забезпечував адекватний контроль АТ і сприяв зменшенню мікроальбумінурії. Найкращий результат щодо зниження ризику прогресування нефропатії було отримано в пацієнтів, які приймали ірбесартан у дозі 300 мг/добу. Повний регрес мікроальбумінурії був констатований у 34 % пацієнтів, які отримували ірбесартан 300 мг/добу, у 24 % хворих, які приймали цей препарат у дозі 150 мг/добу; у групі плацебо подібного результату досягли 21 % учасників. Відносний ризик розвитку протеїнурії знизився на 39 % у групі ірбесартану 150 мг/добу та на 70 % у групі ірбесартану 300 мг/добу.
У дослідженні ICE (Irbesartan Complance Evolution), яке проводилось у різних країнах Європи (Німеччина, Франція, Великобританія), була проаналізована прихильність пацієнтів до терапії протягом 12 місяців. Його результати продемонстрували перевагу ірбесартану — 60,8 %, що значно перевершувало інші види лікування — діуретики (34,4 %), іАПФ (42 %), антагоністи кальцію (43,6 %), лозартан (44,7 %), β-блокатори (49,7 %) та інші сартани (51,3 %).
Однак при використанні монотерапії не завжди можливо досягнення цільового АТ. Тому більше зниження артеріального тиску досягається призначенням раціональних комбінацій. Першим кроком є призначення подвійної комбінації — іАПФ або БРА + БКК або іАПФ чи БРА + діуретик (або петльовий діуретик). Другим кроком є використання потрійної комбінації — іАПФ або БРА + БКК + діуретик (або петльовий діуретик). Третій крок — потрійна комбінація + спіронолактон або інший діуретик, α-блокатор, β-блокатор при резистентній АГ.
β-блокатори призначають на будь-якому етапі лікування при серцевій недостатності, стенокардії, інфаркті міокарда, фібриляції передсердь, молодим жінкам, які планують вагітність.
Відзначається зниження ШКФ і зростання сироваткового креатиніну з очікуваною відповіддю на антигіпертензивну терапію у пацієнтів з ХХН, особливо при застосуванні іАПФ або БРА, проте зростання креатиніну > 30 % передбачає відповідне обстеження для виключення можливої реноваскулярної АГ.
Пацієнтам з ХХН для нефропротекції призначають антагоністи кальцію, серед яких найбільш ефективним є лерканідипін. Лерканідипін — це ідеальний партнер у досягненні цільового артеріального тиску, який може призначатися у комбінації з іАПФ/сартанами, діуретиками та β-блокаторами.
У дослідженні DIAL 277 пацієнтам з АГ і ЦД призначали лерканідипін 10–20 мг/добу або раміприл 5–10 мг/добу. Через 12 місяців спостереження було доведено, що нефропротективні властивості лерканідипіну не поступаються раміприлу. У дослідженні N.R. Robles et al. (2013) порівнювали лерканідипін та амлодипін. Через рік призначення було виявлено, що використання лерканідипіну знижує протеїнурію вдвічі на відміну від амлодипіну.
Фармакокінетика лерканідипіну контролюється клітинною мембраною. Серед усіх антагоністів кальцію лерканідипін має найвищу вазоселективність. Він справляє мінімальний вплив на інотропну функцію серця і практично не впливає на функцію синусово-передсердного вузла та АV-провідність.
Лерканідипін має найбільш значну спорідненість до рецепторів Са2+-каналів L-типу: фіксується на рецепторах Са2+-каналів L-типу, повільно вивільняється зі зв’язку з рецепторами та прогресивно і тривало інгібує вхід Са2+ в клітину.
Також лерканідипін має виключну ліпофільність, високий ступінь зв’язування з мембраною, завдяки чому накопичується в біліпідному шарі мембрани з формуванням депо. Зі сформованих депо відбувається його поступова дифузія до структур кальцієвих каналів.
Лерканідипін має кардіопротекторні властивості, зменшуючи ремоделювання серця і судин, жорсткість судин, знижує пульсовий периферичний, систолічний АТ, аугментаційний індекс. Він має нефропротекторні і нейропротекторні властивості, забезпечує первинну профілактику інсульту, покращує мозковий кровообіг, при цьому не погіршує вуглеводний та ліпідний обмін.
Лерканідипін демонструє оптимальну переносимість, значно меншу частоту розвитку і вираженість набряків, високу прихильність до терапії.
На вітчизняному ринку лерканідипін представлений препаратом Ванлерк® (Київський вітамінний завод, Україна). Що цікавого в цьому продукті? Головне те, що він біоеквівалентний референтному лерканідипіну (рис. 2), має доказану ефективність, безпеку та хорошу переносимість.
Британські клінічні рекомендації щодо менеджменту пацієнтів з АГ та цукровим діабетом пропонують використовувати іАПФ або БРА (але не в комбінації), β-блокатори та блокатори кальцієвих каналів для зменшення серцево-судинних ускладнень у людей із цукровим діабетом та гіпертонією, які перебувають на діалізі (2В), а також використовувати діуретики людям з цукровим діабетом, які перебувають на діалізі та мають залишкову функцію нирок (2С).
Об’єднаний керівний комітет Всесвітнього дня нирки оголосив 2022 рік роком «Здоров’я нирок для всіх». Комітет закликає всіх медиків працювати над усуненням прогалин у знаннях для поліпшення догляду за нирками. Кампанія 2022 року зосереджена на зусиллях з підвищення рівня освіти і обізнаності про здоров’я нирок, а також на зменшенні постійно великої прогалини у знаннях про ХХН на всіх рівнях лікування нирок.

/6_m.jpg)
/7_m.jpg)