Журнал «Травма» Том 23, №6, 2022
Вернуться к номеру
Експериментально-рентгенометричне дослідження динаміки біорозкладання 3D-друкованих імплантатів на основі полілактиду з трикальційфосфатом після остеопластики і застосування культивованих мезенхімальних стромальних клітин
Авторы: Хвисюк О.М. (1), Гонтар Н.М. (1), Пастух В.В. (1), Карпінський М.Ю. (2), Карпінська О.Д. (2), Нікольченко О.А. (2)
(1) — Харківська медична академія післядипломної освіти, м. Харків, Україна
(2) — ДУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка НАМН України», м. Харків, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
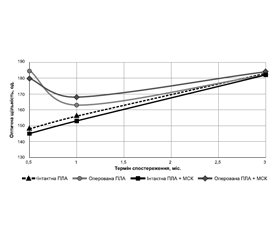
Актуальність. Завдяки 3D-друку стало можливим виготовлення імплантатів за заданими геометричними параметрами і хімічним складом, а також матриць і каркасів для створення комбінованих імплантатів, які відповідають вимогам щодо основних характеристик остеопластичних матеріалів, а саме: мають високу здатність до остеокондукції, остеоіндукції, остеоінтеграції, біосумісність і механічну міцність, придатні для забезпечення міграції, адгезії, проліферації і диференціювання клітин. Мета: в експерименті на тваринах рентгенометрично вивчити динаміку заміщення кістковою тканиною пористих 3D-друкованих імплантатів на основі полілактиду з трикальційфосфатом після застосування мезенхімальних стромальних клітин (МСК) жирової тканини. Матеріали та методи. На 18 лабораторних щурах проведено рентгенометричне дослідження щільності кісткового регенерату в різні терміни після імплантації в порожнинний дефект стегнової кістки біорозкладаного матеріалу на основі полілактиду з додаванням трикальційфосфату і застосування культивованих мезенхімальних стромальних клітин. Щурів виводили з експерименту групами по 6 тварин через 15, 30 і 90 діб після операції. Вимірювали показники оптичної щільності в зоні кісткового дефекту оперованої кістки та в аналогічній зоні контралатеральної кістки. Результати. На 15-ту добу після операції оптична щільність імплантата була вище, ніж аналогічної зони інтактної кістки. Через 1 місяць щільність імплантата знизилася, але залишилася трохи більшою, ніж щільність кістки, тобто біорозкладання імплантованого матеріалу відбулося не повністю. Через 3 місяці після операції спостерігали вирівнювання оптичної щільності зони імплантації та інтактної кістки. Можна припустити, що відбулося повне біорозкладання імплантата, а дефект був заповнений кістковою тканиною. Зниження оптичної щільності в зоні дефекту через 1 міс. після операції викликане саме процесами біорозкладання штучного матеріалу і кісткоутворення, які не збігаються за швидкістю перебігу. На жодному етапі експерименту різниці між імплантатами при застосуванні культури МСК і без неї на статистично значущому рівні не визначено. Висновки. Протягом експерименту щільність інтактної кісткової тканини щурів статистично значуще зростала. У зоні дефекту стегнової кістки в період із 15-ї до 30-ї доби спостерігали зниження оптичної щільності від 180 ± 28 опт.од. до 168 ± 25 опт.од., що може свідчити про початок процесу біорозкладання 3D-друкованого імплантаційного матеріалу, яким заповнений дефект. У термін від 30-ї до 90-ї доби в зоні дефекту спостерігали зростання оптичної щільності до 184 ± 2 опт.од., що наблизилося до рівня інтактної кістки — 182 ± 1 опт.од., про що свідчить відсутність статистичної значущості між цими показниками. Це може буди наслідком процесу кісткоутворення й заміщення імплантованого матеріалу кістковою тканиною. На жодному етапі експерименту не виявлено різниці між імплантатами з використанням культури МСК і без неї.
Background. Thanks to 3D printing, it became possible to manufacture implants of given geometric parameters and chemical composition, as well as matrices and frameworks for the creation of combined implants that are able to meet the requirements for the main characteristics of osteoplastic materials, namely a high ability for osteoconduction, osteoinduction, osseointegration, biocompatibility and mechanical strength, suitable for ensuring migration, adhesion, proliferation and differentiation of cells. Goal: in an experiment on animals, to study radiometrically the dynamics of replacement by bone tissue of porous 3D printed implants based on polylactide with tricalcium phosphate after the use of mesenchymal stromal cells (MSCs) of adipose tissue. Materials and methods. A radiometric study of the density of bone regeneration was carried out on 18 laboratory rats at different times after implantation into a cavity defect of the femur of a biodegradable material based on polylactide with the addition of tricalcium phosphate and the use of cultured MSCs. Rats were sacrificed in groups of 6 animals 15, 30 and 90 days after the operation. Optical density indicators were measured in the area of the bone defect of the operated bone and in the similar area of the contralateral bone. Results. On day 15 after the operation, the optical density of the implant is higher than that of a similar zone of intact bone. One month after, the density of the implant decreased, but remained slightly higher than the density of the bone, that is, the biodegradation of the implant material was not complete. Three months after the operation, the alignment of the optical density of the implantation zone and the intact bone was observed. It can be assumed that complete biodegradation of the implant occurred and the defect was filled with bone tissue. Reduction of optical density in the defect zone 1 month after surgery was caused by the processes of biodegradation of the artificial material and bone formation, which do not coincide in terms of speed. There was no statistically significant difference between the implants in case of using MSC culture and without it at any stage of the experiment. Conclusions. During the experiment, the density of intact bone tissue of rats increased statistically significantly. In the area of the femur defect, there was a decrease in optical density from 180 ± 28 HU to 168 ± 25 HU from day 15 to 30, which may indicate the beginning of the process of biodegradation of the 3D printed implant material that filled the defect. In the period from 30 to 90 days, an increase in optical density in the defect zone was observed up to 184 ± 2 HU, which approached the level of intact bone — 182 ± 1 HU, as evidenced by the lack of statistical significance between these indicators. This may be a consequence of the process of bone formation, and replacement of the implanted material with bone tissue. No difference was found between the implants with and without MSC culture at any stage of the experiment.
кістковий дефект; рентгенометрія; щільність; полілактид; мезенхімальні стромальні клітини
bone defect; radiography; density; polylactide; mesenchymal stromal cells