Международный эндокринологический журнал Том 19, №2, 2023
Вернуться к номеру
Особливості іонорегулювальної функції нирок щурів у динаміці розвитку експериментального цукрового діабету
Авторы: О.А. Olenovych
Bukovinian State Medical University, Chernivtsi, Ukraine
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
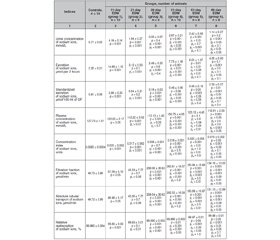
Метою дослідження було вивчити особливості іонорегулювальної функції нирок щурів у динаміці розвитку алоксан-індукованого експериментального цукрового діабету. Матеріали та методи. Дослідження проведені на 63 статевозрілих нелінійних самцях білих щурів, у 53 з яких викликали експериментальний цукровий діабет різної тривалості шляхом одноразового внутрішньоочеревинного введення розчину алоксану в дозі 160 мг/кг маси тіла, 10 інтактних щурів увійшли до контрольної групи. Через 10, 20, 25, 30, 40 та 45 діб після введення діабетогенної речовини тварин виводили з експерименту. Вивчення екскреторної функції нирок здійснювали кліренс-методом за умов водного індукованого 2-годинного діурезу з визначенням кліренсу ендогенного креатиніну, швидкості клубочкової фільтрації, концентрації іонів натрію та калію в пробах сечі та плазми крові й наступним розрахунком показників екскреції електролітів, інтенсивності їх фільтрації, абсолютної та відносної реабсорбції, концентраційного індексу, проксимального та дистального ниркового транспорту (у тому числі в перерахунку на 100 мкл клубочкового фільтрату). Результати. Іонорегулювальна функція нирок у щурів з алоксан-індукованим експериментальним діабетом характеризується інтенсифікацією натрій- та калійурезу на всіх стадіях експерименту. Збільшення втрат іонів натрію з кінцевою сечею на ранніх стадіях алоксан-індукованого експериментального діабету в першу чергу обумовлено клубочковою гіперфільтрацією з наступним зростанням фільтраційного навантаження нефрона натрієм. Втрата пропорційності між профільтрованою кількістю натрію та його проксимальною реабсорбцією викликає зменшення загального реабсорбційного потенціалу канальцевого відділу нефрона в динаміці розвитку алоксан-індукованого експериментального діабету. Це в першу чергу відображається на проксимальних канальцях, а в подальшому викликає функціональне послаблення сили канальцево-канальцевого зв’язку й відносну дисфункцію дистального відділу нефрона з наступним пригніченням альдостерон-залежних регуляторних механізмів. Висновки. Калійурична реакція діабетичної нирки може бути однією з ознак декомпенсації авторегуляції ниркового кровотоку за принципом канальцево-клубочкового зворотнього зв’язку, що є ініціюючим фактором дисфункції канальцевого апарату діабетичної нирки.
Background. The purpose of the research was to study the peculiarities of ionoregulatory renal function in the dynamics of alloxan-induced experimental diabetes mellitus. Materials and methods. The experiments were carried out on 63 white non-linear mature male rats, 53 with experimental diabetes mellitus of varying duration induced by intraperitoneal administration of alloxan in a dose of 160 mg/kg of body weight, and 10 intact rats (control group). Ten, 20, 25, 30, 40 and 45 days after administration of the diabetogenic substance, the animals were withdrawn from the experiment. Ionoregulatory function of the kidneys was studied by means of the clearance method under condition of water induced 2-hour diuresis to determine the clearance of endogenous creatinine, glomerular filtration rate, sodium and potassium content in the urine and blood plasma. It was followed by calculation of the electrolyte excretion, intensity of their filtration, absolute and relative reabsorption, their proximal and distal tubular transport (including standardized by glomerular filtrate volume). Results. The ionoregulatory function of the kidneys in rats with alloxan-induced experimental diabetes is characterized by the intensification of natriuresis and kaliuresis at all stages of the experiment. An increase in the urinary sodium loss in the early stages of alloxan-induced experimental diabetes is primarily stipulated by glomerular hyperfiltration, followed by an enhancement of filtration sodium load to the nephron. The loss of proportionality between the filtered amount of sodium and its proximal reabsorption causes a decrease in the total reabsorption potential of the tubular segment of the nephron in the dynamics of alloxan-induced experimental diabetes. It is reflected primarily on the proximal tubules, and subsequently induces a functional weakening of the tubule-tubular connection and relative dysfunction of the distal segment of the nephron with subsequent inhibition of aldosterone-dependent regulatory mechanisms. Conclusions. The kaliuric reaction of the diabetic kidney may serve as one of the signs of decompensation of the renal blood flow autoregulation by tubuloglomerular feedback, which is an initiating factor for the dysfunction of the tubular apparatus of diabetic kidney.
експериментальний цукровий діабет; алоксан; іонорегулювальна функція нирок
experimental diabetes mellitus; alloxan; ionoregulatory renal function
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Selby N.M., Taal M.W. An updated overview of diabetic nephropathy: diagnosis, prognosis, treatment goals and latest guidelines. Diabetes Obes. Metab. 2020 Apr. 22(Suppl. 1). 3-15. doi: 10.1111/dom.14007.
- Vikram Rao A/L B Vasanth Rao, Tan S.H., Candasamy M., Bhattamisra S.K. Diabetic nephropathy: an update on pathogenesis and drug development. Diabetes Metab. Syndr. 2019 Jan-Feb. 13(1). 754-762. doi: 10.1016/j.dsx.2018.11.054.
- Natesan V., Kim S.J. Diabetic Nephropathy — a Review of Risk Factors, Progression, Mechanism, and Dietary Management. Biomol. Ther. (Seoul). 2021 Jul 1. 29(4). 365-372. doi: 10.4062/biomolther.2020.204.
- Pradhan S., Duffull S.B., Walker R.J., Wright D.F.B. The intact nephron hypothesis as a model for renal drug handling. Eur. J. Clin. Pharmacol. 2019 Feb. 75(2). 147-156. doi: 10.1007/s00228-018-2572-8.
- Luyckx V.A., Rule A.D., Tuttle K.R., Delanaye P., Liapis H., Gandjour A., Romagnani P., Anders H.J. Nephron overload as a the–rapeutic target to maximize kidney lifespan. Nat. Rev. Nephrol. 2022 Mar. 18(3). 171-183. doi: 10.1038/s41581-021-00510-7.
- Dwivedi A.K., Shukla R. Evidence-based statistical analysis and methods in biomedical research (SAMBR) checklists according to design features. Cancer Rep. (Hoboken). 2020 Aug. 3(4). e1211. doi: 10.1002/cnr2.1211.
- Olenovych O.A. Pathophysiology of proteinuria in the dynamics of alloxan-induced experimental diabetes. Bulletin of Medical and Biological Research. 2020. 4(6). 53-8. doi: 10.11603/bmbr.2706-6290.2020.4.11806.
- Boychuk T.M., Olenovych O.A., Gozhenko A.I. Peculiarities of excretory renal function in the early period of alloxan-induced experimental diabetes. Herald of Marine Medicine. 2018. 3(80). 102-9. doi: 10.5281/zenodo.1450849.
- Cachat F., Combescure C., Cauderay M., Girardin E., Chehade H. A systematic review of glomerular hyperfiltration assessment and definition in the medical literature. Clin. J. Am. Soc. Nephrol. 2015 Mar 6. 10(3). 382-9. doi: 10.2215/CJN.03080314.
- Premaratne E., Verma S., Ekinci E.I., Theverkalam G., Jerums G., MacIsaac R.J. The impact of hyperfiltration on the diabetic kidney. Diabetes Metab. 2015 Feb. 41(1). 5-17. doi: 10.1016/j.diabet.2014.10.003.