Журнал «Практическая онкология» Том 6, №1, 2023
Вернуться к номеру
Вплив куркуміну та кверцетину на патогенез раку молочної залози шляхом зниження регуляції miR-632 та miR-137
Авторы: Elgin Türköz Uluer, Muhammet Yusuf Pekmezci, Hilal Kabadayi Ensarioğlu, Mahmut Kemal Özbilgin
Manisa Celal Bayar University, Manisa, Turkey
Рубрики: Онкология
Разделы: Клинические исследования
Версия для печати
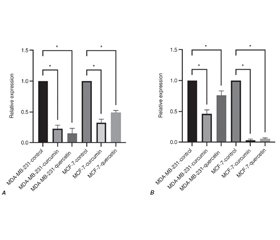
Актуальність. Куркумін і кверцетин виявилися дуже ефективними проти раку молочної залози. Однак повністю їх протипухлинні механізми невідомі. У цьому дослідженні вивчено вплив куркуміну та кверцетину на ріст лінії клітин раку молочної залози людини MCF-7 та MDA-MB-231 шляхом регуляції miR-632 та miR-137. Матеріали та методи. Клітини MCF-7 і MDA-MB-231 обробляли куркуміном і кверцетином у різних розведеннях протягом 24 і 48 годин. Життєздатність клітин оцінювали за допомогою MTT-аналізу. Кількісна полімеразна ланцюгова реакція в реальному часі була використана для виявлення експресії miR-632 і miR-137 у клітинах MCF-7 і MDA-MB-231, оброблених куркуміном і кверцетином. Результати. Наші результати показали, що 50-мкМ розведення куркуміну та кверцетину протягом 24 годин було більш ефективним щодо пригнічення росту клітин MCF-7 та MDA-MB-231. У групах, які отримували куркумін і кверцетин, експресія miR-137 і miR-632 була знижена порівняно з контрольними групами. Експресія miR-137 у клітинній лінії MCF-7 була нижчою, ніж у клітинній лінії MDA-MB-231. Висновки. Використання куркуміну і кверцетину зменшувало ріст лінії клітин раку молочної залози людини MCF-7 і MDA-MB-231 шляхом зниження регуляції miR-137 і miR-632. Цей висновок показав, що куркумін і кверцетин можуть бути використані як терапевтичний засіб, а також що miR-137 і miR-632 застосовуються для діагностики, оцінки ефективності лікування та прогнозу при раку молочної залози.
Background. Curcumin and quercetin have been found to be very effective against breast cancer. However, their anticancer mechanisms of are not known completely. This study investigated the curcumin and quercetin effects on growth of MCF-7 and MDA-MB-231 human cancer breast cell line through regulation of miR-632 and miR-137. Materials and methods. MCF-7 and MDA-MB-231 cells were treated with curcumin and quercetin at various dilutions for 24 and 48 hours. Cell viability was assessed using MTT assay. Quantitative real-time polymerase chain reaction was used to detect the expression of miR-632 and miR-137 in curcumin- and quercetin-treated MCF-7 and MDA-MB-231 cells. Results. Our results showed that 50 μM dilution of curcumin and quercetin for 24 hours was more effective in inhibiting MCF-7 and MDA-MB-231 cells growth. In curcumin- and quercetin-treated groups, miR-632 and miR-137 expression was downregulated compared to control groups. The expression of miR-137 in MCF-7 cell line was lower than in MDA-MB-231 cell line. Conclusions. Curcumin and quercetin treatment decreased the growth of MCF-7 and MDA-MB-231 human cancer breast cell line by downregulating miR-137 and miR-632. This finding indicated that curcumin and quercetin may be used as a therapeutic agent, and also that miR-137 and miR-632 are used for the diagnosis, evaluation of treatment efficacy and prognosis in breast cancer.
куркумін; кверцетин; MCF-7; MDA-MB-231; miR-137; miR-632
curcumin; quercetin; MCF-7; MDA-MB-231; miR-137; miR-632
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- 1. Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: Cancer J. Clin. 2021. 71. 209-249.
- 2. Farghadani R., Naidu R. Curcumin as an Enhancer of Thera–peutic Efficiency of Chemotherapy Drugs in Breast Cancer. Int. J. Mol. Sci. 2022 Feb 15. 23(4). 2144. doi: 10.3390/ijms23042144.
- 3. Askar M.A., El Shawi O.E., Abou Zaid O.A.R., Mansour N.A., Hanafy A.M. Breast cancer suppression by curcumin-naringenin-magnetic-nano-particles: in vitro and in vivo studies. Tumour Biol. 2021. 43(1). 225-247. doi: 10.3233/TUB-211506.
- 4. Tutar L., Özgür A., Tutar Y. Involvement of miRNAs and Pseudogenes in Cancer. Methods Mol. Biol. 2018. 1699. 45-66. doi: 10.1007/978-1-4939-7435-1_3.
- 5. Asgharian P., Tazekand A.P., Hosseini K., Forouhandeh H., Ghasemnejad T. et al. Potential mechanisms of quercetin in cancer prevention: focus on cellular and molecular targets. Cancer Cell. Int. 2022 Aug 15. 22(1). 257. doi: 10.1186/s12935-022-02677-w.
- 6. Hossain R., Sarkar C., Hassan S.M.H., Khan R.A., Arman M. et al. In silico screening of natural products as potential inhibitors of SARS-CoV-2 using molecular docking simulation. Chin. J. Integr. Med. 2021. 28. 1-8.
- 7. Islam M.S., Quispe C., Hossain R., Islam M.T., Al-Harrasi A. et al. Neuropharmacological effects of quercetin: a literature-based review. Front. Pharmacol. 2021. 12. 665031.
- 8. Shutenko Z., Henry Y., Pinard E., Seylaz J., Potier P. et al. Influence of the antioxidant quercetin in vivo on the level of nitric oxide determined by electron paramagnetic resonance in rat brain during global ischemia and reperfusion. Biochem. Pharmacol. 1999. 57(2). 199-208.
- 9. Chang W.-S., Lee Y., Lu F., Chiang H.-C. Inhibitory effects of flavonoids on xanthine oxidase. Anticancer Res. 1993. 13(6A). 2165-70.
- 10. Iio M., Ono Y., Kai S., Fukumoto M. Effects of flavonoids on xanthine oxidation as well as on cytochrome c reduction by milk xanthine oxidase. J. Nutr. Sci. Vitaminol. 1986. 32(6). 635-42.
- 11. Mandel S., Weinreb O., Amit T., Youdim M.B. Cell signaling pathways in the neuroprotective actions of the green tea polyphenol (–)-epigallocatechin-3-gallate: implications for neurodegenerative diseases. J. Neurochem. 2004. 88(6). 1555-69.
- 12. Rahman A., Hadi S.M., Parish J.H. Complexes involving quercetin, DNA and Cu(II). Carcinogenesis. 1990. 11(11). 2001-3.
- 13. Arai Y., Watanabe S., Kimira M., Shimoi K., Mochizuki R., Kinae N. Dietary intakes of flavonols, flavones and isoflavones by Japanese women and the inverse correlation between quercetin intake and plasma LDL cholesterol concentration. J. Nutr. 2000. 130(9). 2243-50.
- 14. Costantino L., Rastelli G., Gamberini M.C., Vinson J.A., Bose P. et al. 1-benzopyran-4-one antioxidants as aldose reductase inhibitors. J. Med. Chem. 1999. 42(11). 1881-93.
- 15. Soobrattee M.A., Bahorun T., Aruoma O.I. Chemopreventive actions of polyphenolic compounds in cancer. BioFactors. 2006. 27(1–4). 19-35.
- 16. Fotsis T., Pepper M.S., Aktas E., Breit S., Rasku S. et al. Flavonoids, dietary-derived inhibitors of cell proliferation and in vitro angiogenesis. Can. Res. 1997. 57(14). 2916-21.
- 17. Khan F., Niaz K., Maqbool F., Ismail Hassan F., Abdollahi M. et al. Molecular targets underlying the anticancer effects of quercetin: an update. Nutrients. 2016. 8(9). 529.
- 18. Alvi N.K., Rizvi R.Y., Hadi S.M. Interaction of quercetin with DNA. Biosci. Rep. 1986. 6(10). 861-8.
- 19. Rahman A., Hadi S.M., Parish J.H., Ainley K. Strand scission in DNA induced by quercetin and Cu(II): role of Cu(I) and oxygen free radicals. Carcinogenesis. 1989. 10(10). 1833-9.
- 20. Fazal F., Rahman A., Greensill J., Ainley K., Hadi S.M., Parish J.H. Strand scission in DNA by quercetin and Cu(II): identification of free radical intermediates and biological consequences of scission. Carcinogenesis. 1990. 11(11). 2005-8.
- 21. Guneydas G., Topcul M.R. Antiproliferative Effects of Curcumin Different Types of Breast Cancer. Asian Pac. J. Cancer Prev. 2022 Mar 1. 23(3). 911-917. doi: 10.31557/APJCP.2022.23.3.911.
- 22. Norouzi S., Majeed M., Pirro M., Generali D., Sahebkar A. Curcumin as an Adjunct Therapy and microRNA Modulator in Breast Cancer. Curr. Pharm. Des. 2018. 24(2). 171-177. doi: 10.2174/1381612824666171129203506.
- 23. Liu D., Chen Z. The effect of curcumin on breast cancer cells. J. Breast Cancer. 2013 Jun. 16(2). 133-7. doi: 10.4048/jbc.2013.16.2.133.
- 24. Roberts E., Cossigny D.A., Quan G.M. The role of vascular endothelial growth factor in metastatic prostate cancer to the skeleton. Prostate Cancer. 2013. 2013. 418340.
- 25. Farghadani R., Naidu R. Curcumin: Modulator of Key Molecular Signaling Pathways in Hormone-Independent Breast Cancer. Cancers. 2021. 13. 3427.
- 26. Chen J., Wang F.-L., Chen W.-D. Modulation of apoptosis-related cell signalling pathways by curcumin as a strategy to inhibit tumor progression. Mol. Biol. Rep. 2014. 41. 4583-4594.
- 27. Banik U., Parasuraman S., Adhikary A.K., Othman N.H. Curcumin: the spicy modulator of breast carcinogenesis. J. Exp. Clin. Cancer Res. 2017. 36. 98.
- 28. Mirzaei H., Masoudifar A., Sahebkar A., Zare N., Sadri Na–hand J. et al. MicroRNA: a novel target of curcumin in cancer therapy. J. Cell. Physiol. 2018 Apr. 233(4). 3004-3015. doi: 10.1002/jcp.26055.
- 29. Seki N., Hattori A., Hayashi A., Kozuma S., Miyajima N., Saito T. Cloning, tissue expression, and chromosomal assignment of human MRJ gene for a member of the DNAJ protein family. J. Hum. Genet. 1999. 44. 185-189.
- 30. Mitra A., Rostas J.W., Dyess D.L., Shevde L.A., Samant R.S. Micro-RNA-632 downregulates DNAJB6 in breast cancer. Lab. Invest. 2012 Sep. 92(9). 1310-7. doi: 10.1038/labinvest.2012.87.
- 31. Bartel D.P. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004. 116. 281-97.
- 32. Mar-Aguilar F., Mendoza-Ramirez J.A., Malagon-Santiago I. et al. Serum circulating microRNA profiling for identification of potential breast cancer biomarkers. Dis. Markers. 2013. 34. 163-9.
- 33. Dumont N., Tlsty T.D. Reflections on miR-ing effects in metastasis. Cancer Cell. 2009 Jul 7. 16(1). 3-4. doi: 10.1016/j.ccr.2009.06.013.
- 34. Rameshwar P. Potential novel targets in breast cancer. Curr. Pharm. Biotechnol. 2009 Feb. 10(2). 148-53. doi: 10.2174/138920109787315024.
- 35. Wright J.A., Richer J.K., Goodall G.J. MicroRNAs and EMT in mammary cells and breast cancer. J. Mammary Gland Biol. Neoplasia. 2010 Jun. 15(2). 213-23. doi: 10.1007/s10911-010-9183-z.
- 36. O’Day E., Lal A. MicroRNAs and their target gene networks in breast cancer. Breast Cancer Res. 2010. 12(2). 201. doi: 10.1186/bcr2484.
- 37. Yu Z., Baserga R., Chen L., Wang C., Lisanti M.P., Pestell R.G. MicroRNA, cell cycle, and human breast cancer. Am. J. Pathol. 2010 Mar. 176(3). 1058-64. doi: 10.2353/ajpath.2010.090664.
- 38. Calin G.A., Croce C.M. MicroRNA-cancer connection: the beginning of a new tale. Cancer Res. 2006 Aug 1. 66(15). 7390-4. doi: 10.1158/0008-5472.CAN-06-0800.
- 39. Pu J., Wang J., Xu Z. et al. MiR-632 functions as oncogene in hepatocellular carcinoma via targeting MYCT1. Hum. Gene Therapy Clin. Dev. 2019. 30(2). 67-73.
- 40. Shi Y., Huang X., Chen G. et al. MiR-632 promotes gastric cancer progression by accelerating angiogenesis in a TFF1-dependent manner. BMC Cancer. 2019. 19(1). 14.
- 41. Cao Y.C., Song L.Q., Xu W.W., Qi J.J., Wang X.Y., Su Y. Serum miR-632 is a potential marker for the diagnosis and prognosis in laryngeal squamous cell carcinoma. Acta Otolaryngol. 2020 May. 140(5). 418-421. doi: 10.1080/00016489.2020.1717610.
- 42. Mahmoudi E., Cairns M.J. MiR-137: an important player in neural development and neoplastic transformation. Mol. Psychiatry. 2017 Jan. 22(1). 44-55. doi: 10.1038/mp.2016.150.
- 43. Fan W.H., Wang F.C., Jin Z., Zhu L., Zhang J.X. Curcumin Synergizes with Cisplatin to Inhibit Colon Cancer through Targeting the MicroRNA-137-Glutaminase Axis. Curr. Med. Sci. 2022 Feb. 42(1). 108-117. doi: 10.1007/s11596-021-2469-0.
- 44. Wan L., Gu D., Jin X. LncRNA NCK1-AS1 Promotes Malignant Cellular Phenotypes of Laryngeal Squamous Cell Carcinoma via miR-137/NCK1 Axis. Mol. Biotechnol. 2022 Aug. 64(8). 888-901. doi: 10.1007/s12033-022-00469-1.
- 45. Ying X., Sun Y., He P. MicroRNA-137 inhibits BMP7 to enhance the epithelial-mesenchymal transition of breast cancer cells. Oncotarget. 2017 Mar 14. 8(11). 18348-18358. doi: 10.18632/oncotarget.15442.
- 46. Hu Q., Yuan Y., Wu Y., Huang Y., Zhao Z., Xiao C. MicroRNA‑137 exerts protective effects on hypoxia‑induced cell injury by inhibiting autophagy/mitophagy and maintaining mitochondrial function in breast cancer stem‑like cells. Oncol. Rep. 2020 Oct. 44(4). 1627-1637. doi: 10.3892/or.2020.7714.
- 47. Tao S.F., He H.F., Chen Q. Quercetin inhibits proliferation and invasion acts by upregulating miR-146a in human breast cancer cells. Mol. Cell. Biochem. 2015 Apr. 402(1–2). 93-100. doi: 10.1007/s11010-014-2317-7.
- 48. Ahmed F., Ijaz B., Ahmad Z., Farooq N., Sarwar M.B., Husnain T. Modification of miRNA expression through plant extracts and compounds against breast cancer: mechanism and translational significance. Phytomedicine. 2020 Mar. 68. 153168. doi: 10.1016/j.phymed.2020.153168.
- 49. Jin L., Li Y., Zhang Z., He T., Hu J. et al. MiR-514a-3p functions as a tumor suppressor in renal cell carcinoma. Oncol. Lett. 2017. 14. 5624.
- 50. Xie R., Liu C., Liu L., Lu X., Tang G. Long non-coding RNA FEZF1-AS1 promotes rectal cancer progression by competitively bin–ding miR-632 with FAM83A. Acta Biochim. Biophys. Sin. (Shanghai). 2022 Apr 25. 54(4). 452-462. doi: 10.3724/abbs.2022022.
- 51. Li D., Shan W., Fang Y., Wang P., Li J. MiR-137 acts as a tumor suppressor via inhibiting CXCL12 in human glioblastoma. Oncotarget. 2017. 8. 101262-101270.
- 52. Wang Z.C., Huang F.Z., Xu H.B., Sun J.C., Wang C.F. MicroRNA-137 inhibits autophagy and chemosensitizes pancreatic cancer cells by targeting ATG5. Int. J. Biochem. Cell. Biol. 2019 Jun. 111. 63-71. doi: 10.1016/j.biocel.2019.01.020.
- 53. Li W., Liu M., Xu Y.F., Feng Y., Che J.P., Wang G.C., Zheng J.H. Combination of quercetin and hyperoside has anticancer effects on renal cancer cells through inhibition of oncogenic –microRNA-27a. Oncol. Rep. 2014 Jan. 31(1). 117-24. doi: 10.3892/or.2013.2811.
- 54. Del Follo-Martinez A., Banerjee N., Li X., Safe S., Mertens-Talcott S. Resveratrol and quercetin in combination have anticancer activity in colon cancer cells and repress oncogenic microRNA-27a. Nutr. Cancer. 2013. 65(3). 494-504. doi: 10.1080/01635581.2012.725194.
- 55. Ryspayeva D., Halytskiy V., Kobyliak N., Dosenko I., Fedosov A. et al. Response to neoadjuvant chemotherapy in breast cancer: do microRNAs matter? Discov. Oncol. 2022 Jun 7. 13(1). 43. doi: 10.1007/s12672-022-00507-z.
- 56. Lee S.J., Jeong J.H., Kang S.H., Kang J., Kim E.A., Lee J. et al. MicroRNA-137 inhibits cancer progression by targeting Del-1 in triple-negative breast cancer cells. International Journal of Molecular Sciences. 2019. 20(24). 6162.