Журнал «Здоровье ребенка» Том 18, №6, 2023
Вернуться к номеру
Біліарний сладж-синдром, індукований цефалоспоринами, у дітей: клініко-діагностичні маркери, тактика лікування
Авторы: Березна Т.Г., Синоверська О.Б., Фоменко Н.М.
ННІПО ДВНЗ «Івано-Франківський національний медичний університет», м. Івано-Франківськ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
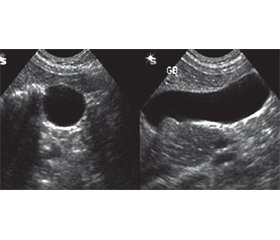
Біліарний сладж може виникнути при прийомі лікарських препаратів (оральні контрацептиви, цефалоспорини, октреотид, фуросемід, клофібрат, морфін, препарати кальцію тощо). Зокрема, 30–40 % препарату цефтріаксон, який широко застосовується в стаціонарній педіатричній практиці, екскретується з жовчю, з усіх побічних ефектів препарату 5–15 % припадає на біліарний сладж. Механізм виникнення цефтріаксоніндукованого біліарного сладжу зумовлений тим, що цефтріаксон конкурує із білірубіном за альбумін, що індукує підвищення в крові некон’югованого білірубіну. У жовч препарат потрапляє у вигляді двовалентного аніону, зв’язується із кальцієм у цефтріаксон-кальцієві комплекси із включеннями кристалів холестеролу моногідрату та гранул білірубінатів. У пацієнтів, що приймали цефалоспорини, при появі скарг з боку шлунково-кишкового тракту обов’язковим є УЗД-скринінг. Діти, які мають обтяжену спадковість з жовчнокам’яної хвороби, фактори ризику, мають проходити УЗД-скринінг на 10-й день та через 1 місяць після лікування цефалоспоринами навіть за відсутності скарг. Призначення урсодезоксихолевої кислоти призводить до значного регресу клінічної симптоматики біліарного сладжу та об’єктивних ознак УЗД у 2/3 дітей через 2 місяці.
Biliary sludge can occur when taking medicines (oral contraceptives, cephalosporins, octreotide, furosemide, clofibrate, morphine, calcium preparations, etc.). In particular, 30–40 % of ceftriaxone, which is widely used in pediatric inpatient practice, is excreted with bile, 5–15 % of all side effects of the drug are due to biliary sludge. The mechanism of ceftriaxone-associated biliary sludge is due to the fact that ceftriaxone competes with bilirubin for albumin, which induces an increase in unconjugated bilirubin in the blood. The drug enters the bile in the form of a divalent anion, binds to calcium in ceftriaxone-calcium complexes with inclusions of cholesterol monohydrate crystals and bilirubinate granules. In patients taking cephalosporins, when complaints from the gastrointestinal tract appear, ultrasound screening is mandatory. Children with a family history of gallstone disease and risk factors should undergo ultrasound screening on the 10th day and 1 month after treatment with cephalosporins, even in the absence of complaints. The administration of ursodeoxycholic acid leads to a significant regression of clinical symptoms of biliary sludge and objective ultrasound signs in 2/3 of children after 2 months.
діти; біліарний сладж; цефалоспорини; лікування
children; biliary sludge; cephalosporins; treatment
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Бєлоусова О.Ю., Волошина Л.Г., Ганзій О.Б., Бабаджанян О.М., Слободянюк О.Л. Досвід використання урсодезоксихолієвої кислоти в терапії біліарного сладжу в дітей. Zdorov’e rebenka. 2018. 13(Suppl 1). S41-S49. doi: 10.22141/2224-0551.13.0.2018.131177.
- Марушко Ю.В., Тодыка Ю.И. Использование урсодезоксихолевой кислоты у детей с нарушением коллоидного состава желчи. Современная педиатрия. 2014. № 5(61). С. 135-139.
- Cotton P.B., Elta Gr.H., Car–ter C.R., Pasricha P.J., Corazziari E.S. Gallbladder and Sphincter of Oddi Disorders. Gastroenterology. 2016 May. 150(6). 1420-1429.e2. doi: 10.1053/j.gastro.2016.02.033.
- Ko C.W., Lee S.P. Biliary sludge and cholecystitis. Best Pract. Res. Clin. Gastroenterol. 2003 Jun. 17(3). 383-96. doi: 10.1016/ S1521-6918(03)00026-X.
- European Association for the Study of the Liver (EASL). EASL Clinical Practice Guidelines on the prevention, diagnosis and treatment of gallstones. J. Hepatol. 2016 Jul. 65(1). 146-181. doi: 10.1016/j.jhep.2016.03.005.
- Jüngst C., Kullak-Ublick G.A., Jüngst D. Gallstone disease: Microlithiasis and sludge. Best Pract. Res. Clin. Gastroenterol. 2006. 20(6). 1053-62. doi: 10.1016/j.bpg.2006.03.007.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of cholestatic liver diseases. J. Hepatol. 2009 Aug. 51(2). 237-67. doi: 10.1016/j.jhep.2009.04.009.
- Brumbaugh D., Mack C. Conjugated hyperbilirubinemia in Children. Pediatr. Rev. 2012 Jul. 33(7). 291-302. doi: 10.1542/ pir.33-7-291.
- Zavhorodnya N.Yu., Lukianenko O.Yu., Yahmur V.B., Konenko I.S. Gallbladder function and hepatic structural changes in children with nonalcoholic fatty liver disease. Gastroenterologia. 2016. (60). 38-43. doi: 10.22141/2308-2097.2.60.2016.74731. (in Ukrainian).
- Shiu T.Y., Huang H.H., Lin H.H., et al. Restriction fragment length polymorphism effectively identifies exon 1 mutation of UGT1A1 gene in patients with Gilbert’s Syndrome. Liver Int. 2015 Aug. 35(8). 2050-6. doi: 10.1111/liv.12785.
- Nobili V., Alisi A., Raponi M. Pediatric non-alcoholic fatty liver disease: Preventive and therapeutic value of lifestyle intervention. World J. Gastroenterol. 2009 Dec 28. 15(48). 6017-22. doi: 10.3748/wjg.15.6017.
- Pacifico L., Anania C., Martino F., et al. Management of metabolic syndrome in children and adolescents. Nutr. Metab. Cardiovasc. Dis. 2011 Jun. 21(6). 455-66. doi: 10.1016/j.numecd.2011.01.011.
- Вabadzhanian O.M., Shutova O.V., Voloshyna L.G., Hanzii O.B., Kaafarani A., Slobodianiuk O.L. Gilbert’s syndrome targeted therapy. Zdorov’e rebenka. 2017. 12(2.1). 219-224. doi: 10.22141/2224-0551.12.2.1.2017.100984. (in Ukrainian).
- Ministry of Health of Ukraine. Order No 59, dated 29 Jan, 2013: On approval of unified clinical protocols of medical care for children with diseases of the digestive system. Available from: http:// old.moz.gov.ua/ua/portal/dn_20130129_0059.html.
- Paumgartner G., Beuers U. Ursodeoxycholic Acid in Cholestatic Liver Disease: Mechanisms of Action and Therapeutic Use Revisited. Hepatology. 2002 Sep. 36(3). 525-31. doi: 10.1053/ jhep.2002.36088.
- Guarino M.P., Cocca S., Altomare A., Emerenziani S., Cicala M. Ursodeoxycholic acid therapy in gallbladder disease, a story not yet completed. World J. Gastroenterol. 2013 Aug 21. 19(31). 5029-34. doi: 10.3748/wjg.v19.i31.5029.
- Ikegami T., Matsuzaki Y. Ursodeoxycholic acid: Mechanism of action and novel clinical applications. Hepatol. Res. 2008. 38(2). 123-31. doi: 10.1111/j.1872-034X.2007.00297.x.
- Kumar D., Tandon R.K. Use of ursodeoxycholic acid in li–ver diseases. J. Gastroenterol. Hepatol. 2001 Jan. 16(1). 3-14. doi: 10.1046/j.1440-1746.2001.02376.x.
- Pusl T., Beuers U. Ursodeoxycholic acid treatment of vanishing bile duct syndromes. World J. Gastroenterol. 2006 Jun 14. 12(22). 3487-95. doi: 10.3748/wjg.v12.i22.3487.
- Cheng K., Ashby D., Smyth R.L. Ursodeoxycholic acid for cystic fibrosis-related liver disease. Cochrane Database Syst. Rev. 2017 Sep 11. 9. CD000222. doi: 10.1002/14651858.CD000222. pub4.
- Gamboa A., Tian C., Massaad J., Reshamwala P., Cai Q. The Therapeutic Role of Ursodeoxycholic Acid in Digestive Diseases. Ann. Gastroenterol. Hepatol. 2011. 1(2). 43-49.
- Wang J.Y., Wu S.D. Chapter 55: Ursodeoxycholic Acid for the Treatment of Liver Diseases. In: Muriel P, editor. Liver Pathophysiology. UK, London: Academic Press is an imprint of Elsevier; 2017. 767-779 pp. doi: 10.1016/B978-0-12-804274- 8.00055-2.

/61.jpg)
/61_2.jpg)
/62.jpg)