Вступ
Ще донедавна вважалось, що здоров’я людини формується під впливом геному і зовнішніх впливів. Однак найсучасніші дослідження доповнили цю модель третім кардинальним компонентом — мікробіомом, що включає сукупність усіх мікроорганізмів (вірусів, бактерій, грибів, найпростіших, дрібних водоростей та їх асоціацій) в усіх біотопах людини. Усі мікроорганізми не тільки пов’язані між собою у функціональному й метаболічному аспекті, але й коеволюціонують разом зі своїм господарем. На сьогодні тривають дослідження ролі пробіотичних бактерій у збереженні здоров’я та профілактиці захворювань, оскільки вони виконують численні життєво важливі функції: синтезують вітаміни, біологічно активні речовини й сигнальні молекули, сприяють засвоєнню мікронутрієнтів, конкурують з кишковими патогенами й запобігають інфекціям, модулюють імунологічні процеси тощо [1–6].
Доведено, що порушення в мікробіомі призводять до розвитку низки захворювань, лікування яких протимікробними (антибактеріальними, противірусними, антифунгальними) засобами супроводжується глобальними наслідками — формуванням резистому. Вказані тенденції поглиблюватимуться в подальшому, оскільки філософія сучасної медицини спрямована на знищення мікроорганізмів, що, звичайно, посилює їх резистентність. Отже, для людини воювати з мікроорганізмами є абсолютно безперспективним напрямом. Саме тому потрібні інноваційні технології, що можуть відновити домінанту здорової мікрофлори, тобто ті принципово нові протимікробні засоби, що містять сертифіковані, безпечні для людини й екосистем, спеціально відібрані пробіотичні мікроорганізми (пробіотики) [1–6].
Як відомо, термін «пробіотики» був сформульований FAO (Food and Agriculture Organization of the United Nations) і WHO (World Health Organization), а пізніше підтриманий ISAPP (International Scientific Association for Probiotics and Prebiotics), що визначають їх як «живі штами суворо відібраних мікроорганізмів, що при введенні в адекватних кількостях дають користь здоров’ю хазяїна» [7–9].
Щодо класичних пробіотиків, зокрема на основі штамів роду Lactobacillus, Bifidobacterium, Lactococcus, Streptococcus і Enterococcus, то створення мікробних препаратів на їх основі є наукомістким технологічним процесом з великою кількістю лімітуючих факторів і обов’язкових критеріїв регуляторного плану. Важливі критерії для відбору пробіотичних штамів наведені в табл. 1 [7–10].
Слід зазначити, що пробіотичні характеристики пов’язані не з родом або видом мікроорганізму, а з невеликою кількістю спеціально відібраних штамів певного виду. На жаль, окремі виробники пробіотичних засобів іноді нехтують окремими критеріями через технічну неможливість їх дотримання або навіть навмисне. У будь-якому разі низка пробіотичних штамів, що мають доведений позитивний вплив на здоров’я людини, не завжди відповідають усім міжнародним критеріям [1–4].
Наприклад, деякі штами не можуть виживати в умовах низького pH шлунка, однак доставка за допомогою пероральних кишковорозчинних лікарських форм вирішує цю проблему. Також пробіотики повинні мати задокументований позитивний вплив на здоров’я людини, що відповідає характеристикам саме того штаму, який наявний у продукті. Важливо наголосити, що наукові дослідження одного певного штаму не є підставою для екстраполювання їх результатів на інший пробіотичний штам, навіть того самого виду. Слід також враховувати, що дослідження, які підтверджують пробіотичні властивості певного штаму в конкретній дозі, не є доказом аналогічних властивостей у цього ж штаму в інших дозах. На жаль, виробники дуже часто ігнорують останнє й використовують свідомо неефективні дози, особливо при реєстрації пробіотиків як дієтичних добавок. Стосовно технологічного аспекту виробники дуже рідко враховують вплив носія та допоміжних компонентів лікарської форми на життє–здатність певного штаму, що може негативно впливати на властивості продукту [11].
Також серед загальних недоліків класичних пробіотиків варто відзначити те, що їх дія базується на поповненні пулу корисних бактерій. Це означає, що пробіотики здебільшого не зменшують кількість патогенних бактерій напряму, а лише поступово, у процесі конкуренції та метаболічної модифікації навколишнього середовища під себе, відновлюючи видову рівновагу мікробіому. Надзвичайно важливою є доза пробіотичних бактерій, оскільки в недостатній кількості вони просто не зможуть конкурувати за простір з умовно-патогенними і патогенними мікроорганізмами [1, 2].
Також більшість класичних пробіотичних штамів не мають повної резистентності до антибіотиків (і нерідко можуть передавати гени резистентності патогенам), що робить можливим призначення таких пробіотиків лише після курсу антибіотикотерапії. Указане може суттєво знижувати якість життя пацієнтів, наприклад, з антибіотик-асоційованою діареєю, яка може виникнути ще до завершення прийому антибіотиків [3–6].
Останніми роками фокус змістився на використання пробіотиків з властивостями так званих біоентеросептиків, які мають усі ті властивості, що й класичні пробіотики, але при цьому позбавлені певних їх недоліків. Так, біоентеросептики можуть продукувати активні речовини, що пригнічують ріст і розвиток патогенних мікроорганізмів, зв’язувати їх токсини й більш активно модулювати імунні процеси хазяїна. Одними з найперспективніших біоентеросептиків на сьогодні є пробіотичні штами Bacillus clausiі.
Мікробіотичне різноманіття кишечника людини
Відповідно до сучасних уявлень найбільшою в організмі людини є сукупна мікробіота кишечника, що складається з понад 35 000 видів бактерій та інших мікроорганізмів. Масштабне дослідження Human Microbiome Project and Metagenome of the Human Intestinal Tract (MetaHIT) показує, що в мікробіомі людини може бути понад 10 мільйонів ненадлишкових генів [12].
До складу мікробіоти кишечника здорової людини переважно входять бактерії типу Firmicutes і Bacteroidetes і, дещо меншою мірою, Actinobacteria і Verrucomicrobia. Незважаючи на відносну сталість загального профілю, кишкова мікробіота демонструє як часові, так і просторові відмінності в розподілі. Зокрема, спостерігається доволі суттєва різниця в різноманітності й кількості бактерій у травному тракті: від 101 на 1 г вмісту в стравоході та шлунку до 1012 на 1 г вмісту в дистальному відділі кишечника [13]. Представники роду Streptococcus домінують у дистальному відділі стравоходу, дванадцятипалій і порожній кишках [14]. У шлунку домінує рід Helicobacter, який і визначає весь гастральний мікробний ландшафт: у випадку, якщо Helicobacter pylori перебуває в шлунку як коменсал, підтримується багате мікробне різноманіття, що складається з бактерій іншого домінуючого роду Streptococcus, а також Prevotella, Veillonella і Rothia [12, 15]. Якщо ж H.pylori набуває патогенного фенотипу, він стає єдиним домінуючим видом, а родове розмаїття суттєво зменшується.
Мікробіота товстої кишки об’єднує понад 70 % усіх бактерій, що ідентифіковані в організмі людини. Переважаючими типами бактерій, що населяють товстий кишечник, є Firmicutes і Bacteroidetes. У товстій кишці людини також містяться первинні патогени, зокрема такі види, як Campylobacter jejuni, Salmonella enterica, Vibrio cholerae, Escherichia coli та Bacteroides fragilis [13, 15]. Повна відсутність або низька численність Proteobacteria разом з наявністю значної кількості представників родів Bacteroides, Prevotella і Ruminococcus відповідає здоровій мікробіоті кишечника [13].
Слід зазначити, що окрім різниці у якісному вмісті мікробіоти залежно від відділу кишечника існує також осьова різниця від просвіту до поверхні слизової оболонки кишки. Роди Bacteroides, Bifidobacterium, Streptococcus, Enterobacteriacae, Enterococcus, Clostridium, Lactobacillus і Ruminococcus є переважаючими представниками люмінальної мікробіоти, а Clostridium, Lactobacillus, Enterococcus і Akkermansia асоційовані зі слизовою оболонкою й епітеліальними криптами тонкої кишки [12, 13, 15].
Широке і часто безконтрольне застосування антибактеріальних препаратів останніми роками стало причиною зростання частоти випадків антибіотик-асоційованої діареї в представників різних вікових груп. Такі порушення в мікробіомі кишечника асоційовані не лише зі зростанням у його вмісті умовно-патогенних і патогенних штамів мікроорганізмів, але й із суттєвим зменшенням (на декілька порядків) кількості анаеробних і аеробних представників нормальної мікрофлори — бактероїдів, лактобацил, біфідобактерій. При цьому тяжкість антибіотик-асоційованої діареї сильно варіює — від легкого до тяжкого ступеня, зокрема такого загрозливого для життя стану, як псевдомембранозний коліт (ПМК) — гострого запального захворювання товстого кишечника, спричиненого спороутворюючою токсинпродукуючою анаеробною бактерією Clostridioides difficile (застаріла назва — Clostridium difficile). У переважній кількості випадків (60–85 %) розвиток ПМК асоційований із прийомом антибактеріальних препаратів, що спричиняють дисбаланс нормальної мікробіоти кишечника, наслідком чого є надмірний ріст колоній Clostridioides difficile та гіперпродукція ними токсинів А і В, що відіграють ключову роль у патогенезі захворювання, оскільки мають прямий цитотоксичний вплив на ентероцити товстої кишки, призводячи до змін її цито–скелета, порушень міжклітинної взаємодії, бар’єрної функції та апоптозу. Важливим є те, що патологія може бути спровокована будь-яким антибактеріальним засобом, у тому числі ванкоміцином і метронідазолом, які вважаються препаратами першої лінії терапії ПМК [13]. Патогенез захворювання включає інтенсифікацію продукції прозапальних цитокінів, зокрема фактора некрозу пухлини α та інтерлейкіну-1β, при цьому зростає проникність стінок судин, унаслідок чого підвищується міграція нейтрофілів і моноцитів. Це призводить до некротичних змін епітеліоцитів і формування фібринозного запалення. Основні механізми дії токсину А реалізуються через порушення взаємодії клітин слизової оболонки товстого кишечника з основною мембраною та ушкодженням ворсинчастого епітелію. Токсин В стимулює апоптотичні зміни. Прозапальні й дезагрегуючі ефекти токсинів А і В призводять до значного підвищення проникності слизової оболонки кишечника. Зважаючи на те, що ПМК є життєзагрозливим ускладненням антибіотик-асоційованої діареї, для запобігання йому доцільним є використання препаратів супроводу — пробіотиків — протягом усього періоду антибіотикотерапії [13, 16, 17].
Вибір пробіотика має здійснюватись з урахуванням якісного й кількісного складу продукту, його стійкості до антибіотиків і наявності антагоністичних властивостей щодо патогенів тощо. З огляду на вищезазначене засобами вибору є пробіотичні штами Bacillus clausii, що продукують лантибіотик клаузин [16–18].
Характерною особливістю клаузину є його здатність пригнічувати активність представників патогенної флори, включно з Clostridioides difficile (рис. 1) [16–18].
Характеристика пробіотичного штаму Bacillus clausii UBBC-07
Як відомо, ефективність пробіотиків залежить перш за все від кількості корисних мікроорганізмів у їх складі. Відповідно до сучасних рекомендацій більшість пробіотичних продуктів містять мільярди клітин, і користь, яку вони приносять, залежить від здатності штамів пережити транзит через шлунок і кишечник. Спорові форми пробіотиків мають перевагу над тими, що містять вегетативні клітини, оскільки унікальний хімічний склад спор (дипіколінова кислота, білки, ліпіди, вуглеводи) і надзвичайно низька їх проникність забезпечують високу стійкість в умовах агресивного середовища різних відділів травного тракту.
/67.jpg)
Спори Bacillus clausii UBBC-07 демонструють високу толерантність до кислоти шлункового соку, жовчі й кишкового вмісту, а також мають високі адгезивні властивості. Вища гідрофобність спор порівняно з вегетативними клітинами є сприятливою для їх персистенції в кишечнику. Крім того, наявність F0F1 АТФ-синтази, декарбоксилази амінокислот, симпортера жовчних кислот, муцин-/колаген-/фібронектин-зв’язуючих білків, білків теплового/холодового шоку й універсальних стресових білків свідчить про те, що штам здатен легко переживати хімічний стрес [19].
Не викликає сумніву, що не лише виживаність і стійкість в агресивних середовищах, але й здатність колонізувати муциновий шар кишечника є незамінними факторами реалізації клінічної ефективності пробіотиків у травному тракті [17, 18]. Після потрапляння у відповідні відділи кишечника частина спор Bacillus clausii переходить у форму вегетативних клітин, які реалізують свої позитивні потенції (рис. 2).
У доклінічних дослідженнях комерційний споровий пробіотик B.clausii UBBC-07 не показав значного зменшення загальної кількості життєздатних організмів (Total Viable Count — TVC) при інкубації під час симуляції травного тракту після годування і натще в SHIME (Simulator of Human Intestinal Microbial Ecosystem), що вказує на здатність спор виживати й проростати в агресивних умовах травного тракту [18].
Також методом проточної цитометрії було виявлено частку спорового пробіотика B.clausii за умови живлення й голодування в моделі SHIME. Наприкінці шлункової фази жодна форма штаму UBBC-07 не зазнала істотних змін з початку інкубаційного процесу, що вказує на їх толерантність до дії соляної кислоти і протеолітичних ферментів шлунка [20, 21].
У стані після годування при надходженні в тонку кишку кількість «сплячих» спор значно зменшувалася, що вказує на можливість їх трансформації в інший фізіологічний стан. Крім того, популяція життєздатних спор B.clausii UBBC-07 значно зростала після години інкубації в кишечнику, що вказує на їх проростання в середовищі тонкої кишки. Порівняння TVC з даними проточної цитометрії для життєздатних клітин показало, що найбільша фракція B.clausii UBBC-07 була присутня в життєздатному й культивованому стані. Ці результати свідчать, що B.сlausii при пероральному прийомі здатні проходити через шлунок і колонізувати кишечник. Подібні результати були продемонстровані також в іншому дослідженні — проростання спор B.clausii під час транзиту через травний тракт in vivo. Крім того, 120 % життєздатних спор було виявлено в кінці інкубації в тонкій кишці за умов здійснення нутритивної підтримки організму [19].
У стані натще кількість «сплячих» спор залишалася незмінною, що вказує на толерантність, проростання або зміну фізіологічної форми, як це спостерігається в стані голодування. Це також могло бути причиною значного збільшення кількості життєздатних спор. Наприкінці інкубації в тонкому кишечнику фракція життєздатних спор здебільшого проростала у вегетативні життєздатні клітини. Близько 133 % життєздатних спор було виявлено в тонкій кишці. Отже, найбільша частка життєздатних спор і бактерій була присутня в культивованому стані. Ці результати узгоджуються з попередніми висновками досліджень про виживання, проростання й розмноження B.clausii у вегетативній формі в кишечнику людини [19].
З огляду на вищезазначене одним з найважливіших факторів стійкості й подальшої здатності до колонізації B.clausii в кишечнику є здатність до утворення спор. У свою чергу, здатність до спороутворення забезпечується наявністю дипіколінової кислоти, що утворює комплекс з іонами кальцію всередині ядра ендоспори. Цей комплекс зв’язує молекули води, наслідком чого є дегідратація спори й підвищення її стійкості до нагрівання. Комплекс «кальцій — дипіколінова кислота» також захищає ДНК бактерії від пошкоджень, зокрема температурної денатурації, підвищуючи її стабільність [19, 20].
Отже, здатність до спороутворення забезпечує стійкість пробіотиків на основі B.сlausii до агресивних середовищ травного тракту і температурного впливу, що, у свою чергу, є надзвичайно важливим для забезпечення клінічної ефективності цих корисних мікроорганізмів, оскільки дозволяє зберегти достатню їх кількість при пероральному прийомі. Крім того, стійкість до агресивного середовища травного тракту завдяки наявності у бактерій власного механізму захисту (формування спор) дозволяє уникнути використання кислотостійких/кишковорозчинних капсул у лікарській формі [19].
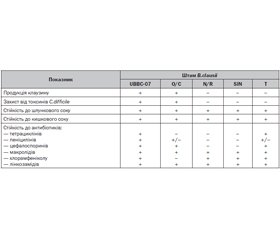
Геноми пробіотичних штамів B.clausii були детально секвеновані й анотовані. Штами O/C, N/R, SIN і T за сумою генів найбільш близькі до штаму B106, який, у свою чергу, подібний до штаму UBBC-07. Усі вищезазначені штами B.сlausii мають спільного пращура — штам KSM-K16, що використовується здебільшого в промислових цілях. Через це пробіотичні штами B.сlausii мають практично однакові характеристики з невеликими відмінностями. Наприклад, завдяки особливостям геному штам B106 може виявляти найпотужнішу кислото- і жовчостійкість, штам UBBC-07 найкраще перешкоджає росту патогенних мікроорганізмів, штам AKU0647 продукує ферменти, що розщеплюють глікопротеїни [20–22].
Сумарний геном B.clausii O/C, N/R, SIN і T також включає гени, що визначають стійкість і кодують синтез бактеріоцинів, проте слід зазначити, що кожний окремий штам має власні характеристики, наприклад, лише O/C здатний продукувати клаузин. Крім того, штами у складі комбінованого пробіотика мають не–однакову резистентність до антибіотиків різних груп [20]. Незважаючи на те, що препарати B.clausii O/C, N/R, SIN і T зарекомендували себе як ефективні й безпечні пробіотики з достатньою історією застосування, усе ж з регуляторної точки зору поєднання трьох і більше штамів пробіотичних мікроорганізмів не є бажаним [1]. Результати секретомного аналізу цих чотирьох штамів B.clausii вказують на те, що, незважаючи на їхню генотипову подібність, кожен штам характеризується специфічним патерном секреції, що обумовлює специфічну взаємодію з клітинами хазяїна й патогенними мікроорганізмами для кожного окремого штаму [23]. Отже, ефективність мультиштамового препарату обумовлена сукупністю специфічних властивостей (функції, ріст і виживаність) кожного штаму, на які безпосередньо впливають етіологія й патогенез захворювання пацієнта, прийом певних лікарських засобів тощо. Отже, цілком можливо, що для пацієнтів кінцевий вміст у кишечнику того чи іншого пробіотичного штаму може відрізнятися. У будь-якому випадку секретомний аналіз біомаркерів ефективних і безпечних комбінованих пробіотичних засобів може стати в нагоді для вивчення й відбору нових моноштамів з найкращим пробіотичним потенціалом.
Узагальнення відмінностей між різними штамами B.сlausii, що використовують у препаратах пробіотиків, наведено в табл. 2 [20, 21, 24].
Взаємодія Bacillus clausii з патогенною і нормальною мікрофлорою
Механізми реалізації клінічної ефективності Bacillus clausii засновані, зокрема, на багатогранних імуномодулюючих властивостях, що забезпечують антагоністичну дію відносно патогенів, які відповідальні за розвиток і прогресування антибіотик-асоційованої діареї [16].
У низці досліджень доведено, що Bacillus clausii суттєво (більше ніж у 4 рази) підвищують продукцію β-дефензинів — ключових природних антимікробних пептидів людини. Так, β-дефензин-2 (hBD-2) людини є індуцибельним пептидом з доведеною активністю проти грамнегативних бактеріальних патогенів. Відомо, що цей пептид не лише здатен пригнічувати ріст бактеріальних патогенів, але й гальмує утворення біоплівок, чинить протизапальну й противірусну дії. Зокрема, було показано пригнічення В.clausii активності ротавірусу. Вегетативні клітини штаму В.clausii –UBBC-07 здатні продукувати лантибіотик клаузин, який виявляє потужну антимікробну активність проти грампозитивних бактерій і зменшує цитотоксичний вплив Clostridioides difficile, що обґрунтовує доцільність використання в лікуванні й профілактиці ПМК. На моделі ротавірусної інфекції з використанням людських ентероцитів було встановлено здатність вегетативних клітин B.clausii індукувати синтез муцину — захисного глікопротеїну слизової оболонки травного тракту, що, у свою чергу, сприяє підтримці нормальної проліферації ентероцитів, захищаючи їх від некрозу й апоптозу. Отже, комплексний вплив B.сlausii забезпечує їх клінічну ефективність при захворюваннях, викликаних порушенням якісного і кількісного складу мікробіоти травного тракту. Крім того, зазначені механізми обґрунтовують доцільність застосування B.сlausii при інших захворюваннях, у патогенезі яких мають місце імунологічні порушення [16, 17, 19, 25, 26].
Для ефективного лікування і профілактики порушень складу мікробіому внаслідок застосування антибактеріальних засобів важливою є не лише здатність пробіотичних мікроорганізмів проявляти антагонізм до патогенів, але й сприяння відновленню нормальної мікрофлори. Сучасними дослідженнями доведено, що B.сlausii здатні синтезувати каталазу й субтилізин, які необхідні для нормального росту Lactobacillus — важливих представників індигенної флори кишечника.
В експерименті застосування спор B.clausii супроводжувалось підвищенням продукції бутирату зі збільшенням видового розмаїття мікробіоти кишечника, зокрема (але не виключно) Faecalibacterium prausnitzii, Bifidobacterium spp. і Lactobacillus spp., що свідчить про здатність цього пробіотичного мікроорганізму сприяти відновленню складу кишкового мікробіому [16–18, 27].
Порівняння Bacillus clausii з класичними пробіотичними штамами
Низка особливостей B.сlausii вигідно відрізняє їх від пробіотиків на основі дріжджів Saccharomyces boulardii, зокрема, це стосується тривалості пробіотичного ефекту (показника, що в переважній більшості випадків є визначальним для профілактики рецидиву захворювання й повної реконвалесценції пацієнта). Ефект Saccharomyces boulardii триває 5–7 діб, вони не колонізують кишечник і вже через 2–5 днів після завершення прийому не виявляються в калі, у той час як дія B.сlausii в кишечнику триває до 30 діб. Не викликає сумніву, що саме наявність постпробіотичного ефекту є визначальною для профілактики ускладнень і рецидиву захворювання. Крім того, B.сlausii мають більш сприятливий профіль безпеки порівняно із Saccharomyces boulardii, для яких описані випадки фунгемії в пацієнтів (зокрема, педіатричного профілю) з ослaбленим iмунiтетом, тяжкими загальними захворюваннями кишечника, а також у госпіталізованих пацієнтів із центральним венозним катетером, що створює суттєві обмеження щодо використання цих препаратів в умовах стаціонару [28, 29].
Окремо слід зазначити, що Saccharomyces boulardii практично не впливають на ріст індигенної мікрофлори, у той час як B.сlausii сприяють відновленню мікробіоти кишечника за рахунок продукції каталази й субтилізину. Відповідно, використання B.сlausii супроводжується коротшим періодом відновлення пацієнтів та ефективнішою подальшою профілактикою ускладнень і рецидивів [16–18, 28–30].
Відомо, що одними з найбільш поширених класів пробіотиків на фармацевтичному ринку є препарати на основі лакто- і біфідобактерій. Їх застосування є фактично замісною терапією, що дозволяє кількісно витіснити представників патогенної флори або пригнітити їх розмноження. Слід зазначити, що ефективне застосування цих препаратів обмежене цілою низкою факторів, серед яких — здатність окремих лактобактерій утворювати лівообертальні ізомери (L-форми) молочної кислоти, у той час як корисною для організму є лише правообертальна форма. Саме тому ВООЗ рекомендує обмежити застосування штамів лактобактерій, які продукують L-форми лактату, що не тільки не виявляє антагонізму до патогенів, але й може спричиняти цілу низку метаболічних порушень. Крім того, комбінації штамів лакто- і біфідобактерій з іншими видами мікроорганізмів не завжди відповідають вимогам ВООЗ, що висуваються до них. Важливим аспектом є також кількість колонієутворюючих одиниць мікроорганізмів у препаратах на основі лакто- і біфідобактерій, оскільки саме ці показники прямо корелюють з ефективністю терапії. На жаль, вказаний показник не завжди відповідає вимогам, що висуваються до пробіотиків [7–10, 31–33].
Не рекомендується застосовувати препарати лакто- і біфідобактерій одночасно з антибіотикотерапією через низьку стійкість певних їх штамів до дії хіміотерапевтичних засобів. Крім цього, більшість штамів лакто- і біфідобактерій здатні передавати гени стійкості до антимікробних засобів іншим мікроорганізмам, у тому числі патогенним [31–33], що сприяє поширенню антибіотикорезистентності.
Бурхливий розвиток біотехнологій дав поштовх до активного дослідження можливості горизонтального переносу генів антибіотикорезистентності до патогенних представників мікробіому. З появою полірезистентних штамів, зокрема B.сlausii, така імовірність була спростована у відповідних дослідженнях. При цьому B.сlausii, як було зазначено вище, сприяють відновленню складу індигенної мікробіоти природним шляхом, а їх застосування можливе з першого дня прийому антибактеріальних препаратів, оскільки бактерії притаманна резистентність до їх дії [16, 31, 32].
Відсутність механізмів горизонтальної передачі генів антибіотикорезистентності іншим, у тому числі патогенним, бактеріям є одним з найжорсткіших і в той же час одним з найважливіших сучасних критеріїв безпеки використання пробіотиків. Окремі штами B.сlausii мають повну відсутність прямих і віддалених ризиків для здоров’я людини, завдяки чому і набули статусу продукту з високим ступенем безпеки — GRAS (Generally Recognized As Safe), що надається американським регулятором FDA [33].
У табл. 3 узагальнено відмінності між B.сlausii та іншими класичними пробіотичними мікроорганізмами.
Клінічні дані з вивчення ефективності й безпеки застосування Bacillus clausii
Добре відомо, що оцінка клінічної ефективності й профілю безпеки лікарських засобів можлива лише в рамках широкомасштабних клінічних досліджень. Препарати на основі B.clausii підтвердили свою ефективність і безпеку при застосуванні в пацієнтів з різноманітними розладами травної системи, алергічними й інфекційними захворюваннями верхніх дихальних шляхів.
Maity і Gupta [34] у рамках рандомізованого подвійного сліпого паралельного плацебо-контрольованого дослідження вивчали ефективність і безпеку B.clausii в дітей (n = 60, вік 2–10 років), а також у підлітків і дорослих (n = 60, 11–65 років) з гострою інфекційною діареєю, які отримували антибіотики широкого спектра дії протягом 5 днів. Пацієнти були рандомізовані (1 : 1) для отримання B.clausii (ідентифікованого відповідно до нової номенклатури як Alkalihalobacillus clausii (A.clausii), штам 088AE) у кількості 2 × 109 КУО двічі (діти) або тричі (підлітки й дорослі) на добу або плацебо протягом 7 днів на тлі антибіотикотерапії. Результати свідчать, що прийом B.clausii зменшував загальну кількість неоформлених випорожнень як у дітей (через 24 год: 16,9 % проти 0 % у групі плацебо; через 168 год: 99,0 % проти 28,5 % у групі плацебо; p < 0,0001), так і в підлітків і дорослих (через 24 год: 57,7 % проти 11,0 %; через 96 год: 98,6 % проти 28,3 % відповідно; p < 0,0001). Крім того, нормалізація випорожнень у групах пацієнтів, які отримували Bacillus clausii, наставала вірогідно швидше порівняно з плацебо. Загалом значно більше пацієнтів, які отримували B.clausii порівняно з плацебо, досягли повної ремісії захворювання (діти: 100 % проти 3,0 %; ВР 30,0; 95% ДІ 4,3–100; p < 0,0001; підлітки й дорослі: 73,3 % проти 33,3 %; ВР 2,2; 95% ДІ 1,27–3,81; p < 0,0001). При цьому пацієнти добре переносили прийом Bacillus clausii, що встановлено за відсутністю повідомлень про побічні явища.
У рамках подвійного сліпого рандомізованого плацебо-контрольованого дослідження з паралельними групами, проведеного Sudha et al. [35], оцінювали ефективність і профіль безпеки B.clausii штаму –UBBC-07 (2 × 109 КУО двічі на день протягом 5 днів) для лікування гострої діареї в дітей віком від 6 місяців до 5 років (n = 119). Результати свідчать, що прийом B.clausii на тлі пероральної регідратації значно скорочував тривалість діареї (75,3 год проти 81,6 год) і частоту випорожнень (день 4: 3,5 проти 4,6; день 5: 0 проти 3,6) порівняно з плацебо разом з пероральною регідратацією. В основній групі також спостерігалося покращення консистенції випорожнень. Однак прийом Bacillus clausii не впливав на інші прояви захворювання (блювання й тривалість лихоманки). Дані цього дослідження показують, що штам B.clausii UBBC-07 ефективний у лікуванні діареї в дітей.
Sudha et al. у проспективному дослідженні штаму B.clausii UBBC-07 виявили його високу клінічну ефективність у зменшенні симптомів діареї в пацієнтів дорослого віку, при цьому препарат демонстрував добру переносимість за відсутності побічних ефектів.
Наступним етапом досліджень у 2019 році було вивчення безпеки й ефективності суспензії спор B.clausii UBBC-07 у лікуванні гострої діареї в дітей віком від 0,5 до 5 років. Результати свідчать, що при прийомі пробіотика скорочувалась тривалість діареї, зменшувалася частота випорожнень і нормалізувалась їх консистенція [16, 17].
У широкомасштабному відкритому обсерваційному дослідженні de Castro et al. [36] вивчали безпеку й ефективність B.clausii (O/C, N/R, SIN і T) як доповнення до стандартної терапії у 3178 дітей (віком від 1 місяця до 6 років) з гострою позалікарняною діареєю (вірусна або пов’язана з прийомом антибіотиків). Препарат Bacillus clausii у дозі 2 або 4 × 109 КУО на день протягом 5–7 днів добре переносився з дуже низькою частотою побічних ефектів (0,09 %), які всі були легкого/помірного ступеня. Діарея минала протягом 3 днів після початку прийому B.clausii у 52,6 % (1535/2916) дітей. Лікування Bacillus clausii також зменшило середню кількість випорожнень на день (з 5,2 раза на початку дослідження до 1,2 раза наприкінці; p < 0,001) і частку дітей з рідкими випорожненнями (з 81,6 до 9,2 %; p < 0,001). Не спостерігалося жодних відмінностей, пов’язаних з лікуванням, між дітьми з вірусною діареєю та діареєю на тлі прийому антибіотиків. Ці результати додатково демонструють добрий профіль ефективності й безпеки B.clausii у лікуванні гострої діареї в дітей.
Madempudi et al. у рамках подвійного сліпого рандомізованого плацебо-контрольованого клінічного дослідження вивчали доцільність застосування штаму B.clausii UBBC-07 у симптоматичному лікуванні інфекцій верхніх дихальних шляхів у дітей (n = 90) віком від 4 до 7 років. Діти основної групи отримували перорально суспензію спор B.clausii UBBC-07 (2 × 109 у флаконі 5 мл), а в групі контролю — плацебо 2 рази/день протягом 3 місяців. Загальна тривалість дослідження становила 6 місяців (3 місяці лікування і 3 — спостереження). Результати свідчать про суттєве зниження кількості, тривалості й тяжкості інфекцій верхніх дихальних шляхів у групі дітей, які отримували B.clausii UBBC-07, порівняно з вихідними показниками і групою плацебо. Застосування пробіотика супроводжувалось зниженням рівнів IgA та IgE у слині, що свідчить про його імунотропні потенції [37].
McFarlin et al. виявили зменшення ендотоксемії на 42 % через 5 год після вживання їжі в пацієнтів, які отримували суміш спороутворюючих пробіотичних штамів включно з B.clausii, у той час як використання плацебо (рисового борошна) супроводжувалося підвищенням рівнів ендотоксинів у сироватці крові на 36 %. Крім того, пробіотик сприяв зменшенню на 24 % рівнів тригліцеридів сироватки крові через 3 год після вживання їжі, а також зниженню показників прозапальних біомаркерів IL-12p70, IL-1β і греліну. Важливо зазначити практично значущий факт — зменшення рівня прозапальних маркерів за допомогою загальноприйнятих заходів зі зниження маси тіла потребувало учетверо більше часу (> 12 тижнів). Отже, використання пробіотичних бактерій B.clausii є перспективною терапевтичною стратегією для зменшення системного запалення в пацієнтів з ризиком метаболічної ендотоксемії та пов’язаних з цим кардіоваскулярних захворювань [38].
Отже, клінічні дослідження пробіотиків на основі B.clausii підтверджують їх ефективність у лікуванні й профілактиці діарей різного генезу (інфекційних і спричинених прийомом антибактеріальних препаратів). Слід відзначити, що наявність імуномодулюючих властивостей B.clausii дозволяє ефективно застосовувати їх у комплексній терапії алергічних та інфекційних захворювань за наявності доведеного сприятливого профілю безпеки в пацієнтів різних вікових груп.
На сьогодні в арсеналі практичного лікаря є високотехнологічні продукти — суспензія оральна Пробіз® kids і Пробіз® DUO, що містять спори полірезистентного штаму Bacillus clausii UBBC-07 у кількості 2 × 109 і 4 × 109 КУО відповідно. Ці засоби рекомендовані для підтримки нормального стану кишкового мікробіому при лікуванні антибіотиками, поліпшення травлення при діареї та при необхідності підвищення імунітету.
Пробіз® kids і Пробіз® DUO абсолютно безпечні для дорослих і дітей з 28-го дня життя, що доведено у відповідних клінічних дослідженнях.
З профілактичною метою Пробіз® kids і Пробіз® DUO можна вживати дітям від 28 днів до 6 років — по 1 флакону суспензії 1 раз на добу; у випадках вираженого порушення мікробіому кишечника — по 1 флакону 2 рази на добу через однакові проміжки часу. Оптимальний обсяг вживання Пробіз® kids та Пробіз® DUO у дітей, старших за 6 років, і дорослих становить 1 флакон 1–2 рази на добу або ж за рекомендацією лікаря. Пробіз® kids і Пробіз® DUO доцільно вживати з першого дня прийому антибіотика.
Оптимальна тривалість вживання Пробіз® kids і Пробіз® DUO становить 10 днів, але при більш тривалому курсі антибіотикотерапії Пробіз® kids і Пробіз® DUO доцільно використовувати довше — у такому випадку необхідно проконсультуватися з лікарем.
Висновки
Модернізація і розвиток біотехнологічної промисловості спонукають використовувати більш сучасні підходи до збереження здоров’я, профілактики й лікування захворювань. Зміщення фокусу уваги на біоентеросептики не лише пов’язане з новітніми тенденціями в терапії гастроінтестинальних розладів, інфекційних та алергічних захворювань, але й обумовлене практичною стороною питання — вони є більш прийнятними, ніж класичні пробіотики, за ефективністю, тривалістю пробіотичного ефекту, профілем безпеки й віддаленими наслідками застосування. Безумовно, найбільш перспективними на сьогодні є штами Bacillus сlausii, зокрема UBBC-07, безпека й ефективність яких доведені клінічними дослідженнями й підтверджені міжнародними регуляторними організаціями.
Конфлікт інтересів. Не заявлений.
Отримано/Received 10.09.2023
Рецензовано/Revised 16.10.2023
Прийнято до друку/Accepted 20.10.2023

/65.jpg)
/67.jpg)
/68.jpg)
/70.jpg)