Журнал «Здоровье ребенка» Том 18, №7, 2023
Вернуться к номеру
Регуляція мікроРНК за допомогою продуктів харчування. Частина 2. Продукти харчування тваринного походження
Авторы: Абатуров О.Є., Бабич В.Л.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
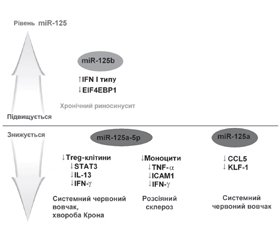
У науковому огляді наведено механізми регуляції біологічних процесів організму людини мікроРНК за допомогою продуктів харчування, а саме продуктів харчування тваринного походження. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library. Відомо, що молекули мікроРНК молока зберігають біологічну активність у травному тракті протягом тривалого часу, досягають слизової оболонки кишечника й проникають у внутрішній континуум організму. Зазначено, що в грудному молоці мікроРНК переважно знаходяться в екстрацелюлярних везикулах, які є сигналосомами, що опосередковують ефективність молекулярної комунікації між матір’ю та її дитиною. Було показано, що грудне молоко містить близько 1400 різних мікроРНК, більшість яких знаходяться в екзосомах. У таблиці наводяться дані про те, що вміст мікроРНК у грудному молоці змінюється протягом післяпологового періоду. Науковці вважають, що велика кількість мікроРНК міститься як у сирому коров’ячому молоці, так і в комерційних молочних продуктах харчування. Штучні молочні суміші є мікроРНК-дефіцитними молочними продуктами харчування. Автори наводять дані, що дефіцит miR-148a асоційований з розвитком таких патологічних процесів гепатобіліарної системи, як запалення, фіброз печінки, канцерогенез і порушення ліпідного обміну. Показано, що м’ясні продукти містять великі обсяги різноманітних мікроРНК, які можуть зберігати функціональну активність навіть після термічної обробки. Отже, у всебічному огляді з використанням новітніх інформаційних пошукових баз даних встановлено: у сучасній науковій літературі автори відзначають горизонтальне переміщення від тварин до організму людини численних молекул мікроРНК. Основним продуктом харчування, що відновлює дефіцит мікроРНК, є молоко. Грудне молоко містить мРНК, мікроРНК і безліч інших активних субстанцій. Вигодовування дітей штучними молочними сумішами призводить до вираженого дефіциту екзогенних мікроРНК. Зміна структури транскриптому людини обумовлена вживанням м’ясних продуктів.
The scientific review considers the mechanisms of microRNA regulation of biological processes in the human body with the help of food products, namely those of animal origin. To write the article, information was searched using Scopus, Web of Science, MEDLINE, PubMed, Google Scholar, Embase, Global Health, The Cochrane Library databases. It is known that microRNA molecules of milk retain their biological activity in the digestive tract for a long time, reach the intestinal mucosa and penetrate the internal continuum of the body. It is stated that in breast milk, microRNAs are mainly found in extracellular vesicles, which are signalosomes that mediate the effectiveness of molecular communication between the mother and her child. Breast milk has been shown to contain about 1,400 different miRNAs, most of which are located in exosomes. The authors indicate that the representation of miRNA in breast milk changes during the postpartum period. Scientists believe that large amounts of microRNAs are found both in raw cow’s milk and in commercial dairy foods. Formulas are miRNA-deficient dairy foods. The authors provide data that miR-148a deficiency is associated with the development of pathological processes of the hepatobiliary system such as inflammation, liver fibrosis, carcinogenesis and lipid metabolism disorders. It has been shown that meat products contain large amounts of various miRNAs, which can retain their functional activity even after heat treatment. So, in a comprehensive review using the latest information search databases, it was found that in the modern scientific literature, the authors determine the horizontal transfer of numerous microRNA molecules from animals to the human body. The main food product that restores microRNA deficiency is milk. Breast milk contains mRNA, microRNA and many other active substances. Feeding children with formulas leads to a pronounced deficiency of exogenous miRNAs. The change in the structure of the human transcriptome is due to the consumption of meat products.
мікроРНК; грудне молоко; коров’яче молоко; штучні молочні суміші; м’ясо; огляд
microRNA; miRNA; miR; breast milk; cow’s milk; formulas; meat; review
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Абатуров О.Є., Товарницька А.О. Вплив miR-155 грудного молока на стан здоров’я недоношених новонароджених. Здоров’я дитини. 2022. 7(17). 53-59. DOI: 10.22141/2224-0551.17.7.2022.1539.
- Admyre C., Johansson S.M., Qazi K.R. et al. Exosomes with immune modulatory features are present in human breast milk. J. Immunol. 2007 Aug 1. 179(3). 1969-78. doi: 10.4049/jimmunol.179.3.1969.
- Alsaweed M., Hepworth A.R., Lefèvre C. et al. Human Milk –MicroRNA and Total RNA Differ Depending on Milk Fractionation. J. Cell. Biochem. 2015 Oct. 116(10). 2397-407. doi: 10.1002/jcb.25207.
- Alsaweed M., Hartmann P.E., Geddes D.T., Kakulas F. Micro–RNAs in Breastmilk and the Lactating Breast: Potential Immunoprotectors and Developmental Regulators for the Infant and the Mother. Int. J. Environ. Res. Public Health. 2015 Oct 30. 12(11). 13981-4020. doi: 10.3390/ijerph121113981.
- Auerbach A., Vyas G., Li A. et al. Uptake of dietary milk miRNAs by adult humans: a validation study. F1000Res. 2016 Apr 22. 5. 721. doi: 10.12688/f1000research.8548.1.
- Baier S.R., Nguyen C., Xie F. et al. MicroRNAs are absorbed in biologically meaningful amounts from nutritionally relevant doses of cow milk and affect gene expression in peripheral blood mononuclear cells, HEK-293 kidney cell cultures, and mouse livers. J. Nutr. 2014 Oct. 144(10). 1495-500. doi: 10.3945/jn.114.196436.
- Benmoussa A., Lee C.H., Laffont B. et al. Commercial Dairy Cow Milk microRNAs Resist Digestion under Simulated Gastrointestinal Tract Conditions. J. Nutr. 2016 Nov. 146(11). 2206-2215. doi: 10.3945/jn.116.237651.
- Benmoussa A., Ly S., Shan S.T. A subset of extracellular vesicles carries the bulk of microRNAs in commercial dairy cow’s milk. J. Extracell. Vesicles. 2017 Nov 21. 6(1). 1401897. doi: 10.1080/20013078.2017.1401897.
- Biagioni F., Bossel Ben-Moshe N., Fontemaggi G. et al. The locus of microRNA-10b: a critical target for breast cancer insurgence and dissemination. Cell. Cycle. 2013 Aug 1. 12(15). 2371-5. doi: 10.4161/cc.25380.
- Cabantous S., Hou X., Louis L. et al. Evidence for an important role of host microRNAs in regulating hepatic fibrosis in humans infected with Schistosoma japonicum. Int. J. Parasitol. 2017 Nov. 47(13). 823-830. doi: 10.1016/j.ijpara.2017.05.007.
- Chen W., Zhao W., Yang A. et al. Integrated analysis of micro–RNA and gene expression profiles reveals a functional regulatory mo–dule associated with liver fibrosis. Gene. 2017 Dec 15. 636. 87-95. doi: 10.1016/j.gene.2017.09.027.
- Chen X., Gao C., Li H. et al. Identification and characterization of microRNAs in raw milk during different periods of lactation, commercial fluid, and powdered milk products. Cell. Res. 2010 Oct. 20(10). 1128-37. doi: 10.1038/cr.2010.80.
- Cheng L., Zhu Y., Han H. et al. MicroRNA-148a deficiency promotes hepatic lipid metabolism and hepatocarcinogenesis in mice. Cell. Death Dis. 2017 Jul 13. 8(7). e2916. doi: 10.1038/cddis.2017.309.
- Cui J., Zhou B., Ross S.A., Zempleni J. Nutrition, microRNAs, and Human Health. Adv. Nutr. 2017 Jan 17. 8(1). 105-112. doi: 10.3945/an.116.013839.
- Deng W., Zhang X., Ma Z. et al. MicroRNA-125b-5p mediates post-transcriptional regulation of hepatitis B virus replication via the LIN28B/let-7 axis. RNA Biol. 2017 Oct 3. 14(10). 1389-1398. doi: 10.1080/15476286.2017.1293770.
- Dever J.T., Kemp M.Q., Thompson A.L. et al. Survival and Diversity of Human Homologous Dietary MicroRNAs in Conventionally Cooked Top Sirloin and Dried Bovine Tissue Extracts. PLoS One. 2015 Sep 22. 10(9). e0138275. doi: 10.1371/journal.pone.0138275.
- El-Ekiaby N.M., Mekky R.Y., Riad S.E. et al. miR-148a and miR-30a limit HCV-dependent suppression of the lipid droplet protein, ADRP, in HCV infected cell models. J. Med. Virol. 2017 Apr. 89(4). 653-659. doi: 10.1002/jmv.24677.
- Elhelw D.S., Riad S.E., Shawer H. et al. Ectopic delivery of miR-200c diminishes hepatitis C virus infectivity through transcriptional and translational repression of Occludin. Arch. Virol. 2017 Nov. 162(11). 3283-3291. doi: 10.1007/s00705-017-3449-3.
- Feng Y.Y., Xu X.Q., Ji C.B. et al. Aberrant hepatic microRNA expression in nonalcoholic fatty liver disease. Cell. Physiol. Biochem. 2014. 34(6). 1983-97. doi: 10.1159/000366394.
- Golan-Gerstl R., Elbaum Shiff Y., Moshayoff V. et al. Characterization and biological function of milk-derived miRNAs. Mol. Nutr. Food Res. 2017 Oct. 61(10). doi: 10.1002/mnfr.201700009.
- Han H., Sun D., Li W. et al. A c-Myc-MicroRNA functional feedback loop affects hepatocarcinogenesis. Hepatology. 2013 Jun. 57(6). 2378-89. doi: 10.1002/hep.26302.
- Haneklaus M., Gerlic M., O’Neill L.A., Masters S.L. miR-223: infection, inflammation and cancer. J. Intern. Med. 2013 Sep. 274(3). 215-26. doi: 10.1111/joim.12099.
- Heo M.J., Kim T.H., You J.S. et al. Alcohol dysregulates miR-148a in hepatocytes through FoxO1, facilitating pyroptosis via TXNIP overexpression. Gut. 2018 Feb 23. pii: gutjnl-2017-315123. doi: 10.1136/gutjnl-2017-315123.
- Humphreys K.J., Conlon M.A., Young G.P. et al. Dietary manipulation of oncogenic microRNA expression in human rectal mucosa: a randomized trial. Cancer Prev. Res. (Phila). 2014 Aug. 7(8). 786-95. doi: 10.1158/1940-6207.CAPR-14-0053.
- Hyun J., Wang S., Kim J. et al. MicroRNA-378 limits activation of hepatic stellate cells and liver fibrosis by suppressing Gli3 expression. Nat. Commun. 2016 Mar 22. 7. 10993. doi: 10.1038/ncomms10993.
- Izumi H., Kosaka N., Shimizu T. et al. Bovine milk contains –microRNA and messenger RNA that are stable under degradative conditions. J. Dairy Sci. 2012 Sep. 95(9). 4831-4841. doi: 10.3168/jds.2012-5489.
- Izumi H., Tsuda M., Sato Y. et al. Bovine milk exosomes contain microRNA and mRNA and are taken up by human macrophages. J. Dairy Sci. 2015 May. 98(5). 2920-33. doi: 10.3168/jds.2014-9076.
- Jung K.H., Zhang J., Zhou C. et al. Differentiation therapy for hepatocellular carcinoma: Multifaceted effects of miR-148a on tumor growth and phenotype and liver fibrosis. Hepatology. 2016 Mar. 63(3). 864-79. doi: 10.1002/hep.28367.
- Kahn S., Liao Y., Du X. et al. Exosomal MicroRNAs in Milk from Mothers Delivering Preterm Infants Survive in Vitro Digestion and Are Taken Up by Human Intestinal Cells. Mol. Nutr. Food Res. 2018 Jun. 62(11). e1701050. doi: 10.1002/mnfr.201701050.
- Kocic G., Bjelakovic L., Bjelakovic B. et al. Impact of folic acid supplementation on single- and double-stranded RNA degradation in human colostrum and mature milk. J. Med. Food. 2014 Jul. 17(7). 804-9. doi: 10.1089/jmf.2013.0093.
- Kosaka N., Izumi H., Sekine K., Ochiya T. microRNA as a new immune-regulatory agent in breast milk. Silence. 2010 Mar 1. 1(1). 7. doi: 10.1186/1758-907X-1-7.
- Kulkarni S., Mercado V., Rios M. et al. Breast milk is better than formula milk in preventing parenteral nutrition-associated liver disease in infants receiving prolonged parenteral nutrition. J. Pediatr. Gastroenterol. Nutr. 2013 Sep. 57(3). 383-8. doi: 10.1097/MPG.0b013e31829b68f3.
- Lai Y.C., Ushio N., Rahman M.M. et al. Aberrant expression of microRNAs and the miR-1/MET pathway in canine hepatocellular carcinoma. Vet. Comp. Oncol. 2018 Jun. 16(2). 288-296. doi: 10.1111/vco.12379.
- Le Doare K., Holder B., Bassett A., Pannaraj P.S. Mother’s Milk: A Purposeful Contribution to the Development of the Infant Microbiota and Immunity. Front. Immunol. 2018 Feb 28. 9. 361. doi: 10.3389/fimmu.2018.00361.
- Lee H.M., Kim T.S., Jo E.K. MiR-146 and miR-125 in the regulation of innate immunity and inflammation. BMB Rep. 2016 Jun. 49(6). 311-8. doi: 10.1016/j.yexcr.2015.09.015.
- Liao Y., Du X., Li J., Lönnerdal B. Human milk exosomes and their microRNAs survive digestion in vitro and are taken up by human intestinal cells. Mol. Nutr. Food Res. 2017 Nov. 61(11). doi: 10.1002/mnfr.201700082.
- Lin L.L., Wang W., Hu Z. et al. Erratum to: Negative feedback of miR-29 family TET1 involves in hepatocellular cancer. Med. Oncol. 2015 Mar. 32(3). 39. doi: 10.1007/s12032-014-0437-2.
- Lubberts E. The IL-23-IL-17 axis in inflammatory arthritis. Nat. Rev. Rheumatol. 2015 Jul. 11(7). 415-29. doi: 10.1038/nrrheum.2015.53.
- Lukasik A., Brzozowska I., Zielenkiewicz U., Zielenkiewicz P. Detection of Plant miRNAs Abundance in Human Breast Milk. Int. J. Mol. Sci. 2017 Dec 23. 19(1). pii: E37. doi: 10.3390/ijms19010037.
- Lukasik A., Zielenkiewicz P. In silico identification of plant –miRNAs in mammalian breast milk exosomes — a small step forward? PLoS One. 2014 Jun 16. 9(6). e99963. doi: 10.1371/journal.pone.0099963.
- Mahesh G., Biswas R. MicroRNA-155: A Master Regulator of Inflammation. J. Interferon Cytokine Res. 2019 Jun. 39(6). 321-330. doi:10.1089/jir.2018.0155.
- Melnik B.C., Schmitz G. Milk’s Role as an Epigenetic Regulator in Health and Disease. Diseases. 2017 Mar 15. 5(1). pii: E12. doi: 10.3390/diseases5010012.
- Miyasaka K.Y., Kida Y.S., Banjo T. et al. Heartbeat regulates cardiogenesis by suppressing retinoic acid signaling via expression of miR-143. Mech. Dev. 2011 Jan-Feb. 128(1-2). 18-28. doi: 10.1016/j.mod.2010.09.002.
- Moriya N., Shibasaki S., Karasaki M., Iwasaki T. The Impact of MicroRNA-223-3p on IL-17 Receptor D Expression in Synovial Cells. PLoS One. 2017 Jan 5. 12(1). e0169702. doi: 10.1371/journal.pone.0169702.
- Munch E.M., Harris R.A., Mohammad M. et al. Transcriptome profiling of microRNA by Next-Gen deep sequencing reveals known and novel miRNA species in the lipid fraction of human breast milk. PLoS One. 2013. 8(2). e50564. doi: 10.1371/journal.pone.0050564.
- Pang C., Huang G., Luo K. et al. miR-206 inhibits the growth of hepatocellular carcinoma cells via targeting CDK9. Cancer Med. 2017 Oct. 6(10). 2398-2409. doi: 10.1002/cam4.1188.
- Peng C., Wang H., Zhang W.J. et al. Inhibitory effect of –miR-125b on hepatitis C virus core protein-induced TLR2/MyD88 signaling in THP-1 cells. World J. Gastroenterol. 2016 May 7. 22(17). 4354-61. doi: 10.3748/wjg.v22.i17.4354.
- Pieters B.C., Arntz O.J., Bennink M.B. et al. Commercial cow milk contains physically stable extracellular vesicles expressing immunoregulatory TGF-β. PLoS One. 2015 Mar 30. 10(3). e0121123. doi: 10.1371/journal.pone.0121123.
- Rao Z.Z., Zhang X.W., Ding Y.L. et al. miR-148a-mediated estrogen-induced cholestasis in intrahepatic cholestasis of pregnancy: Role of PXR/MRP3. PLoS One. 2017 Jun 2. 12(6). e0178702. doi: 10.1371/journal.pone.0178702.
- Rubio M., Bustamante M., Hernandez-Ferrer C. et al. Circula–ting miRNAs, isomiRs and small RNA clusters in human plasma and breast milk. PLoS One. 2018 Mar 5. 13(3). e0193527. doi: 10.1371/journal.pone.0193527.
- Simpson M.R., Brede G., Johansen J. et al. Human Breast Milk miRNA, Maternal Probiotic Supplementation and Atopic Dermatitis in Offspring. PLoS One. 2015 Dec 14. 10(12). e0143496. doi: 10.1371/journal.pone.0143496.
- Sun Y.M., Lin K.Y., Chen Y.Q. Diverse functions of miR-125 family in different cell contexts. J. Hematol. Oncol. 2013 Jan 15. 6. 6. doi: 10.1186/1756-8722-6-6.
- Taïbi F., Metzinger-Le Meuth V., Massy Z.A., Metzinger L. miR-223: An inflammatory oncomiR enters the cardiovascular field. Biochim. Biophys. Acta. 2014 Jul. 1842(7). 1001-9. doi: 10.1016/j.bbadis.2014.03.005.
- Takagi S., Nakajima M., Mohri T., Yokoi T. Post-transcriptional regulation of human pregnane X receptor by micro-RNA affects the expression of cytochrome P450 3A4. J. Biol. Chem. 2008 Apr 11. 283(15). 9674-80. doi: 10.1074/jbc.M709382200.
- Title A.C., Denzler R., Stoffel M. Uptake and Function Studies of Maternal Milk-derived MicroRNAs. J. Biol. Chem. 2015 Sep 25. 290(39). 23680-91. doi: 10.1074/jbc.M115.676734.
- Wade B., Cummins M., Keyburn A., Crowley T.M. Isolation and detection of microRNA from the egg of chickens. BMC Res. Notes. 2016 May 23. 9. 283. doi: 10.1186/s13104-016-2084-5.
- Wang X., Gu H., Qin D. et al. Exosomal miR-223 Contributes to Mesenchymal Stem Cell-Elicited Cardioprotection in Polymicrobial Sepsis. Sci. Rep. 2015 Sep 8. 5. 13721. doi: 10.1038/srep13721.
- Weber J.A., Baxter D.H., Zhang S. et al. The microRNA spectrum in 12 body fluids. Clin. Chem. 2010 Nov. 56(11). 1733-41. doi: 10.1373/clinchem.2010.147405.
- Wojcicka A., Swierniak M., Kornasiewicz O. et al. Next generation sequencing reveals microRNA isoforms in liver cirrhosis and hepatocellular carcinoma. Int. J. Biochem. Cell. Biol. 2014 Aug. 53. 208-17. doi: 10.1016/j.biocel.2014.05.020.
- Xu Z., Zhao L., Yang X. et al. Mmu-miR-125b overexpression suppresses NO production in activated macrophages by targeting eEF2K and CCNA2. BMC Cancer. 2016 Mar 28. 16. 252. doi: 10.1186/s12885-016-2288-z.
- Yin H., Sun Y., Wang X. et al. Progress on the relationship between miR-125 family and tumorigenesis. Exp. Cell. Res. 2015 Dec 10. 339(2). 252-60. doi: 10.1016/j.yexcr.2015.09.015.
- Youness R.A., El-Tayebi H.M., Assal R.A. et al. MicroRNA-486-5p enhances hepatocellular carcinoma tumor suppression through repression of IGF-1R and its downstream mTOR, STAT3 and c-Myc. Oncol. Lett. 2016 Oct. 12(4). 2567-2573. doi: 10.3892/ol.2016.4914.
- Yu F., Chen B., Dong P., Zheng J. HOTAIR Epigenetically Modulates PTEN Expression via MicroRNA-29b: A Novel Mechanism in Regulation of Liver Fibrosis. Mol. Ther. 2017 Jan 4. 25(1). 205-217. doi: 10.1016/j.ymthe.2016.10.015.
- Zelber-Sagi S., Ivancovsky-Wajcman D., Fliss Isakov N. et al. High red and processed meat consumption is associated with non-alcoholic fatty liver disease and insulin resistance. J. Hepatol. 2018 Jun. 68(6). 1239-1246. doi: 10.1016/j.jhep.2018.01.015.
- Zempleni J., Sukreet S., Zhou F., Wu D., Mutai E. Milk-Derived Exosomes and Metabolic Regulation. Annu. Rev. Anim. Biosci. 2019 Feb 15. 7. 245-262. doi: 10.1146/annurev-animal-020518-115300.
- Zhang X., Yu L., Ding Y. Human leukocyte antigen G and miR-148a are associated with the pathogenesis of intrahepatic cholestasis of pregnancy. Exp. Ther. Med. 2014 Dec. 8(6). 1701-1706. doi: 10.3892/etm.2014.1986.
- Zhou Q., Li M., Wang X. et al. Immune-related microRNAs are abundant in breast milk exosomes. Int. J. Biol. Sci. 2012. 8(1). 118-23. doi:10.7150/ijbs.8.118.