Журнал «Здоровье ребенка» Том 18, №8, 2023
Вернуться к номеру
Медикаментозна регуляція мікроРНК
Авторы: Абатуров О.Є., Бабич В.Л.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
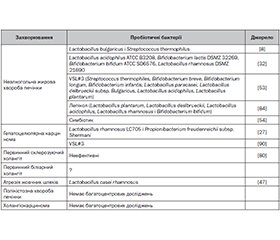
У науковому огляді наведено механізми медикаметозної регуляції мікроРНК в організмі людини. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MEDLINE, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library. Зазначено, що для відновлення зниженої функціональної активності мікроРНК застосовують замісну терапію, використовуючи модифіковані синтетичні аналоги ендогенних мікроРНК і лікарські засоби, що підсилюють продукцію власних мікроРНК організму. Автори підкреслюють, що численні дослідження підтвердили ефективність мікроРНК-замісної терапії. Відомо, що серед інгібіторів мікроРНК виділяють кілька груп лікарських засобів: антимікроРНК-олігонуклеотиди, мікроРНК-пастки, імітатори мікроРНК, які запобігають зв’язуванню мікроРНК; пептидо-нуклеїнові кислоти, інгібітори малих молекул. Автори показують, що експресія ферментів, які метаболізують лікарські засоби, контролюється регуляцією транскрипції ядерними рецепторами і факторами транскрипції, епігенетичною регуляцією, такою як метилювання ДНК та ацетилювання гістонів, а також посттрансляційною модифікацією. Підкреслено, що урсодезоксихолева кислота модулює експресію деяких мікроРНК. Відомо, що й пробіотичні бактерії мають здатність модулювати рівень експресії генів мікроРНК. Застосування пробіотиків супроводжується зміною експресії численних генів організму, що беруть участь у регуляції запальної відповіді, алергічних реакцій, обміну речовин та інших біологічних процесів. Отже, у сучасній науці інтенсивно вивчається потенціал використання лікарських засобів, що відновлюють вміст мікроРНК або інгібують активність мікроРНК для терапії мікроРНК-залежних станів. Результати наукових досліджень підтвердили терапевтичний ефект урсодезоксихолевої кислоти й пробіотичних препаратів через вплив на активність генерації мікроРНК при захворюваннях гепатобіліарної системи. Отже, упровадження в клінічну практику лікарських засобів, що мають здатність модулювати вміст та експресію конкретних мікроРНК, безумовно, відкриє нові перспективи в лікуванні хворих із захворюваннями гепатобіліарної системи.
The scientific review provides the mechanisms of drug regulation of microRNA in the human body. To write the article, information was searched using Scopus, Web of Science, MEDLINE, PubMed, Google Scholar, Embase, Global Health, The Cochrane Library databases. To restore the reduced functional activity of microRNAs, replacement therapy is used, with modified synthetic analogs of endogenous microRNAs, and drugs that enhance the production of the body’s own microRNAs. The authors state that numerous studies have confirmed the effectiveness of miRNA replacement therapy. It is known that there are several groups of drugs among miRNA inhibitors: anti-miRNA oligonucleotides, miRNA traps, miRNA mimics that prevent miRNA binding; peptide nucleic acids, small-molecule inhibitors. The authors suggest that the expression of drug-metabolizing enzymes is controlled by nuclear receptors and transcription factors, epigenetic regulation such as DNA methylation and histone acetylation, and post-translational modification. It is emphasized that ursodeoxycholic acid modulates the expression of some miRNAs. It is known that probiotic bacteria can modulate the expression level of miRNA genes. The use of probiotics is accompanied by a change in the expression of numerous genes of the body involved in the regulation of the inflammatory response, allergic reactions, metabolism and other biological processes. Thus, modern science is intensively studying the potential of using drugs that restore miRNA content or inhibit miRNA activity for the therapy of miRNA-dependent conditions. The results of scientific research confirmed the therapeutic effect of ursodeoxycholic acid and probiotic preparations due to the effect on the activity of miRNA generation in hepatobiliary diseases. Therefore, the introduction into clinical practice of drugs than can modulate the content and expression of specific miRNAs will certainly open new perspectives in the treatment of patients with hepatobiliary diseases.
мікроРНК; мімікратори мікроРНК; антимікроРНК-олігонуклеотиди; мікроРНК-пастки; інгібуючі імітатори мікроРНК; урсодезоксихолева кислота; пробіотичні препарати; гепатобіліарна система; огляд
microRNA; miRNA; miR; miR mimics; anti-miRNA oligonucleotides; miRNA sponges; miR masking; ursodeoxycholic acid; probiotic preparations; hepatobiliary system; review
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Абатуров О.Є., Бабич В.Л. Ефективність застосування урсодезоксихолевої кислоти при лікування функціональних розладів жовчного міхура та сфінктера Одді в дітей. Світ медицини та біології. 2019. 1(67). 7-11. doi: 10.26724/2079-8334-2019-1-67-7.
- Абатуров О.Є., Бабич В.Л. Медикаментозна модуляція активності генерації мікроРНК при функціональних розладах жовчного міхура та сфінктера Одді в дітей. Здоров’я дитини. 2019. 2(14). 53-59. doi: 10.22141/2224-0551.14.2.2019.165544.
- Абатуров О.Є., Бабич В.Л., Бондаренко Н.С., Бондаренко О.О., Лєвих А.Е., Твердохліб І.В. Морфологічний аналіз впливу урсодезоксихолевої кислоти на м’язову оболонку стінки жовчного міхура мишей. Морфологія. 2020. 2(14). 7-16. doi: 10.26641/1997-9665.2020.2.7-16.
- Абатуров О.Є., Бабич В.Л., Твердохліб І.В. Ультраструктурна характеристика інтерстиційних клітин Кахаля м’язової оболонки стінки жовчного міхура при експериментальному дослідженні мишей під впливом урсодезоксихолевої кислоти. Морфологія. 2020. 3(14). 9-14. doi: 10.26641/1997-9665.2020.3.9-14.
- Абатуров О.Є., Твердохліб І.В., Бабич В.Л., Русакова О.О. Вплив холеретичної терапії на активність експресії мікроРНК-378f та м’язову оболонку стінки жовчного міхура. Сучасна педіатрія. 2022. 5(125). 26-34. doi: 10.15574/SP.2022.125.26.
- Abaturov A.E., Babych V.L. Influence of choleretic therapy on the microRNA-4714-3p expression level in children with functional disorders of the gallbladder and Оddi’s sphincter. Medical perspectives. 2019. 24(4). 43-50. doi: 10.26641/2307-0404.2019.4.189196.
- Abaturov A.E., Vysochyna I.L., Babych V.L., Dosenko V.E. Regulation of microRNA expression level by choleretic therapy in functional disorders of the gallbladder and Оddi’s sphincter in children. Wiadomości Lekarskie. 2020. 73(1). 41-45. doi: 10.36740/WLek202001107.
- Aller R., De Luis D.A., Izaola O. et al. Effect of a probiotic on liver aminotransferases in nonalcoholic fatty liver disease patients: a double blind randomized clinical trial. Eur. Rev. Med. Pharmacol. Sci. 2011 Sep. 15(9). 1090-5. PMID: 22013734.
- Alpini G., Baiocchi L., Glaser S. et al. Ursodeoxycholate and tauroursodeoxycholate inhibit cholangiocyte growth and secretion of BDL rats through activation of PKC alpha. Hepatology. 2002 May. 35(5). 1041-52. doi: 10.1053/jhep.2002.32712.
- Antsypovich S.I. Peptide Nucleic Acids: Structure, Properties, Applications, Strategies and Practice of Chemical Synthesis. Advances in Chemistry. 2002. 71(1). 81-96.
- Bader A.G. miR-34 — a microRNA replacement therapy is headed to the clinic. Front. Genet. 2012 Jul 2. 3. 120. doi: 10.3389/fgene.2012.00120.
- Bak R.O., Mikkelsen J.G. miRNA sponges: soaking up miRNAs for regulation of gene expression. Wiley Interdiscip Rev. RNA. 2014 May-Jun. 5(3). 317-33. doi: 10.1002/wrna.1213.
- Barta T., Peskova L., Hampl A. miRNAsong: a web-based tool for generation and testing of miRNA sponge constructs in silico. Sci. Rep. 2016 Nov 18. 6. 36625. doi: 10.1038/srep36625.
- Beg M.S., Brenner A.J., Sachdev J. et al. Phase I study of MRX34, a liposomal miR-34a mimic, administered twice weekly in patients with advanced solid tumors. Invest. New Drugs. 2017 Apr. 35(2). 180-188. doi: 10.1007/s10637-016-0407-y.
- Bernardo B.C., Ooi J.Y., Lin R.C., McMullen J. miRNA therapeutics: a new class of drugs with potential therapeutic applications in the heart. Future Med. Chem. 2015. 7(13).1771-92. doi: 10.4155/fmc.15.107.
- Bodeа N., Grebeb A., Kerksiekc А. et al. Ursodeoxycholic acid impairs atherogenesis and promotes plaque regression by cholesterol crystal dissolution in mice. Biochem. Biophys. Res. Commun. 2016 Sep 9. 478(1). 356-362. doi: 10.1016/j.bbrc.2016.07.047.
- Bose D., Jayaraj G., Suryawanshi H. et al. The tuberculosis drug streptomycin as a potential cancer therapeutic: inhibition of miR-21 function by directly targeting its precursor. Angew Chem. Int. Ed. Engl. 2012 Jan 23. 51(4). 1019-23. doi: 10.1002/anie.201106455.
- Brandi G., De Lorenzo S., Candela M. et al. Microbiota, NASH, HCC and the potential role of probiotics. Carcinogenesis. 2017 Mar 1. 38(3). 231-240. doi: 10.1093/carcin/bgx007.
- Brognara E., Fabbri E., Bianchi N. et al. Molecular methods for validation of the biological activity of peptide nucleic acids targeting microRNAs. Methods Mol. Biol. 2014. 1095. 165-76. doi: 10.1007/978-1-62703-703-7_14.
- Castro R.E., Ferreira D.M.S., Zhang X., Borralho P.M. et al. Identification of microRNAs during rat liver regeneration after partial hepatectomy and modulation by ursodeoxycholic acid. Am. J. Physiol. Gastrointest. Liver Physiol. 2010 Oct. 299(4). G887-97. doi: 10.1152/ajpgi.00216.2010.
- Castro R.E., Ferreira D.M.S., Afonso M.B., Borralho P.M. et al. miR-34a/SIRT1/p53 is suppressed by ursodeoxycholic acid in the rat liver and activated by disease severity in human non-alcoholic fatty liver disease. J. Hepatol. 2013 Jan. 58(1). 119-25. doi: 10.1016/j.jhep.2012.08.008.
- Chao J., Guo Y., Li P., Chao L. Role of Kallistatin Treatment in Aging and Cancer by Modulating miR-34a and miR-21 Expression. Oxid. Med. Cell. Longev. 2017. 2017. 5025610. doi: 10.1155/2017/5025610.
- Chen Q., Tong C., Ma S. et al. Involvement of MicroRNAs in Probiotics-Induced Reduction of the Cecal Inflammation by Salmonella Typhimurium. Front. Immunol. 2017 Jun 13. 8. 704. doi: 10.3389/fimmu.2017.00704.
- Choi W.Y., Giraldez A.J., Schier A.F. Target protectors reveal dampening and balancing of Nodal agonist and antagonist by miR-430. Science. 2007 Oct 12. 318(5848). 271-4. doi: 10.1126/science.1147535.
- Daige C.L., Wiggins J.F., Priddy L. et al. Systemic delivery of a miR34a mimic as a potential therapeutic for liver cancer. Mol. Cancer Ther. 2014 Oct. 13(10). 2352-60. doi: 10.1158/1535-7163.MCT-14-0209.
- Davies B.P., Arenz C. A homogenous assay for micro RNA maturation. Angew Chem. Int. Ed. Engl. 2006 Aug 18. 45(33). 5550-2. doi: 10.1002/anie.200601332.
- de Moreno de LeBlanc A., Matar C., Perdigón G. The application of probiotics in cancer. Br. J. Nutr. 2007 Oct. 98 Suppl. 1. S105-10. Doi: 10.1017/S0007114507839602.
- Demont A., Hacini-Rachinel F., Doucet-Ladevèze R. et al. Live and heat-treated probiotics differently modulate IL10 mRNA stabilization and microRNA expression. J. Allergy Clin. Immunol. 2016 Apr. 137(4). 1264-1267.e10. doi: 10.1016/j.jaci.2015.08.033.
- Ebert M.S., Neilson J.R., Sharp P.A. MicroRNA sponges: competitive inhibitors of small RNAs in mammalian cells. Nat. Methods. 2007 Sep. 4(9). 721-6. doi: 10.1038/nmeth1079.
- Ebert M.S., Sharp P.A. Emerging roles for natural microRNA sponges. Curr. Biol. 2010 Oct 12. 20(19). R858-61. doi: 10.1016/j.cub.2010.08.052.
- Fabani M.M., Gait M.J. miR-122 targeting with LNA/2’-O-methyl oligonucleotide mixmers, peptide nucleic acids (PNA), and PNA-peptide conjugates. RNA. 2008 Feb. 14(2). 336-46. doi: 10.1261/rna.844108.
- Famouri F., Shariat Z., Hashemipour M. et al. Effects of Probiotics on Nonalcoholic Fatty Liver Disease in Obese Children and Adolescents. J. Pediatr. Gastroenterol. Nutr. 2017 Mar. 64(3). 413-417. doi: 10.1097/MPG.0000000000001422.
- Feng Q., Chen W.D., Wang Y.D. Gut Microbiota: An Integral Moderator in Health and Disease. Front Microbiol. 2018 Feb 21. 9. 151. doi: 10.3389/fmicb.2018.00151.
- Fong F.L., Shah N.P., Kirjavainen P., El-Nezami H. Mechanism of Action of Probiotic Bacteria on Intestinal and Systemic Immunities and Antigen-Presenting Cells. Int. Rev. Immunol. 2016 May 3. 35(3). 179-88. doi: 10.3109/08830185.2015.1096937.
- Gambari R., Brognara E., Spandidos D.A., Fabbri E. Targeting oncomiRNAs and mimicking tumor suppressor miRNAs: Νew trends in the development of miRNA therapeutic strategies in oncology. Int. J. Oncol. 2016 Jul. 49(1). 5-32. doi: 10.3892/ijo.2016.3503.
- Giahi L., Aumueller E., Elmadfa I., Haslberger A.G. Regulation of TLR4, p38 MAPkinase, IκB and miRNAs by inactivated strains of lactobacilli in human dendritic cells. Benef. Microbes. 2012 Jun 1. 3(2). 91-8. doi: 10.3920/BM2011.0052.
- Grijalvo S., Alagia A., Jorge A.F., Eritja R. Covalent Strategies for Targeting Messenger and Non-Coding RNAs: An Updated Review on siRNA, miRNA and antimiR Conjugates. Genes (Basel). 2018 Feb 6. 9(2). pii: E74. doi: 10.3390/genes9020074.
- Gumireddy K., Young D.D., Xiong X. et al. Small-molecule inhibitors of microrna miR-21 function. Angew Chem. Int. Ed. Engl. 2008. 47(39). 7482-4. doi: 10.1002/anie.200801555.
- Hammes T.O., Leke R., Escobar T.D.C. et al. Lactobacillus rhamnosusGG reduces hepatic fibrosis in a model of chronic liver disease in rats. Nutr. Hosp. 2017 Jun 5. 34(3). 702-709. doi: 10.20960/nh.626.
- Haraguchi T., Ozaki Y., Iba H. Vectors expressing efficient RNA decoys achieve the long-term suppression of specific microRNA activity in mammalian cells. Nucleic Acids Res. 2009 Apr. 37(6). e43. doi: 10.1093/nar/gkp040.
- Huang R., Ning H., Shen M. et al. Probiotics for the Treatment of Atopic Dermatitis in Children: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Front. Cell. Infect. Microbiol. 2017 Sep 6. 7. 392. doi: 10.3389/fcimb.2017.00392.
- Janssen H.L., Reesink H.W., Lawitz E.J. et al. Treatment of HCV infection by targeting microRNA. N. Engl. J. Med. 2013 May 2. 368(18). 1685-94. doi: 10.1056/NEJMoa1209026.
- Katsushima F., Takahashi A., Sakamoto N., Kanno Y., Abe K., Ohira H. Expression of micro-RNAs in peripheral blood mononuclear cells from primary biliary cirrhosis patients. Hepatology Research. 2014. 44(10). E189-E197. DOI: 10.1111/hepr.12198.
- Kluiver J., Slezak-Prochazka I., Smigielska-Czepiel K. et al. Generation of miRNA sponge constructs. Methods. 2012 Oct. 58(2). 113-7. doi: 10.1016/j.ymeth.2012.07.019.
- Krishnan P., Damaraju S. The Challenges and Opportunities in the Clinical Application of Noncoding RNAs: The Road Map for miRNAs and piRNAs in Cancer Diagnostics and Prognostics. Int. J. Genomics. 2018 Apr 30. 2018. 5848046. doi: 10.1155/2018/5848046.
- Lennox K.A., Behlke M.A. A direct comparison of anti-micro–RNA oligonucleotide potency. Pharm. Res. 2010 Sep. 27(9). 1788-99. doi: 10.1007/s11095-010-0156-0.
- Lien T.H., Bu L.N., Wu J.F. et al. Use of Lactobacillus casei rhamnosus to Prevent Cholangitis in Biliary Atresia After Kasai Operation. J. Pediatr. Gastroenterol. Nutr. 2015 May. 60(5). 654-8. doi: 10.1097/MPG.0000000000000676.
- Lima J.F., Cerqueira L., Figueiredo C. et al. Anti-miRNA oligonucleotides: A comprehensive guide for design. RNA Biol. 2018 Mar 4. 15(3). 338-352. doi: 10.1080/15476286.2018.1445959.
- Lindow M., Kauppinen S. Discovering the first microRNA-targeted drug. J. Cell. Biol. 2012 Oct 29. 199(3). 407-12. doi: 10.1083/jcb.201208082.
- Llewellyn A., Foey A. Probiotic Modulation of Innate Cell Pathogen Sensing and Signaling Events. Nutrients. 2017 Oct 23. 9(10). pii: E1156. doi: 10.3390/nu9101156.
- Lu T.X., Rothenberg M.E. Diagnostic, functional, and therapeutic roles of microRNA in allergic diseases. J. Allergy. Clin. Immunol. 2013 Jul. 132(1). 3-13. quiz 14. doi: 10.1016/j.jaci.2013.04.039.
- Marchelli R., Corradini R., Manicardi A. et al. Gene Modulation by Peptide Nucleic Acids (PNAs) Targeting microRNAs (miRs). In: You Y., editor. Targets in Gene Therapy. Rijeka: InTech; 2011. p. Ch. 02.
- Miccheli A., Capuani G., Marini F. et al. Urinary (1)H-NMR-based metabolic profiling of children with NAFLD undergoing VSL#3 treatment. Int. J. Obes. (Lond.). 2015 Jul. 39(7). 1118-25. doi: 10.1038/ijo.2015.40.
- Mofidi F., Poustchi H., Yari Z. et al. Synbiotic supplementation in lean patients with non-alcoholic fatty liver disease: a pilot, randomised, double-blind, placebo-controlled, clinical trial. Br. J. Nutr. 2017 Mar. 117(5). 662-668. doi: 10.1017/S0007114517000204.
- Monroig Pdel C., Chen L., Zhang S., Calin G.A. Small molecule compounds targeting miRNAs for cancer therapy. Adv. Drug Deliv. Rev. 2015 Jan. 81. 104-16. doi: 10.1016/j.addr.2014.09.002.
- Murakami K., Miyagishi M. Tiny masking locked nucleic acids effectively bind to mRNA and inhibit binding of microRNAs in relation to thermodynamic stability. Biomed. Rep. 2014 Jul. 2(4). 509-512.
- Nakano M., Nakajima M. Current knowledge of microRNA-mediated regulation of drug metabolism in humans. Expert Opin. Drug Metab. Toxicol. 2018 May. 14(5). 493-504. doi: 10.1080/17425255.2018.1472237.
- Naro Y., Thomas M., Stephens M.D. et al. Aryl amide small-molecule inhibitors of microRNA miR-21 function. Bioorg. Med. Chem. Lett. 2015 Nov 1. 25(21). 4793-4796. doi: 10.1016/j.bmcl.2015.07.016.
- Ottosen S., Parsley T.B., Yang L. et al. In vitro antiviral acti–vity and preclinical and clinical resistance profile of miravirsen, a novel anti-hepatitis C virus therapeutic targeting the human factor miR-122. Antimicrob. Agents Chemother. 2015 Jan. 59(1). 599-608. doi: 10.1128/AAC.04220-14.
- Panduru M., Panduru N.M., Sălăvăstru C.M., Tiplica G.S. Probiotics and primary prevention of atopic dermatitis: a meta-analysis of randomized controlled studies. J. Eur. Acad. Dermatol. Venereol. 2015 Feb. 29(2). 232-42. doi: 10.1111/jdv.12496.
- Pearson T., Caporaso J.G., Yellowhair M., Martinez J.A. et al. Abstract A18: Gut microbiota changes in response to treatment with ursodeoxycholic acid (UDCA). Cancer research. 2017. CRC16-A18. doi: 10.1158/1538-7445.
- Pelucchi C., Chatenoud L., Turati F. et al. Probiotics supplementation during pregnancy or infancy for the prevention of atopic dermatitis: a meta-analysis. Epidemiology. 2012 May. 23(3). 402-14. doi: 10.1097/EDE.0b013e31824d5da2.
- Plaza-Díaz J., Ruiz-Ojeda F.J., Gil-Campos M., Gil A. Immune-Mediated Mechanisms of Action of Probiotics and Synbiotics in Treating Pediatric Intestinal Diseases. Nutrients. 2018 Jan 5. 10(1). pii: E42. doi: 10.3390/nu10010042.
- Quijano E., Bahal R., Ricciardi A. et al. Therapeutic Peptide Nucleic Acids: Principles, Limitations, and Opportunities. Yale J. Biol. Med. 2017 Dec 19. 90(4). 583-598.
- Rockey D.C. Translating an understanding of the pathogenesis of hepatic fibrosis to novel therapies. Clin. Gastroenterol. Hepatol. 2013 Mar. 11(3). 224-31.e1-5. doi: 10.1016/j.cgh.2013.01.005.
- Rodrigues P.M., Afonso M.B., Simão A.L. miR-21 ablation and obeticholic acid ameliorate nonalcoholic steatohepatitis in mice. Cell. Death Dis. 2017. 8(4). e2748. doi: 10.1038/cddis.2017.172.
- Rodríguez-Nogales A., Algieri F., Garrido-Mesa J. et al. The Administration of Escherichia coli Nissle 1917 Ameliorates Development of DSS-Induced Colitis in Mice. Front. Pharmacol. 2018 May 11. 9. 468. doi: 10.3389/fphar.2018.00468.
- Sabharwal H., Cichon C., Ölschläger T.A. et al. Interleukin-8, CXCL1, and MicroRNA miR-146a Responses to Probiotic Escherichia coli Nissle 1917 and Enteropathogenic E. coli in Human Intestinal Epithelial T84 and Monocytic THP-1 Cells after Apical or Basolateral Infection. Infect. Immun. 2016 Aug 19. 84(9). 2482-92. doi: 10.1128/IAI.00402-16.
- Sakamoto T., Morishita A., Nomura T., Tani J., Miyoshi H. et al. Identification of microRNA profiles associated with refractory primary biliary cirrhosis. Mol. Med. Rep. 2016 Oct. 14(4). 3350-6. doi:10.3892/mmr.2016.5606.
- Sarver A.L., Subramanian S. Competing endogenous RNA database. Bioinformation. 2012. 8(15). 731-3. doi: 10.6026/97320630008731.
- Sayed D., Rane S., Lypowy J. et al. MicroRNA-21 targets Sprouty2 and promotes cellular outgrowths. Mol. Biol. Cell. 2008 Aug. 19(8). 3272-82. doi: 10.1091/mbc.E08-02-0159.
- Schmidt M.F. Drug target miRNAs: chances and challenges. Trends Biotechnol. 2014 Nov. 32(11). 578-585. doi: 10.1016/j.tibtech.2014.09.002.
- Sen R., Ghosal S., Das S. et al. Competing endogenous RNA: the key to posttranscriptional regulation. ScientificWorldJournal. 2014 Feb 2. 2014. 896206. doi: 10.1155/2014/896206.
- Shah M.Y., Ferrajoli A., Sood A.K. et al. microRNA Therapeutics in Cancer — An Emerging Concept. EBioMedicine. 2016 Oct. 12. 34-42. doi: 10.1016/j.ebiom.2016.09.017.
- Shan G., Li Y., Zhang J., Li W. et al. A small molecule enhances RNA interference and promotes microRNA processing. Nat. Biotechnol. 2008 Aug. 26(8). 933-40. doi: 10.1038/nbt.1481.
- Simonson B., Das S. MicroRNA Therapeutics: the Next Magic Bullet? Mini Rev. Med. Chem. 2015. 15(6). 467-74. doi: 10.2174/1389557515666150324123208.
- Simpson M.R., Brede G., Johansen J. et al. Human Breast Milk miRNA, Maternal Probiotic Supplementation and Atopic Dermatitis in Offspring. PLoS One. 2015 Dec 14. 10(12). e0143496. doi: 10.1371/journal.pone.0143496.
- Titze-de-Almeida R., David C., Titze-de-Almeida S.S. The Race of 10 Synthetic RNAi-Based Drugs to the Pharmaceutical Market. Pharm. Res. 2017 Jul. 34(7). 1339-1363. doi: 10.1007/s11095-017-2134-2.
- van Rooij E., Purcell A.L., Levin A.A. Developing microRNA therapeutics. Circ. Res. 2012 Feb 3. 110(3). 496-507. doi: 10.1161/CIRCRESAHA.111.247916.
- Vleggaar F.P., Monkelbaan J.F., van Erpecum K.J. Probiotics in primary sclerosing cholangitis: a randomized placebo-controlled crossover pilot study. Eur. J. Gastroenterol. Hepatol. 2008 Jul. 20(7). 688-92. doi: 10.1097/MEG.0b013e3282f5197e.
- Wan M.L.Y., El-Nezami H. Targeting gut microbiota in hepatocellular carcinoma: probiotics as a novel therapy. Hepatobiliary Surg. Nutr. 2018 Feb. 7(1). 11-20. doi: 10.21037/hbsn.2017.12.07.
- Wang Z. The principles of MiRNA-masking antisense oligonucleotides technology. Methods Mol. Biol. 2011. 676. 43-9. doi: 10.1007/978-1-60761-863-8_3.
- Williams M.R., Stedtfeld R.D., Tiedje J.M., Hashsham S.A. MicroRNAs-Based Inter-Domain Communication between the Host and Members of the Gut Microbiome. Front. Microbiol. 2017 Sep 27. 8. 1896. doi: 10.3389/fmicb.2017.01896.
- Wong V.W., Won G.L., Chim A.M. et al. Treatment of nonalcoholic steatohepatitis with probiotics. A proof-of-concept study. Ann. Hepatol. 2013 Mar-Apr. 12(2). 256-62. PMID: 23396737.
- Xia T., Li J., Cheng H. et al. Small-Molecule Regulators of MicroRNAs in Biomedicine. Drug Dev. Res. 2015 Nov. 76(7). 375-81. doi: 10.1002/ddr.21271.].
- Xiao Z., Li C.H., Chan S.L. et al. A small-molecule modulator of the tumor-suppressor miR34a inhibits the growth of hepatocellular carcinoma. Cancer Res. 2014 Nov 1. 74(21). 6236-47. doi: 10.1158/0008-5472.CAN-14-0855.
- Xu G., Zhang Y., Wei J. et al. MicroRNA-21 promotes hepatocellular carcinoma HepG2 cell proliferation through repression of mitogen-activated protein kinase-kinase 3. BMC Cancer. 2013 Oct 10. 13. 469. doi: 10.1186/1471-2407-13-469.
- Yang H.S., Jansen A.P., Nair R., Shibahara K., Verma A.K., Cmarik J.L., Colburn N.H. A novel transformation suppressor, Pdcd4, inhibits AP-1 transactivation but not NF-kappaB or ODC transactivation. Oncogene. 2001. 20. 669-676. doi: 10.1038/sj.onc.1204137.
- Young D.D., Connelly C.M., Grohmann C., Deiters A. Small molecule modifiers of microRNA miR-122 function for the treatment of hepatitis C virus infection and hepatocellular carcinoma. J. Am. Chem. Soc. 2010 Jun 16. 132(23). 7976-81. doi: 10.1021/ja910275u.
- Zhang H.L., Yu L.X., Yang W. et al. Profound impact of gut homeostasis on chemically-induced pro-tumorigenic inflammation and hepatocarcinogenesis in rats. J. Hepatol. 2012 Oct. 57(4). 803-12. doi: 10.1016/j.jhep.2012.06.011.
- Zhao H., Zhao C., Dong Y. et al. Inhibition of miR122a by Lactobacillus rhamnosus GG culture supernatant increases intestinal occludin expression and protects mice from alcoholic liver disease. Toxicol. Lett. 2015 May 5. 234(3). 194-200. doi: 10.1016/j.toxlet.2015.03.002.