Международный эндокринологический журнал Том 20, №1, 2024
Вернуться к номеру
Постковідний синдром: стан вуглеводного обміну у пацієнтів з артеріальною гіпертензією і стабільною ішемічною хворобою серця
Авторы: Курята О.В., Митрохіна О.С., Кушнір Ю.С., Стаднік О.І.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
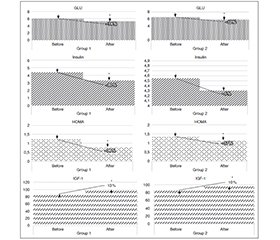
Актуальність. Постковідний синдром пов’язаний із широким спектром хронічних симптомів або станів. COVID-19 викликає метаболічні порушення, як-от гіперглікемія, інсулінорезистентність. Інсуліноподібний фактор росту-1 (ІФР-1) пов’язаний з порушенням толерантності до глюкози та вищим ризиком розвитку цукрового діабету 2-го типу. На сьогодні актуальним є вивчення молекул регуляції вуглеводного обміну як потенційних біомаркерів постковідного синдрому та мішеней для терапевтичного впливу. Мета дослідження: вивчення рівня ІФР-1 та його зв’язку із регуляцією вуглеводного обміну, а також динаміки оцінюваних показників під впливом медикаментозного лікування у пацієнтів з артеріальною гіпертензією та стабільною ішемічною хворобою серця, які перенесли COVID-19. Матеріали та методи. У дослідження включено 55 хворих, середній вік — 55,87 [40; 75] року, які перенесли COVID-19 легкого та середнього ступенів тяжкості. Реєстрували та аналізували результати рутинних лабораторних досліджень. Імуноферментним аналізом визначали вміст інсуліну та ІФР-1. Розраховували індекс НОМА. Результати. У пацієнтів із середнім ступенем COVID-19 порівняно з легким виявлено вірогідне зниження рівня ІФР-1 (р = 0,008) на тлі перевищення референтних значень показників глюкози, інсуліну та НОМА (р < 0,01). Виявлено вплив ступеня АГ на рівень ІФР-1 (р = 0,004). Виявлено зворотний зв’язок між показником ІФР-1 та рівнем глюкози (r = –0,28, р = 0,034). Використання мельдонію сприяло вірогідному зменшенню рівнів глюкози та інсуліну (p < 0,001), збільшенню показника ІФР-1. На фоні прийому мельдонію була більш суттєвою динаміка зсуву в бік зменшення індексу HOMA. Висновки. Виявлено зворотний взаємозв’язок ІФР-1 з глюкозою крові незалежно від рівня інсуліну та НОМА у хворих з АГ та стабільною ІХС у постковідному періоді. Мельдоній продемонструв поліпшення вуглеводного обміну шляхом нормалізації рівня інсуліну та зменшення явищ інсулінорезистентності як потенційної мішені медикаментозного впливу. Препарат сприяв поліпшенню клінічного перебігу ІХС у пацієнтів та продемонстрував добру переносимість і безпеку.
Background. Post-COVID syndrome is associated with a wide range of chronic symptoms or conditions. Coronavirus disease 2019 (COVID-19) causes metabolic disorders such as hyperglycemia, insulin resistance. Insulin-like growth factor 1 (IGF-1) is associated with an impaired glucose tolerance and a higher risk of developing type 2 diabetes. Currently, the study of molecules regulating carbohydrate metabolism as potential biomarkers of post-COVID syndrome and targets for therapeutic influence is relevant. The purpose of the study was to assess the level of IGF-1 and its relationship with regulation of carbohydrate metabolism, as well as the dynamics of the evaluated indicators under the influence of drug treatment in patients with hypertension and stable coronary heart disease who suffered from COVID-19. Materials and methods. Fifty-five patients who had a mild and moderate COVID-19 were included in the study; their average age was 55.87 [40; 75] years. The results of routine laboratory tests were registered and analyzed. The content of insulin and IGF-1 was assessed by enzyme immunoassay. The HOMA-IR was calculated. Results. In patients with a moderate COVID-19 compared to those with a mild one, a significant decrease in the level of IGF-1 (р = 0.008) was found against the background of increased reference values of glucose, insulin, and HOMA-IR (р < 0.01). The influence of the degree of hypertension on the IGF-1 level was revealed (р = 0.004). An inverse relationship between IGF-1 and glucose level was noted (r = –0.28, p = 0.034). The use of meldonium contributed to a significant decrease in glucose and insulin content (p < 0.001), and an increase in IGF-1. Against the background of taking meldonium, the dynamics of the shift towards a decrease in the HOMA-IR was more significant. Conclusions. An inverse relationship was found between IGF-1 and blood glucose, regardless of the level of insulin and HOMA-IR, in patients with hypertension and stable ischemic heart disease in the post-COVID period. Meldonium has been shown to improve carbohydrate metabolism by normalizing insulin levels and reducing the phenomena of insulin resistance as a potential drug target. Meldonium improved the clinical course of ischemic heart disease and demonstrated good tolerability and safety.
постковідний синдром; артеріальна гіпертензія; ішемічна хвороба серця; мельдоній; вуглеводний обмін; інсуліноподібний фактор росту-1
post-COVID syndrome; hypertension; ischemic heart disease; meldonium; carbohydrate metabolism; insulin-like growth factor 1
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Pierce J.D., Shen Q., Cintron S.A., Hiebert J.B. Post-COVID-19 Syndrome. Nurs Res. 2022 Mar-Apr 01. 71(2). 164-174. doi: 10.1097/NNR.0000000000000565. PMID: 34653099.
- Yong S.J. Long COVID or post-COVID-19 syndrome: putative pathophysiology, risk factors, and treatments. Infect. Dis. (Lond.). 2021 Oct. 53(10). 737-754. doi: 10.1080/23744235.2021.1924397. Epub 2021 May 22. PMID: 34024217; PMCID: PMC8146298.
- Hallek M., Adorjan K., Behrends U., Ertl G., Suttorp N., Lehmann C. Post-COVID Syndrome. Dtsch Arztebl. Int. 2023 Jan 27. 120(4). 48-55. doi: 10.3238/arztebl.m2022.0409. PMID: 36633452; PMCID: PMC10060997.
- Carod-Artal F.J. Post-COVID-19 syndrome: epidemiology, diagnostic criteria and pathogenic mechanisms involved. Rev. Neurol. 2021 Jun 1. 72(11). 384-396. English, Spanish. doi: 10.33588/rn.7211.2021230. PMID: 34042167.
- Shin J., Toyoda S., Nishitani S., Onodera T., Fukuda S., Kita S. et al. SARS-CoV-2 infection impairs the insulin/IGF signaling pathway in the lung, liver, adipose tissue, and pancreatic cells via IRF1. Metabolism. 2022 Aug. 133. 155236. doi: 10.1016/j.metabol.2022.155236. Epub 2022 Jun 8. PMID: 35688210; PMCID: PMC9173833.
- Gerganova A., Assyov Y., Kamenov Z. Stress Hyperglycemia, Diabetes Mellitus and COVID-19 Infection: Risk Factors, Clinical Outcomes and Post-Discharge Implications. Front. Clin. Diabetes Healthc. 2022 Apr 7. 3. 826006 doi: 10.3389/fcdhc.2022.826006. PMID: 36992767; PMCID: PMC10012081.
- Pal R., Joshi A., Bhadada S.K., Banerjee M., Vaikkakara S., Mukhopadhyay S. Endocrine Follow-up During Post-Acute COVID-19: Practical Recommendations Based on Available Clinical Evidence. Endocr. Pract. 2022 Apr. 28(4). 425-432. doi: 10.1016/j.eprac.2022.02.003. Epub 2022 Feb 11. PMID: 35158058; PMCID: PMC8832848.
- Obradovic M., Zafirovic S., Soskic S., Stanimirovic J., Trpko–vic A., Jevremovic D. et al. Effects of IGF-1 on the Cardiovascular System. Curr. Pharm. Des. 2019. 25(35). 3715-3725. doi: 10.2174/1381612825666191106091507. PMID: 31692426.
- Friedrich N., Thuesen B., Jørgensen T., Juul A., Spielhagen C., Wallaschofksi H. et al. The association between IGF-I and insulin resistance: a general population study in Danish adults. Diabetes Care. 2012 Apr. 35(4). 768-73. doi: 10.2337/dc11-1833. Epub 2012 Feb 28. PMID: 22374641; PMCID: PMC3308317.
- Al-Samerria S., Radovick S. The Role of Insulin-like Growth Factor-1 (IGF-1) in the Control of Neuroendocrine Regulation of Growth. Cells. 2021 Oct 5. 10(10). 2664. doi: 10.3390/cells10102664. PMID: 34685644; PMCID: PMC8534318.
- Hazrati E., Gholami M., Farahani R.H., Ghorban K., Ghayomzadeh M., Rouzbahani N.H. The effect of IGF-1 plasma concentration on COVID-19 severity. Microb. Pathog. 2022 Mar. 164. 105416. doi: 10.1016/j.micpath.2022.105416. Epub 2022 Jan 26. PMID: 35092836; PMCID: PMC8789556.
- Nelke C., Dziewas R., Minnerup J., Meuth S.G., Ruck T. Skeletal muscle as potential central link between sarcopenia and immune senescence. EBioMedicine. 2019 Nov. 49. 381-388. doi: 10.1016/j.ebiom.2019.10.034. Epub 2019 Oct 26. PMID: 31662290; PMCID: PMC6945275.
- Aslanbeigi F., Rahimi H., Malekipour A., Pahlevani H., Najafizadeh M., Ehteram H. et al. Association between hypertension and clinical outcomes in COVID-19 patients: a case-controlled study. Ann. Med. Surg. (Lond.). 2023 Jun 17. 85(7). 3258-3263. doi: 10.1097/MS9.0000000000000391. PMID: 37427160; PMCID: PMC10328661.
- Suhail S., Zajac J., Fossum C., Lowater H., McCracken C., Severson N. et al. Role of Oxidative Stress on SARS-CoV (SARS) and SARS-CoV-2 (COVID-19) Infection: A Review. Protein J. 2020 Dec. 39(6). 644-656. doi: 10.1007/s10930-020-09935-8. Epub 2020 Oct 26. PMID: 33106987; PMCID: PMC7587547.
- Dambrova M., Makrecka-Kuka M., Vilskersts R., Makarova E., Kuka J., Liepinsh E. Pharmacological effects of meldonium: Biochemical mechanisms and biomarkers of cardiometabo–lic activity. Pharmacol. Res. 2016 Nov. 113(Pt B). 771-780. doi: 10.1016/–j.phrs.–2016.01.019. Epub 2016 Feb 2. PMID: 26850121.
- Görgens C., Guddat S., Dib J., Geyer H., Schänzer W., Thevis M. Mildronate (Meldonium) in professional sports — monitoring doping control urine samples using hydrophilic interaction liquid chromatography — high resolution/high accuracy mass spectrometry. Drug Test Anal. 2015 Nov-Dec. 7(11-12). 973-9. doi: 10.1002/dta.1788. Epub 2015 Apr 5. PMID: 25847280; PMCID: PMC5066279.
- Đurašević S., Ružičić A., Lakić I., Tosti T., Đurović S., Glumac S. et al. The Effects of a Meldonium Pre-Treatment on the Course of the LPS-Induced Sepsis in Rats. Int. J. Mol. Sci. 2022 Feb 21. 23(4). 2395. doi: 10.3390/ijms23042395. PMID: 35216510; PMCID: PMC8924897.
- Oronsky B., Larson C., Hammond T.C., Oronsky A., Kesari S., Lybeck M. et al. A Review of Persistent Post-COVID Syndrome (PPCS). Clin. Rev. Allergy Immunol. 2023 Feb. 64(1). 66-74. doi: 10.1007/s12016-021-08848-3. Epub 2021 Feb 20. PMID: 33609255; PMCID: PMC7896544.
- Pashkovska N., Pankiv V., Pashkovska O. COVID-19 and diabetes mellitus: management of patients during the pandemic. International Journal оf Endocrinology (Ukraine). 2020. 16(3). 180-184. https://doi.org/10.22141/2224-0721.16.3.2020.205264.
- Scherer P.E., Kirwan J.P., Rosen C.J. Post-acute sequelae of COVID-19: A metabolic perspective. Elife. 2022 Mar 23. 11. e78200. doi: 10.7554/eLife.78200. PMID: 35318939; PMCID: PMC8942467.
- Ghini V., Vieri W., Celli T., Pecchioli V., Boccia N., Alonso-Vásquez T. et al. COVID-19: A complex disease with a unique metabo–lic signature. PLoS Pathog. 2023 Nov 9. 19(11). e1011787. doi: 10.1371/journal.ppat.1011787. PMID: 37943960; PMCID: PMC10662774.
- Wang Z., Du Z., Zhu F. Glycosylated hemoglobin is associated with systemic inflammation, hypercoagulability, and prognosis of COVID-19 patients. Diabetes Res. Clin. Pract. 2020 Jun. 164. 108214. doi: 10.1016/j.diabres.2020.108214. Epub 2020 May 18. PMID: 32416121; PMCID: PMC7233217.
- Huang C., Huang L., Wang Y., Li X., Ren L., Gu X. et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021 Jan 16. 397(10270). 220-232. doi: 10.1016/S0140-6736(20)32656-8. Epub 2021 Jan 8. PMID: 33428867; PMCID: PMC7833295.
- Barker-Davies R.M., O’Sullivan O., Senaratne K.P.P., Ba–ker P., Cranley M. et al. The Stanford Hall consensus statement for post-COVID-19 rehabilitation. Br. J. Sports Med. 2020 Aug. 54(16). 949-959. doi: 10.1136/bjsports-2020-102596. Epub 2020 May 31. PMID: 32475821; PMCID: PMC7418628.
- Кovalchuk A., Zinych О., Кushnarova N., Prybyla О., Shyshkan-Shyshova K. Pathophysiological basis of sarcopenia — a chro–nic complication of diabetes. International Journal оf Endocrinology (Ukraine). 2022. 18(6). 343-350. https://doi.org/10.22141/2224-0721.18.6.2022.1205.