Международный неврологический журнал Том 20, №1, 2024
Вернуться к номеру
Малоінвазивні втручання на сонячному сплетенні в пацієнтів зі стійким болем у животі, спричиненим раком підшлункової залози
Авторы: Єрошкін О.А., Романуха Д.М.
ДУ «Головний медичний центр МВС України», м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
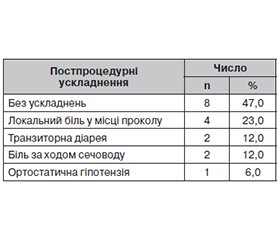
Актуальність. Хронічний біль у животі поширений у 50 % пацієнтів з інтраабдомінальними злоякісними новоутвореннями і має величезний вплив на якість їхнього життя. Зі збільшенням кількості й доз системних анальгетиків зростає й частота побічних ефектів, які можуть ще більше погіршити функціональний стан, що важливо для цієї когорти хворих, у яких п’ятирічна виживаність становить лише 8 %. Мета дослідження: оцінити ефективність і безпечність нейролізису сонячного сплетення під контролем комп’ютерної томографії як методу зменшення стійкого, вираженого болю в пацієнтів з раком підшлункової залози, що впливає на їхній функціональний статус. Матеріали та методи. Проведено аналіз результатів 17 інтервенційних втручань на черевному сплетенні у 16 учасників, одному пацієнту симпатолізис виконали двічі. Критерії включення учасників у дослідження: особи, у яких був встановлений діагноз раку підшлункової залози, зі стійким фармакорезистентним нейропатичним болем у животі протягом ≥ 3 місяців, що не піддавався медикаментозній корекції, у тому числі опіоїдами, протизапальними препаратами та іншими консервативними методами лікування. Вік хворих становив від 39 до 72 років (середній вік — 62,6 ± 8,2 року), 10 (62,5 %) учасників дослідження — чоловіки, 6 (37,5 %) — жінки. Результати. Усім хворим інтервенції були успішно виконані з першої спроби. Випадків перфорації порожнистих органів, пошкодження судин, плевральних синусів або інших структур черевної, грудної порожнин не було. Не зафіксовано жодних неврологічних ускладнень, і жоден пацієнт не потребував переливання крові. Усі досліджувані пацієнти мали значне зменшення болю за візуальною аналоговою шкалою болю (ВАШ) порівняно з оцінкою перед втручанням як через один тиждень після процедури — з 9,7 ± 0,6 до 4,7 ± 1,4 (P < 0,001), так і через шість місяців — з 9,7 ± 0,6 до 4,1 ± 1,4 (P < 0,001) відповідно. Середня оцінка за шкалою Карновського через тиждень після процедури порівняно з даними до втручання зросла з 64,7 ± 7,9 до 78,2 ± 6,4 (P < 0,001). Вірогідне поліпшення функціонального статусу зберігалося до трьох місяців — 71,2 ± 6,9 (P < 0,001). Однак через пів року цей показник становив 63,5 ± 6,0 (P = 0,668), що було пов’язано не тільки з інтенсивністю больового синдрому, але й з іншими ускладненнями перебігу основного захворювання (асцит, кахексія, прологнація росту пухлини, паліативні хірургічні втручання та інше). Висновки. Нейролізис черевного сплетення під контролем комп’ютерної томографії є безпечною та ефективною процедурою для пацієнтів з абдомінальним болем, спричиненим неоперабельним раком підшлункової залози. Симпатолізис забезпечує тривале, значне зменшення больового синдрому за ВАШ через 1, 3, 6 місяців (Р < 0,001) і підвищує функціональний статус пацієнтів за шкалою Карновського через 1 (Р < 0,001) і 3 місяці (p = 0,023). Слід розглядати нейролізис сонячного сплетення як частину міждисциплінарного підходу для комплексного лікування болю у верхній частині живота, пов’язаного з раком, на ранніх стадіях захворювання.
Background. Chronic abdominal pain is common in 50 % of patients with intra-abdominal malignancies and has a huge impact on quality of their lives. As the number and doses of systemic analgesics increase, so does the frequency of side effects that can further worsen functional status, which is important for this cohort of patients who have a five-year survival rate of only 8 %. The purpose of the study: to assess the efficacy and safety of computed tomography-guided celiac plexus neurolysis as a method of reducing persistent, severe pain in patients with pancreatic cancer that affects their functional status. Materials and methods. The analysis of the results of 17 interventional procedures on the celiac plexus in 16 participants was conducted, sympatholysis was performed twice in one patient. Inclusion criteria: pancreatic cancer with persistent pharmacoresistant neuropathic abdominal pain for ≥ 3 months, which did not respond to medications, including opioids, anti-inflammatory drugs, and other conservative methods of treatment. Age of patients was 39 to 72 years (mean of 62.6 ± 8.2 years), 10 (62.5 %) research participants were male and 6 (37.5 %) were female. Results. Interventions were successfully performed for all patients on the first attempt. There were no cases of perforations of hollow organs, damage to blood vessels, pleural sinuses, or other structures of the abdominal and thoracic cavities. No neurological complications were recorded, and no one required blood transfusion. All study patients had a significant reduction in pain on the visual analogue scale compared to baseline, both one week after the procedure, from 9.7 ± 0.6 to 4.7 ± 1.4 (P < 0.001), and in six months, from 9.7 ± 0.6 to 4.1 ± 1.4 (P < 0.001). The average Karnofsky Performance Status Scale score compared to the data before the procedure, one week after increased from 64.7 ± 7.9 to 78.2 ± 6.4 (P < 0.001). A significant improvement in functional status was maintained up to three months — 71.2 ± 6.9 (P < 0.001). However, in six months, this indicator was 63.5 ± 6.0 (Р = 0.668), which may be related not only to the intensity of the pain syndrome, but also to other complications of the underlying disease (ascites, cachexia, tumor growth, palliative surgical interventions, etc.). Conclusions. Computed tomography-guided celiac plexus neurolysis is a safe and effective procedure for patients with abdominal pain caused by inoperable pancreatic cancer. Sympatholysis provides a long-term significant reduction in pain syndrome according to the visual analogue scale after 1, 3, 6 months (Р < 0.001) and increases the functional status of patients according to the Karnofsky Performance Status Scale in 1 (Р < 0.001), 3 months (Р = 0.023). Celiac plexus neurolysis should be considered as part of a multidisciplinary approach to the comprehensive treatment of upper abdominal pain associated with cancer in the early stages of the disease.
нейролізис; симпатолізис; черевне сплетення; рак підшлункової залози; біль у животі; раковий біль; лікування болю
neurolysis; sympatholysis; celiac plexus; pancreatic cancer; abdominal pain; cancer pain; pain management