Журнал "Гастроэнтерология" Том 58, №1, 2024
Вернуться к номеру
Патофізіологічні основи гепатопульмонального синдрому
Авторы: Чуклін С.М. (1), Чуклін С.С. (1), Посівнич М.М. (2), Кристопчук С.А. (2)
(1) - Медичний центр Святої Параскеви, м. Львів, Україна
(2) - Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
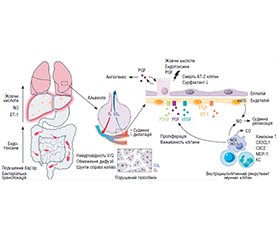
Зміни кровообігу зі збільшенням кровотоку та порушенням балансу між вазодилатацією/вазоконстрикцією є невід’ємним наслідком цирозу печінки та портальної гіпертензії і можуть впливати на легеневий кровообіг з розвитком судинних розладів, з яких гепатопульмональний синдром (ГПС) є найпоширенішим. ГПС є серйозним легеневим ускладненням прогресуючої хвороби печінки, що призводить до несприятливого клінічного прогнозу. У патогенезі ГПС важливими є зниження судинного тонусу, моноцитарна інфільтрація легеневих судин, утворення внутрішньолегеневих артеріовенозних шунтів, дисфункція альвеолярних клітин II типу, деструкція ендотеліального глікокаліксу. Аномалії в легеневому капілярному руслі призводять до гіпоксемії, яка спричинена порушенням співвідношення вентиляція/перфузія, розладами дифузії, розвитком артеріовенозних анастомозів. Інфільтрація легеневого судинного русла моноцитами є одним із ключових факторів ГПС. Цій міграції сприяє переміщення бактерій з кишкової мікробіоти в портальний кровотік зі збільшенням експресії прозапальних цитокінів (ФНП-α, ІЛ-1, ІЛ-6), які призводять до активації моноцитів. Моноцити, розташовані в легеневому колі кровообігу, сприятимуть розширенню судин через активацію індуцибельної синтази оксиду азоту і, таким чином, збільшенню продукції NO. Це також пов’язано з ендотеліальною дисфункцією внаслідок зниження печінкової секреції BMP9 і підвищення ендотеліну-1, ендотеліальної гіперекспресії рецепторів В ендотеліну і збільшення ендотеліальної продукції NO. У проліферації легеневих капілярів значну участь беруть проангіогенні фактори, як-от судинний ендотеліальний фактор росту, тромбоцитарний фактор росту, плацентарний фактор росту. Циркуляція ФНП-α, жовчних кислот і моноцитарна інфільтрація в легеневому кровообігу призводять до посилення апоптозу альвеолярних клітин 2 типу та зниження синтезу сурфактанту. Хронічне запалення при ГПС порушує безперервність шару ендотеліального глікокаліксу. У цій статті наведено огляд поточних знань щодо патогенезу ГПС, підсумовано багато особливостей захворювання на підставі оцінювання літературних джерел з бази даних MedLine на платформі PubMed.
Circulatory changes with increased blood flow and vasodilatation/vasoconstriction imbalance are an integral consequence of liver cirrhosis and portal hypertension and can affect the pulmonary circulation with the development of vascular disorders, with hepatopulmonary syndrome (HPS) being the most common. HPS is a serious pulmonary complication of progressive liver disease, resulting in a poor clinical prognosis. Vascular tone decrease, monocytic infiltration of pulmonary vessels, formation of intrapulmonary arteriovenous shunts, dysfunction of alveolar type II cells, destruction of the endothelial glycocalyx are important in the pathogenesis of HPS. Abnormalities of pulmonary capillaries lead to hypoxemia caused by a violation of the ventilation/perfusion ratio, diffusion disorders, and the development of arteriovenous anastomoses. Infiltration of the pulmonary vessels by monocytes is one of the key factors of HPS. This migration is facilitated by the intestinal microbiota translocation into the portal bloodstream with increased expression of proinflammatory cytokines (tumor necrosis factor α, interleukins 1, 6), leading to the activation of monocytes. Monocytes located in the pulmonary circulation promote the vasodilation through the activation of inducible nitric oxide (NO) synthase and thus NO production. This is also associated with endothelial dysfunction due to a decreased hepatic secretion of bone morphogenetic protein 9 and increased endothelin 1, endothelial overexpression of endothelin B receptors, and increased endothelial NO production. Proangiogenic factors such as vascular endothelial growth factor, platelet-derived growth factor, and placental growth factor play an important role in the proliferation of pulmonary capillaries. Circulation of tumor necrosis factor α, bile acids and monocyte infiltration in the pulmonary circulation lead to increased apoptosis of alveolar type II cells and decreased surfactant synthesis. Chronic inflammation in HPS disrupts the continuity of the endothelial glycocalyx layer. This article provides an overview of the current knowledge on the pathogenesis of HPS, summarizes many features of the disease based on the literature research in MEDLINE database on the PubMed platform.
гепатопульмональний синдром; внутрішньолегенева судинна дилатація; моноцити; ангіогенез; ендотеліальний глікокалікс; огляд
hepatopulmonary syndrome; intrapulmonary vascular dilatation; monocytes; angiogenesis; endothelial glycocalyx; review
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- DuBrock H.M., Forde K., Krok K., et al. Cardiac index and hepatopulmonary syndrome in liver transplantation candidates: The pulmonary vascular complications of liver disease study. Liver Transpl. 2023. 29(5). 467-475. doi: 10.1097/LVT.0000000000000112.
- Raevens S., Fallon M.B. Potential clinical targets in hepatopulmonary syndrome: lessons from experimental models. Hepatology. 2018. 68(5). 2016-2028. doi: 10.1002/hep.30079.
- Weinfurtner K., Forde K. Hepatopulmonary Syndrome and Portopulmonary Hypertension: Current Status and Implications for Liver Transplantation. Curr Hepatol Rep. 2020. 19(3). 174-185. doi: 10.1007/s11901-020-00532-y.
- Raevens S., Boret M., Fallon M.B. Hepatopulmonary syndrome. JHEP Rep. 2022. 4(9). 100527. doi: 10.1016/j.jhepr.2022.100527.
- Raevens S., Geerts A., Paridaens A., et al. Placental growth factor inhibition targets pulmonary angiogenesis and represents a therapy for hepatopulmonary syndrome in mice: liver failure/cirrhosis/portal hypertension. Hepatology. 2018. 68. 634-651. doi: 10.1002/hep.29579.
- Baweja S., Kumari A., Negi P., et al. Hepatopulmonary syndrome is associated with low sphingosine-1-phosphate levels and can be ameliorated by the functional agonist fingolimod. J Hepatol. 2023. 79(1). 167-180. doi: 10.1016/j.jhep.2023.03.018.
- Douschan P., Kovacs G., Sassmann T., et al. Pulmonary vascular disease and exercise hemodynamics in chronic liver disease. Respir Med. 2022. 202. 106987. doi: 10.1016/j.rmed.2022.106987.
- Königshofer P., Brusilovskaya K., Schwabl P., Reiberger T. Animal models of portal hypertension. Biochim Biophys Acta Mol Basis Dis. 2019. 1865. 1019-1030. doi: 10.1016/j.bbadis.2018.07.018.
- Li L., Cook C., Liu Y., et al. Endothelial glycocalyx in hepatopulmonary syndrome: An indispensable player mediating vascular changes. Front Immunol. 2022. 13. 1039618. doi: 10.3389/fimmu.2022.1039618.
- Certain M.C., Robert F., Baron A., et al. Hepatopulmonary syndrome: Prevalence, pathophysiology and clinical implications. [Article in French]. Rev Mal Respir. 2022. 39(2). 84-89. doi: 10.1016/j.rmr.2022.02.055.
- Rodríguez-Roisin R., Krowka M.J., Agustí A. Hepatopulmonary Disorders: Gas Exchange and Vascular Manifestations in Chronic Liver Disease. Compr Physiol. 2018. 8(2). 711-729. doi: 10.1002/cphy.c170020.
- Gandhi K.D., Taweesedt P.T., Sharma M., Surani S. Hepatopulmonary syndrome: An update. World J Hepatol. 2021. 13(11). 1699-1706. doi: 10.4254/wjh.v13.i11.1699.
- Sayadi A., Duhaut L., Robert F., et al. Hepatopulmonary syndrome. Rev Med Interne. 2023 Mar 31. S0248-8663(23)00113-3. doi: 10.1016/j.revmed.2023.03.008. Online ahead of print.
- Del Valle K., DuBrock H.M. Hepatopulmonary Syndrome and Portopulmonary Hypertension: Pulmonary Vascular Complications of Liver Disease. Compr Physiol. 2021. 11(4). 3281-3302. 10.1002/cphy.c210009.
- Georgakopoulou V.E., Asimakopoulou S., Cholongitas E. Pulmonary function testing in patients with liver cirrhosis (Review). Med Int (Lond). 2023. 3(4). 36. doi: 10.3892/mi.2023.96.
- Soulaidopoulos S., Cholongitas E., Giannakoulas G., et al. Review article: Update on current and emergent data on hepatopulmonary syndrome. World J Gastroenterol. 2018 Mar 28. 24(12). 1285-1298. doi: 10.3748/wjg.v24.i12.1285.
- Khoramzadeh M., Dehghanian A., Ketabchi F. Roles of Endothelin B Receptors and Endothelial Nitric Oxide Synthase in the Regulation of Pulmonary Hemodynamic in Cirrhotic Rats. J Cardiovasc Pharmacol. 2019. 73(3). 178-185. doi: 10.1097/FJC.0000000000000650.
- Nassef N.A., Abd-El Hamid M.S., Abusikkien S.A., Ah–med A.I. Quercetin ameliorates acute lung injury in a rat model of hepatopulmonary syndrome. BMC Complement Med Ther. 2022. 22(1). 320. doi: 10.1186/s12906-022-03785-w.
- Corbi L.E., Tannuri A.C.A., de Aro Braz M.J., et al. Does Biliodigestive Anastomosis Have Any Effect on the Reversal of Hepatopulmonary Syndrome in a Biliary Cirrhosis Experimental Model? Dig Dis Sci. 2019. 64(11). 3192-3202. doi: 10.1007/s10620-019-05658-8.
- Gupta S., Tang R., Al-Hesayen A. Inhaled nitric oxide improves the hepatopulmonary syndrome: a physiologic analysis. Thorax. 2021. 76(11). 1142-1145. doi: 10.1136/thoraxjnl-2020-216128.
- Nayyar D., Man H.S., Granton J., et al. Proposed management algorithm for severe hypoxemia after liver transplantation in the hepatopulmonary syndrome. Am J Transplant. 2015. 15. 903-913. doi: 10.1111/ajt.13177.
- Ling Y., Zhang J., Luo B., et al. The role of endothelin-1 and the endothelin B receptor in the pathogenesis of hepatopulmonary syndrome in the rat. Hepatology. 2004. 39. 1593-1602. doi: 10.1002/hep.20244.
- Cho T.J., Kim H.J., Cho J. Endothelin-converting enzyme-1 expression in acute and chronic liver injury in fibrogenesis. Anim Cells Syst (Seoul). 2019. 23(3). 170-175. doi: 10.1080/–19768354.2019.1595141.
- Örmeci N. Endothelins and liver cirrhosis. Port Hypertens Cirrhos. 2022. 1. 66-72. doi: 10.1002/poh2.17.
- Chaumais M.C., Guignabert C., Savale L., et al. Clinical pharmacology of endothelin receptor antagonists used in the treatment of pulmonary arterial hypertension. Am J Cardiovasc Drugs Drugs Devices Interv. 2015. 15(1). 13-26. doi: 10.1007/s40256-014-0095-y.
- Li T.H., Lee P.C., Lee K.C., et al. Down-regulation of common NFκB-iNOS pathway by chronic Thalidomide treatment improves Hepatopulmonary Syndrome and Muscle Wasting in rats with Biliary Cirrhosis. Sci Rep. 2016. 6. 39405. doi: 10.1038/srep39405.
- Koch D.G., Fallon M.B. Hepatopulmonary syndrome. Curr Opin Gastroenterol. 2014. 30(3). 260-264. doi: 10.1097/MOG.0000000000000067.
- Cartin-Ceba R., Krowka M.J. Pulmonary Complications of Portal Hypertension. Clin Liver Dis. 2019. 23(4). 683-711. doi: 10.1016/j.cld.2019.06.003.
- Gómez F.P., Barberà J.A., Roca J., et al. Effects of nebulized N(G)-nitro-L-arginine methyl ester in patients with hepatopulmonary syndrome. Hepatology. 2006. 43(5). 1084-1091. 10.1002/hep.21141.
- Cirino G., Szabo C., Papapetropoulos A. Physiological roles of hydrogen sulfide in mammalian cells, tissues, and organs. Physiol Rev. 2023. 103(1). 31-276. doi: 10.1152/physrev.00028.2021.
- Sabang R.L., Abu-Hishmeh M., Bodin R., Epelbaum O. Impact of Liver Transplantation on Carbon Monoxide Production as Measured by Arterial Carboxyhemoglobin Levels in Cirrhotic Patients with and without Hepatopulmonary Syndrome. Ann Transplant. 2021. 26. e932009. doi: 10.12659/AOT.932009.
- Gu L.L., Yang X.W., Liao J., et al. CX3CR1 participates in pulmonary angiogenesis in experimental hepatopulmonary syndrome mice through inhibiting AKT/ERK signaling pathway and regulating NO/NOS release. Eur Rev Med Pharmacol Sci. 2019. 23(15). 6645-6656. doi: 10.26355/eurrev_201908_18555.
- Wu W., Zhang J., Yang W., et al. Role of splenic reservoir monocytes in pulmonary vascular monocyte accumulation in experimental hepatopulmonary syndrome. J Gastroenterol Hepatol. 2016. 31(11). 1888-1894. doi: 10.1111/jgh.13388.
- Muñoz L., Caparrós E., Albillos A., Francés R. The shaping of gut immunity in cirrhosis. Front Immunol. 2023. 14. 1139554. doi: 10.3389/fimmu.2023.1139554.
- Zhu J., Qiu J., Chen K., et al. Tea polyphenols and Levofloxacin alleviate the lung injury of hepatopulmonary syndrome in common bile duct ligation rats through Endotoxin -TNF signaling. Biomed Pharmacother. 2021. 137. 111263. doi: 10.1016/j.biopha.2021.111263.
- Suk K.T., Kim M.Y., Jeong S.W., et al. Impact of bacterial translocation on hepatopulmonary syndrome: a prospective observational study. Dig Dis Sci. 2018. 63(1). 248-256. doi: 10.1007/s10620-017-4868-4.
- Li X., Chen Y., Chang Y., et al. CXCR2 is involved in pulmonary intravascular macrophage accumulation and angiogenesis in a rat model of hepatopulmonary syndrome. Clin Sci (Lond). 2017. 131(2). 159-168. doi: 10.1042/CS20160593.
- Kawut S.M., Krowka M.J., Forde K.A., et al. Impact of hepatopulmonary syndrome in liver transplantation candidates and the role of angiogenesis. Eur Respir J. 2022. 60(2). 2102304. doi: 10.1183/13993003.02304-2021.
- Albonici L., Giganti M.G., Modesti A., et al. Multifaceted Role of the Placental Growth Factor (PlGF) in the Antitumor Immune Response and Cancer Progression. Int J Mol Sci. 2019. 20(12). 2970. doi: 10.3390/ijms20122970.
- Li X., Jin Q., Yao Q., et al. Placental Growth Factor Contri–butes to Liver Inflammation, Angiogenesis, Fibrosis in Mice by Promo–ting Hepatic Macrophage Recruitment and Activation. Front Immunol. 2017. 8. 801. doi: 10.3389/fimmu.2017.00801.
- Shenoda B., Boselli J. Vascular syndromes in liver cirrhosis. Clin J Gastroenterol. 2019. 12(5). 387-397. doi: 10.1007/s12328-019-00956-0.
- Rochon E.R., Krowka M.J., Bartolome S., et al. BMP9/10 in pulmonary vascular complications of liver disease. Am J Respir Crit Care Med. 2020. 201(12). 1575-1578. doi: 10.1164/rccm.201912-2514LE.
- Gaitantzi H., Karch J., Germann L., et al. BMP-9 Modulates the Hepatic Responses to LPS. Cells. 2020. 9(3). 617. doi: 10.3390/cells9030617.
- Wang L., Rice M., Swist S., et al. BMP9 and BMP10 Act Directly on Vascular Smooth Muscle Cells for Generation and Maintenance of the Contractile State. Circulation. 2021. 143(14). 1394-1410. doi: 10.1161/CIRCULATIONAHA.120.047375.
- Guignabert C., Humbert M. Targeting transforming growth factor-β receptors in pulmonary hypertension. Eur Respir J. 2021. 57(2). 2002341. doi: 10.1183/13993003.02341-2020.
- Tu L., Desroches-Castan A., Mallet C., et al. Selective BMP-9 Inhibition Partially Protects Against Experimental Pulmonary Hypertension. Circ Res. 2019. 124(6). 846-855. doi: 10.1161/CIRCRESAHA.118.313356.
- Hassanisaber H., Rouleau L., Faucheux N. Effect of BMP-9 on endothelial cells and its role in atherosclerosis. Front Biosci (Landmark Ed). 2019. 24(6). 994-1023. doi: 10.2741/4764.
- John M., Kim K.J., Bae S.D.W., et al. Role of BMP-9 in human liver disease. Gut. 2019. 68(11). 2097-2100. doi: 10.1136/gutjnl-2018-317543.
- Owen N.E., Alexander G.J., Sen S., et al. Reduced circulating BMP10 and BMP9 and elevated endoglin are associated with disease severity, decompensation and pulmonary vascular syndromes in patients with cirrhosis. EBioMedicine. 2020. 56. 102794. doi: 10.1016/j.ebiom.2020.102794.
- Yaman M., Mustika S. Lung Abnormalities in Liver Cirrhosis. J Pulmonol Respir Res. 2023. 7. 015-020. doi: 10.29328/journal.jprr.1001045.
- Qi X., Luo Y., Mengyong X., Zhang Q., et al. Mechanisms of Alveolar Type 2 epithelial cell death during acute lung injury. Stem Cells. 2023 Sep 16:sxad074. doi: 10.1093/stmcls/sxad074.
- Yang W., Hu B., Wu W., et al. Alveolar type II epithelial cell dysfunction in rat experimental hepatopulmonary syndrome (HPS). PLoS One. 2014. 9(11). e113451. doi: 10.1371/journal.pone.0113451.
- Horvatits T., Drolz A., Rutter K., et al. Serum bile acids in patients with hepatopulmonary syndrome. Z Gastroenterol. 2017. 55(4). 361-367. doi: 10.1055/s-0042-121268.
- Elmore A., Almuntashiri A., Wang X., et al. Circulating Surfactant Protein D: A Biomarker for Acute Lung Injury? Biomedicines. 2023. 11(9). 2517. doi: 10.3390/biomedicines11092517.
- Villalba N., Baby S., Yuan S.Y. The endothelial glycocalyx as a double-edged sword in microvascular homeostasis and pathogenesis. Front Cell Dev Biol. 2021. 9. 711003. doi: 10.3389/fcell.2021.711003.
- Mortazavi C.M., Hoyt J.M., Patel A., Chignalia A.Z. The glycocalyx and calcium dynamics in endothelial cells. Curr Top Membr. 2023. 91. 21-41. doi: 10.1016/bs.ctm.2023.02.002.
- Suzuki A., Tomita H., Okada H. Form follows function: The endothelial glycocalyx. Transl Res. 2022. 247. 158-167. doi: 10.1016/j.trsl.2022.03.014.
- Parthasarathi K. The pulmonary vascular barrier: Insights into structure, function, and regulatory mechanisms. Adv Anat Embryol Cell Biol. 2018. 228. 41-61. doi: 10.1007/978-3-319-68483-3_3.
- De Zutter A., Crijns H., Berghmans N., et al. The Chemokine-Based Peptide, CXCL9(74-103), Inhibits Angiogenesis by Blocking Heparan Sulfate Proteoglycan-Mediated Signaling of Multiple Endothelial Growth Factors. Cancers (Basel). 2021. 13(20). 5090. doi: 10.3390/cancers13205090.
- Jain P., Shanthamurthy C.D., Leviatan Ben-Arye S., et al. Synthetic heparan sulfate ligands for vascular endothelial growth factor to modulate angiogenesis. Chem Commun (Camb). 2021. 57(28). 3516-3519. doi: 10.1039/d1cc00964h.
- Wang X., Zhu Q., Lin Y., et al. Crosstalk between TEMs and endothelial cells modulates angiogenesis and metastasis via IGF1-IGF1R signalling in epithelial ovarian cancer. Br J Cancer. 2017. 117(9). 1371-1382.
- Lindkvist M., Zegeye M.M., Grenegård M., Ljungberg L.U. Pleiotropic, unique and shared responses elicited by IL-6 family cytokines in human vascular endothelial cells. Int J Mol Sci. 2022. 23(3). 1448. doi: 10.3390/ijms23031448.