Архив офтальмологии Украины Том 12, №1, 2024
Вернуться к номеру
Експресія нейрон-специфічної єнолази в сітківці та вплив на неї агоніста бензодіазепінових рецепторів карбацетаму при експериментальній діабетичній ретинопатії
Авторы: Зябліцев С.В., Жупан Д.Б.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
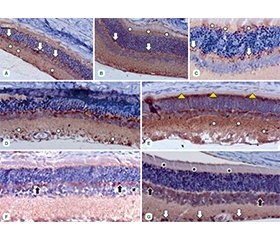
Актуальність. На сьогодні визнано, що в патогенезі діабетичної ретинопатії (ДР) поряд з розвитком судинних порушень у сітківці незалежно розвивається дисфункція нейронів і процеси нейродегенерації. Метою наших досліджень було визначення експресії нейрон-специфічної єнолази (NSE) у сітківці на початкових стадіях розвитку експериментальної ДР і впливу на неї агоніста бензодіазепінових рецепторів карбацетаму. Матеріали та методи. У 45 трьохмісячних щурів-самців лінії Wistar моделювали ДР шляхом одноразового введення стрептозотоцину (50 мг/кг; Sigma-Aldrich, Co, China). Щурів було розподілено на 3 групи: контрольна, з уведенням інсуліну (30 ОД; Novo Nordisk A/S, Denmark) і з уведенням інсуліну й карбацетаму (5 мг/кг). Імуногістохімічно в сітківці виявляли NSE (ThermoFisher Scietific, USA). Результати. У сітківці щурів з експериментальною ДР NSE-позитивне забарвлення мали гангліонарні клітини, нейрони внутрішнього і зовнішнього ядерних шарів і внутрішній сегмент фоторецепторів. Інтенсивність забарвлення в контрольній групі збільшувалася до 14-ї доби, після чого лишалася на низькому рівні. У внутрішньому ядерному шарі спостерігалося фонове забарвлення, на тлі якого візуалізувалися численні нервові волокна. Через 2 місяці в контрольній групі загальна інтенсивність забарвлення в нейронах сітківки була слабкою, NSE-позитивні клітини групувалися навколо мікроаневризм, які на цей час утворювалися по внутрішній поверхні сітківки. У зовнішньому ядерному шарі формувалися численні клітинні фіброзні проліферати. Застосування інсуліну сприяло збереженню NSE-позитивно забарвлених клітин у шарах сітківки при зменшенні інтенсивності фонового забарвлення. Застосування інсуліну з карбацетамом посилювало цю тенденцію: NSE-позитивне забарвлення виявлялося в гангліонарних клітинах, клітинах внутрішнього ядерного шару і внутрішньому сегменті фоторецепторів. При цьому утворення мікроаневризм і клітинних проліфератів не спостерігалося. Висновки. У даному дослідженні показаний ефект карбацетаму щодо запобігання розвитку процесів нейродегенерації та збереження NSE-позитивних нейронів сітківки при ДР.
Background. Today, it is recognized that in the pathogenesis of diabetic retinopathy (DR), along with the development of vascular disorders, neuron dysfunction and neurodegeneration processes independently develop in the retina. The purpose was to determine the expression of neuron-specific enolase (NSE) in the retina at the initial stages of the experimental DR and the effect on it of the benzodiazepine receptor agonist carbacetam. Materials and methods. DR was modeled in 45 three-month-old male Wistar rats by a single injection of streptozotocin (50 mg/kg; Sigma-Aldrich Co, China). The rats were divided into 3 groups: control, with the introduction of insulin (30 units; Novo Nordisk A/S, Denmark) and with the introduction of insulin and carbacetam (5 mg/kg). NSE in the retina was detected immunohistochemically (Thermo Fisher Scientific, USA). Results. In the retina of rats with experimental DR, ganglion cells, neurons of the inner and outer nuclear layers, and the inner segment of photoreceptors had NSE-positive staining. The intensity of staining in the control group increased until the day 14, after which it remained at a low level. In the inner nuclear layer, a background staining was observed against which numerous nerve fibers were visualized. After 2 months in the control group, the general intensity of staining in retinal neurons was weak, NSE-positive cells were grouped around microaneurysms, which at this time were formed on the inner surface of the retina. Numerous cellular fibrous proliferations were formed in the outer nuclear layer. The use of insulin contributed to the preservation of NSE-positively stained cells in the layers of the retina while reducing the intensity of background staining. The use of insulin with carbacetam enhanced this trend: NSE-positive staining was detected in ganglion cells, cells of the inner nuclear layer, and the inner segment of photoreceptors. At the same time, the formation of microaneurysms and cell proliferations was not observed. Conclusions. This study shows the protective effect of carbacetam for the development of neurodegeneration processes and the preservation of NSE-positive retinal neurons in DR.
цукровий діабет; стрептозотоцин; нейродегенерація; NSE-позитивні нейрони; мікроаневризми
diabetes; streptozotocin; neurodegeneration; NSE-positive neurons; microaneurysms
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Sun H, Saeedi P, Karuranga S, Pinkepank M, Ogurtsova K, Duncan BB et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res Clin Pract. 2022 Jan;183:109119. doi: 10.1016/j.diabres.2021.109119.
- GBD 2019 Blindness and Vision Impairment Collaborators; Vision Loss Expert Group of the Global Burden of Disease Study. Causes of blindness and vision impairment in 2020 and trends over 30 years, and prevalence of avoidable blindness in relation to VISION 2020: the Right to Sight: an analysis for the Global Burden of Disease Study. Lancet Glob Health. 2021 Feb;9(2):e144-e160. doi: 10.1016/S2214-109X(20)30489-7. Epub 2020 Dec 1. Erratum in: Lancet Glob Health. 2021 Apr;9(4):e408.
- Teo ZL, Tham YC, Yu M, Chee ML, Rim TH, Cheung N et al. Global Prevalence of Diabetic Retinopathy and Projection of Burden through 2045: Systematic Review and Meta-analysis. Ophthalmology. 2021 Nov;128(11):1580-1591. doi: 10.1016/j.ophtha.2021.04.027.
- Ren J, Zhang S, Pan Y, Jin M, Li J, Luo Y, Sun X, Li G. Dia–betic retinopathy: Involved cells, biomarkers, and treatments. Front Pharmacol. 2022 Aug 9;13:953691. doi: 10.3389/fphar.2022.953691.
- Simó R, Stitt AW, Gardner TW. Neurodegeneration in diabetic retinopathy: does it really matter? Diabetologia. 2018 Sep;61(9):1902-1912. doi: 10.1007/s00125-018-4692-1.
- Ou GY, Lin WW, Zhao WJ. Neuregulins in Neurodegenerative Diseases. Front Aging Neurosci. 2021 Apr 9;13:662474. doi: 10.3389/fnagi.2021.662474.
- Xu CM, Luo YL, Li S, Li ZX, Jiang L, Zhang GX, Owusu L, Chen HL. Multifunctional neuron-specific enolase: its role in lung di–seases. Biosci Rep. 2019 Nov 29;39(11):BSR20192732. doi: 10.1042/BSR20192732.
- Seki SM, Gaultier A. Exploring Non-Metabolic Functions of Glycolytic Enzymes in Immunity. Front Immunol. 2017 Nov 22;8:1549. doi: 10.3389/fimmu.2017.01549.
- Capello M, Ferri-Borgogno S, Cappello P, Novelli F. α-Enolase: a promising therapeutic and diagnostic tumor target. FEBS J. 2011 Apr;278(7):1064-74. doi: 10.1111/j.1742-4658.2011.08025.x.
- Marangos PJ, Schmechel D, Zis AP, Goodwin FK. The existence and neurobiological significance of neuronal and glial forms of the glycolytic enzyme enolase. Biol Psychiatry. 1979 Aug;14(4):563-79. PMID: 385064.
- Yu ZW, Liu R, Li X, Wang Y, Fu YH, Li HY, Yuan Y, Gao XY. High Serum Neuron-Specific Enolase Level Is Associated with Mild Cognitive Impairment in Patients with Diabetic Retinopathy. Diabetes Metab Syndr Obes. 2020 Apr 24;13:1359-1365. doi: 10.2147/DMSO.S249126.
- Sieber M, Dreßler J, Franke H, Pohlers D, Ondruschka B. Post-mortem biochemistry of NSE and S100B: A supplemental tool for detecting a lethal traumatic brain injury? J Forensic Leg Med. 2018 Apr;55:65-73. doi: 10.1016/j.jflm.2018.02.016.
- Ahmed SA, Ghoneim DF, Morsy ME, Hassan AA, Mahmoud ARH. Low-Level Laser Therapy with 670 nm Alleviates Diabetic Retinopathy in an Experimental Model. J Curr Ophthalmol. 2021 Jul 5;33(2):143-151. doi: 10.4103/joco.joco_29_20.
- Li J, Yan M, Zhang Y, Xie M, Yan L, Chen J. Serum neuron-specific enolase is elevated as a novel indicator of diabetic retino–pathy including macular oedema. Diabet Med. 2015 Jan;32(1):102-7. doi: 10.1111/dme.12597.
- Yu ZW, Liu R, Li X, Wang Y, Fu YH, Li HY, Yuan Y, Gao XY. High Serum Neuron-Specific Enolase Level Is Associated with Mild Cognitive Impairment in Patients with Diabetic Retinopathy. Diabetes Metab Syndr Obes. 2020 Apr 24;13:1359-1365. doi: 10.2147/DMSO.S249126.
- Asadova V, Gul Z, Buyukuysal RL, Yalcinbayir O. Assessment of neuron-specific enolase, S100B and malondialdehyde levels in serum and vitreous of patients with proliferative diabetic retinopathy. Int Ophthalmol. 2020 Jan;40(1):227-234. doi: 10.1007/s10792-019-01175-9.
- Dabbs D. Diagnostic Immunohistochemistry, 4th Edition. Theranostic and genomic applications. 2014. 960 p.
- Rich KA, Zhan Y, Blanks JC. Migration and synaptogenesis of cone photoreceptors in the developing mouse retina. J Comp Neurol. 1997 Nov 10;388(1):47-63. PMID: 9364238.
- Haque A, Ray SK, Cox A, Banik NL. Neuron specific enolase: a promising therapeutic target in acute spinal cord injury. Metab Brain Dis. 2016 Jun;31(3):487-95. doi: 10.1007/s11011-016-9801-6.
- Vodianyk VV, Ziablitzev SV, Andrushchenko VI. Effect of tyrosine protein kinase blockade on the state of retinal microglia in diabetic retinopathy. International Journal of Endocrinology (Ukraine). 2023;19(5):337-343. doi: 10.22141/2224-0721.19.5.2023.1296. (in Ukrainian).
- Ziablitzev SV, Zhupan DB, Dyadyk OO. The influence of a benzodiazepine receptor agonist on the state of glia in the diabetic retinopathy. Fiziol Zh. 2023;69(6):33-42. doi: 10.15407/fz69.06.033. in Ukrainian.
- Haque A, Polcyn R, Matzelle D, Banik NL. New Insights into the Role of Neuron-Specific Enolase in Neuro-Inflammation, Neurodegeneration, and Neuroprotection. Brain Sci. 2018 Feb 18;8(2):33. doi: 10.3390/brainsci8020033.
- Ziablitsev SV, Zhupan DB, Tykhomyrov AO, Dyadyk OO. Benzodiazepine receptor agonist Carbacetam modulates the level of vascular endothelial growth factor in the retina of rats with streptozotocin-induced diabetes. Ukr Biochem J. 2023;6(95):20-29. doi: 10.15407/ubj95.06.021.
- Haque A, Capone M, Matzelle D, Cox A, Banik NL. Targeting Enolase in Reducing Secondary Damage in Acute Spinal Cord Injury in Rats. Neurochem Res. 2017 Oct;42(10):2777-2787. doi: 10.1007/s11064-017-2291-z.
- Eggers ED, Carreon TA. The effects of early diabetes on inner retinal neurons. Vis Neurosci. 2020 Sep 16;37:E006. doi: 10.1017/S095252382000005X.
- Castilho Á, Ambrósio AF, Hartveit E, Veruki ML. Disruption of a neural microcircuit in the rod pathway of the mammalian retina by diabetes mellitus. J Neurosci. 2015 Apr 1;35(13):5422-33. doi: 10.1523/JNEUROSCI.5285-14.2015.
- Lee YJ, Kim M, Lee JY, Jung SH, Jeon HY, Lee SA et al. The benzodiazepine anesthetic midazolam prevents hyperglycemia-induced microvascular leakage in the retinas of diabetic mice. FASEB J. 2018 May 21:fj201800014RR. doi: 10.1096/fj.201800014RR.
- Ali SA, Zaitone SA, Dessouki AA, Ali AA. Pregabalin affords retinal neuroprotection in diabetic rats: Suppression of retinal glutamate, microglia cell expression and apoptotic cell death. Exp Eye Res. 2019 Jul;184:78-90. doi: 10.1016/j.exer.2019.04.014.
- Ziablitsev SV, Starodubska OO, Bogza SL. Influence of carbacetam on neurologic destruction processes under the experimental traumatic brain injury. J Educat Health Sport Form Health Sci. 2017;7(2):601-11. doi: 10.26641/1997-9665.2017.2.12-18.
- Al-Kuraishy HM, Al-Gareeb AI, Saad HM, Batiha GE. Benzodiazepines in Alzheimer’s disease: beneficial or detrimental effects. Inflammopharmacology. 2023 Feb;31(1):221-30. doi: 10.1007/s10787-022-01099-4.
- Kmet OG, Ziablitsev SV, Filipets ND. Peculiarities of the anti–oxidant protection and nitrogen oxide systems of the brain in rats with experimental type 2 diabetes mellitus after carbacetam admini–stration. Int J Endocrinol. 2019;15(5):376-80. doi: 10.22141/2224-0721.15.5.2019.180040.