Журнал «Боль. Суставы. Позвоночник» Том 14, №1, 2024
Вернуться к номеру
Особливості реноваційних властивостей кісткової тканини проксимального відділу великогомілкової кістки у хворих на ревматоїдний артрит з багатоплощинними деформаціями колінного суглоба
Авторы: Герасименко С.І., Полулях М.В., Герасименко А.С., Бабко А.М., Панченко Л.М., Полулях Д.М., Качан Д.І.
ДУ «Інститут травматології та ортопедії НАМН України», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
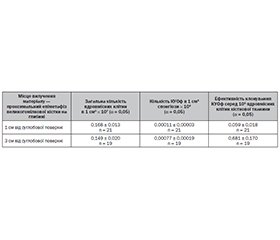
Актуальність. За тяжкістю ураження суглобів ревматоїдний артрит (РА) не має собі рівних серед захворювань опорно-рухової системи. Ураження колінних суглобів у хворих на РА відмічається у 65–70 % випадків і є найбільш поширеною причиною втрати працездатності. Мета: вивчити показники остеогенної активності стромальних (мезенхімальних) стовбурових клітин кісткової тканини суглобових кінців колінного суглоба хворих на вторинний гонартроз на ґрунті РА за наявності багатоплощинних деформацій. Матеріали та методи. Матеріалом були зразки спонгіозної кістки переднього та заднього відділів плато проксимального відділу великогомілкової кістки і спонгіозна тканина з глибини 1 і 3 см від суглобової поверхні, а саме з проксимального епіметафізу великогомілкової кістки, видалені під час ендопротезування колінних суглобів хворих на вторинний гонартроз на ґрунті РА та у хворих на первинний гонартроз за наявності багатоплощинних деформацій. За допомогою методики клонування колонієутворюючих одиниць фібробластів (КУОф) кісткової тканини обстежено 38 хворих, з них 9 хворих на РА та 29 — на первинний гонартроз з ураженням колінного суглоба за наявності багатоплощинних деформацій. Результати. Загальна кількість ядровмісних клітин в 1 см³ спонгіози переднього відділу плато великогомілкової кістки була у 2,3 раза нижча порівняно з цим показником у задньому відділі (р < 0,05). Встановлено, що характеристики спонгіозної тканини за кількістю ядровмісних клітин та вмістом КУОф в 1 см³ з глибини у 3 см від суглобової поверхні проксимального епіметафізу великогомілкової кістки хворих на РА були майже у 3 рази вищі порівняно з показниками хворих на первинний гонартроз (р < 0,05). Висновки. Зміни реноваційних процесів кісткової тканини хворих на вторинний гонартроз на ґрунті РА та хворих на первинний гонартроз за наявності багатоплощинних деформацій мають односпрямований характер, але вираженість їх більша у хворих на РА. На глибині 3 см від суглобової поверхні проксимального епіметафізу великогомілкової кістки умови для вторинної фіксації ніжки ендопротеза колінного суглоба значно кращі, за однакових інших умов, тому «виживаність» ендопротеза з подовженою ніжкою буде більшою.
Background. Rheumatoid arthritis (RA) has no equal among the musculoskeletal system diseases in terms of the severity of joint damage. Knee joint damage was noted in 65–70 % of RA patients and it is the most common cause of disability. The purpose was to study the indices of osteogenic activity of stromal (mesenchymal) stem cells (MSCs) of the articular bone ends of the knee joint in patients with secondary knee osteoarthritis (KOA) due to RA in the presence of multi-plane deformations. Materials and methods. The studied material was samples of cancellous bone of the anterior and posterior parts of the plateau of the proximal part of the tibia and spongiosa from a depth of 1 cm and 3 cm from the articular surface, namely from the proximal epimetaphysis of the tibia, removed during knee arthroplasty of patients with secondary KOA due to RA and in patients with primary KOA in the presence of multi-plane deformations. Using the method of cloning colony-forming units of fibroblasts (CSF) of bone tissues, 38 patients were examined, including 9 patients with RA and 29 patients with primary KOA with damage to the knee joint in the presence of multi-plane deformations. Results. The total number of nucleated cells in 1 cm3 of spongiosa of the front part of the tibial plateau was 2.3 times lower compared to the parameter of this index in the posterior part (p < 0.05). The characteristics of spongy tissue in terms of the number of nucleated cells and the content of CSF in 1 cm3 from a depth of 3 cm from the articular surface of the proximal epimetaphysis of the tibia of patients with RA were almost 3 times higher compared to the indices of patients with primary KOA (p < 0.05). Conclusions. Changes in the renovation processes of bone tissue in patients with secondary KOA due to RA and in patients with primary KOA in the presence of multi-plane deformations are unidirectional, but their expressiveness is greater in patients with RA. At a depth of 3 cm from the articular surface of the proximal epimetaphysis of the tibia, the conditions for secondary fixation of the leg of the knee joint replacement are much better, all other conditions being equal, so the "survival" of the endoprosthesis with an elongated leg will be greater.
ревматоїдний артрит; колінний суглоб; згинальна контрактура; колонієутворюючі одиниці фібробластів; стромальні (мезенхімальні) стовбурові клітини; тотальне ендопротезування
rheumatoid arthritis; knee joint; flexion contracture; fibroblast colony-forming units; stem stromal cells; total arthroplasty
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Watson RS, Gouze E, Levings PP, Bush ML, Kay JD, Jorgensen MS, et al. Gene delivery of TGF-β1 induces arthrofibrosis and chondrometaplasia of synovium in vivo. Lab Invest. 2010 Nov;90(11):1615-27. doi: 10.1038/labinvest.2010.145. Epub 2010 Aug 9. PMID: 20697373; –PMCID: PMC3724510.
- Ouyang X, Ghani A, Mehal WZ. Inflammasome biology in fibrogenesis. Biochim Biophys Acta. 2013 Jul;1832(7):979-88. doi: 10.1016/j.bbadis.2013.03.020. Epub 2013 Apr 3. PMID: 23562491.
- Canovas F, Dagneaux L. Quality of life after total knee arthroplasty. Orthop Traumatol Surg Res. 2018 Feb;104(1S):S41-S46. doi: 10.1016/j.otsr.2017.04.017. Epub 2017 Nov 26. PMID: 29183821.
- Øiestad BE, Juhl CB, Eitzen I, Thorlund JB. Knee extensor muscle weakness is a risk factor for development of knee osteoarthritis. A systematic review and meta-ana–lysis. Osteoarthritis Cartilage. 2015 Feb;23(2):171-7. doi: 10.1016/j.joca.2014.10.008. Epub 2014 Nov 1. PMID: 25450853.
- Herman MJ, Martinek MA, Abzug JM. Complications of tibial eminence and diaphyseal fractures in children: prevention and treatment. J Am Acad Orthop Surg. 2014 Nov;22(11):730-41. doi: 10.5435/JAAOS-22-11-730. PMID: 25344598.
- Dell'Isola A, Smith SL, Andersen MS, Steultjens M. Knee internal contact force in a varus malaligned phenotype in knee osteoarthritis (KOA). Osteoarthritis Cartilage. 2017 Dec;25(12):2007-2013. doi: 10.1016/j.joca.2017.08.010. Epub 2017 Sep 4. PMID: 28882753.
- George JM. Valgus Deformity Correction in Total Knee Replacement: An Overview [Internet]. Knee Surgery — Reconstruction and Replacement. IntechOpen; 2020. Available from: doi: 10.5772/intechopen.89739.
- Schiavone Panni A, Cerciello S, Vasso M, Tartarone M. Stiffness in total knee arthroplasty. J Orthop Traumatol. 2009 Sep;10(3):111-8. doi: 10.1007/s10195-009-0054-6. Epub 2009 Jul 7. PMID: 19582368; PMCID: PMC2744731.
- Formby PM, Donohue MA, Cannova CJ, Caulfield JP. Hydraulic distension of the knee: a novel treatment for arthrofibrosis after total knee replacement (case series). ANZ J Surg. 2016 Jun;86(6):480-2. doi: 10.1111/ans.13540. Epub 2016 Apr 12. PMID: 27071912.
- Khatri K, Bansal D, Rajpal K. Management of Flexion Contracture in Total Knee Arthroplasty [Internet]. Knee Surgery — Reconstruction and Replacement. IntechOpen; 2020. Available from: doi: 10.5772/intechopen.90417.
- Schiavone Panni A, Cerciello S, Vasso M, Tartarone M. Stiffness in total knee arthroplasty. J Orthop Traumatol. 2009 Sep;10(3):111-8. doi: 10.1007/s10195-009-0054-6. Epub 2009 Jul 7. PMID: 19582368; PMCID: PMC2744731.
- Kukin IA, Kirpichjov IV, Maslov LB, Vihrev SV. Particularities of the strength characteristics of spongy bone in diseases of the hip joint. Fundamental research. 2013;(7):328-33.
- Ipach I, Mittag F, Lahrmann J, Kunze B, Kluba T. Arthrofibrosis after TKA — Influence factors on the absolute flexion and gain in flexion after manipulation under anaesthesia. BMC Musculoskelet Disord. 2011 Aug 12;12:184. doi: 10.1186/1471-2474-12-184. PMID: 21838865; –PMCID: PMC3175211.
- Kalson NS, Borthwick LA, Mann DA, Deehan DJ, Lewis P, Mann C, et al. International consensus on the definition and classification of fibrosis of the knee joint. Bone Joint J. 2016 Nov;98-B(11):1479-1488. doi: 10.1302/0301-620X.98B10.37957. PMID: 27803223.
- Babko AM, Herasymenko AS. The Mechanism of Contracture Formation in the Hip and Knee Joints in Early Stages of Rheumatoid Arthritis (Natural Experiment). Vіsn. ortopedії travmatologії ta protezuvannja. 2019;(4):57-65. doi: 10.37647/0132-2486-2019-103-4-53-61.
- Deshmukh AJ, Rathod PA, Moses MJ, Snir N, Marwin SE, Dayan AJ. Does a non-stemmed constrained condylar prosthesis predispose to early failure of primary total knee arthroplasty? Knee Surg Sports Traumatol Arthrosc. 2016 Oct;24(10):3194-3199. doi: 10.1007/s00167-014-3494-3. Epub 2015 Jan 1. PMID: 25552405.
- Фриденштейн А, Лалыкина К. Индукция костной ткани и остеогенные клетки-предшественники. Москва, 1973. 223.
- Астахова В. Остеогенні клітини-попередники кісткового мозку людини. Тунік Л., редактор. Київ: Фенікс, 2000. 175 с.
- Фетісов В. Прикладні пакети статистичної обробки. Лаборатор. практикум. 2010. 27.
- Berthelot JM, Le Goff B, Maugars Y. Bone marrow me–senchymal stem cells in rheumatoid arthritis, spondyloarthritis, and ankylosing spondylitis: problems rather than solutions? Arthritis Res Ther. 2019 Nov 13;21(1):239. doi: 10.1186/s13075-019-2014-8. PMID: 31722720; PMCID: PMC6854713.
- Даньків Л.В. Оцінка стану мінеральної щільності кісткової тканини у хворих на ревматоїдний артрит. ВНД. 01, квітень 2016. (1).
- Xiao PL, Hsu CJ, Ma YG, Liu D, Peng R, Xu XH, et al. Prevalence and treatment rate of osteoporosis in patients undergoing total knee and hip arthroplasty: a systematic review and meta-analysis. Arch Osteoporos. 2022 Jan 14;17(1):16. doi: 10.1007/s11657-021-01055-9. PMID: 35029750.
- Pasquier GJM, Huten D, Common H, Migaud H, Putman S. Extraction of total knee arthroplasty intramedullary stem extensions. Orthop Traumatol Surg Res. 2020 Feb;106(1S):S135-S147. doi: 10.1016/j.otsr.2019.05.025. Epub 2019 Dec 4. PMID: 31812635.
- Панченко Л., Автомєєнко Є., Бабко А., Герасименко С., Герасименко А., Полішко В. Показники остеогенної активності стовбурових стромальних клітин кісткового мозку у хворих на ревматоїдний артрит за наявності фронтальних деформацій колінного суглоба. Ортопедия, травматология и протезирование. 2018. (1). 41-46. doi: 10.15674/0030-59872018141-46.
- Gerasymenko S.I., Babko A.M., Gerasymenko A.S., Kachan D.I. Mathematical model of knee joint degenerative dystrophic changes formation in its flexion contracture at late stages of rheumatoid arthritis. Pain. Joints. Spine;13(2):93-100. doi: 10.22141/pjs.13.2.2023.371.