Журнал «Медицина неотложных состояний» Том 20, №3, 2024
Вернуться к номеру
Роль азтреонаму в раціональній антибактеріальній терапії резистентних госпітальних інфекцій, викликаних грамнегативними бактеріями. Нове життя відомого β-лактаму
Авторы: V.A. Korsunov (1), M.A. Georgiyants (1), N.I. Zozulia (2), I.Yu. Odynets (1), M.B. Pushkar (1), M.V. Lyzogub (3), N.M. Bohuslavska (1), O.L. Onikiienko (1)
(1) - Kharkiv National Medical University, Kharkiv, Ukraine
(2) - Communal Non-Commercial Enterprise of the Kharkiv Regional Council “Regional Children’s Infectious Clinical Hospital”, Kharkiv, Ukraine
(3) - State Institution “Sytenko Institute of Spine and Joint Pathology of the National Academy of Medical Sciences of Ukraine”, Kharkiv, Ukraine
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
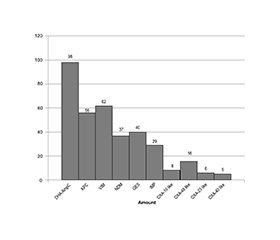
Актуальність. Ситуація щодо поширеності резистентних збудників, типів продукції β-лактамаз та, відповідно, обґрунтування раціональних підходів до антибактеріальної терапії в Україні залишається недостатньо вивченою. Мета: на підставі визначення етіологічної структури збудників госпітальних інфекцій у Харківському регіоні та стану їх резистентності, обумовленої продукцією β-лактамаз, запропонувати раціональні підходи до антибактеріальної терапії та оцінити доцільність використання азтреонаму як потенційно ефективного засобу лікування інфекцій, викликаних стійкими бактеріями. Матеріали та методи. У 251 пацієнта методом полімеразної ланцюгової реакції було вивчено зразки біоматеріалів на наявність наступних грамнегативних збудників: P.aeruginosa, Enterobacter, E.coli, K.pneumoniaе, Proteus spp. та A.baumanii. Також проводилося молекулярне-генетичне дослідження для визначення певних типів β-лактамаз. Резуль-тати. У структурі госпітальних збудників абсолютна більшість
грамнегативних бактерій належить до родини ентеробактерій. При визначенні профілю β-лактамаз виявлено, що в 59,38 % випадків Е.сoli була здатна продукувати метало-β-лактамази, що унеможливлює терапію карбапенемами або цефтазидимом-авібактамом. Альтернативою в таких випадках є комбінація азтреонаму та цефтазидиму-авібактаму. При виявленні збудника K.рneumoniae в окремих пацієнтів також може бути потреба в комбінованій терапії з використанням азтреонаму. Установлено, що Enterobacter spp. у переважній більшості випадків є чутливим до карбапенемів. A.baumanii є абсолютно нечутливим до карбапенемів, що потребує альтернативних підходів до антибактеріальної терапії з включенням азтреонаму, цефтазидиму-авібактаму та поліміксинів. P.aeruginosa зустрічався лише в складі полімікробних асоціацій, отже, виконати аналіз профілю продукції β-лактамаз було неможливо. Висновки. За результатами проведеного дослідження продемонстровано надзвичайно високий процент виявлення грамнегативних антибіотикорезистентних збудників у пацієнтів відділень інтенсивної терапії Харківського регіону. Найбільш несприятливий профіль антибіотикорезистентності мають такі мікроорганізми, як Е.сoli та A.baumanii, що обумовлено високою частотою продукції ними серинових карбапенемаз та метало-β-лактамаз, наявність яких унеможливлює ефективне використання карбапенемів.
Background. The situation regarding the prevalence of resistant pathogens, types of β-lactamase products, and, accordingly, the justification of rational approaches to antibacterial therapy in Ukraine remains insufficiently studied. Objective: based on the determination of the etiological structure of the causative agents of hospital infections in the Kharkiv region and the state of their resistance due to the production of β-lactamases, to propose rational approaches to antibacterial therapy and assess the feasibility of using aztreonam as a potentially effective mean of treating infections caused by resistant bacteria. Materials and methods. In 251 patients, samples of biomaterials were tested by the polymerase chain reaction for the presence of the following gram-negative pathogens: P.aeruginosa, Enterobacter, E.coli, K.pneumoniae, Proteus spp. and A.baumanii. A molecular genetic study was also conducted to identify certain types of β-lactamases. Results. In the structure of hospital pathogens, the absolute majority of gram-negative bacteria belong to the enterobacteria family. When determining the profile of β-lactamases, we found that in 59.38 % of cases, E.coli was able to produce metallo-β-lactamases, which makes the therapy with carbapenems or ceftazidime-avibactam impossible. An alternative in such cases is a combination of aztreonam and ceftazidime-avibactam. When the causative agent K.pneumoniae is detected, in some cases there may also be a need for combined therapy with the use of aztreonam. It was found that Enterobacter spp. in most cases is sensitive to carbapenems. A.baumanii is completely insensitive to carbapenems and requires alternative approaches to antibacterial therapy, including aztreonam, ceftazidime-avibactam, and polymyxins. P.aeruginosa was found only as part of polymicrobial associations, so it was impossible to analyze its β-lactamase production profile. Conclusions. The results of the conducted study demonstrate an extremely high detection of gram-negative antibiotic-resistant pathogens in patients of the intensive care units in the Kharkiv region. Microorganisms such as E.coli and A.baumanii have the most unfavorable profile of antibiotic resistance, which is due to the high frequency of production of serine carbapenemases and metallo-β-lactamases, whose presence makes the effective use of carbapenems impossible.
грамнегативна інфекція; β-лактамази; антибіотикорезистентність; антибактеріальна терапія; відділення інтенсивної терапії
gram-negative infection; β-lactamase; antibiotic resistance; antibacterial therapy; intensive care unit
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Cuypers W.L., Jacobs J., Wong V. et al. Fluoroquinolone resistance in Salmonella: insights by whole-genome sequencing. Microb. Genom. 2018. 4(7). e000195. doi: 10.1099/mgen.0.000195.
- Chung H., Baker S. Out of Asia: the independent rise and global spread of fluoroquinolone-resistant Shigella. Microb. Genom. 2018. 4(4). e000171. doi: 10.1099/mgen.0.000171.
- Cillóniz C., Dominedò C., Torres A. Multidrug Resistant Gram-Negative Bacteria in Community-Acquired Pneumonia. Crit. Care. 2019. 23(1). 79. doi: 10.1186/s13054-019-2371-3.
- World Health Organization. Antimicrobial resistance: global report on surveillance. Available from: https://apps.who.int/iris/handle/10665/112642.
- Suay-García B., Pérez-Gracia M.T. Present and Future of Carbapenem-resistant Enterobacteriaceae (CRE) Infections. Antibio-tics (Basel). 2019. 8(3). 122. doi: 10.3390/antibiotics8030122.
- Bianco G., Boattini M., Comini S. et al. Occurrence of multi-carbapenemases producers among carbapenemase-producing Enterobacterales and in vitro activity of combinations including cefiderocol, ceftazidime-avibactam, meropenem-vaborbactam, and aztreonam in the COVID-19 era. Eur. J. Clin. Microbiol. Infect. Dis. 2022. 21. 1-8. doi: 10.1007/s10096-022-04408-5.
- Kagami K., Ishiguro N., Yamada T. et al. Efficacy and safety of colistin for the treatment of infections caused by multidrug-resistant gram-negative bacilli. J. Infect. Chemother. 2021. 27(3). 473-479. doi: 10.1016/j.jiac.2020.10.024.
- Garg S.K., Singh O., Juneja D. et al. Resurgence of Polymyxin B for MDR/XDR Gram-Negative Infections: An Overview of Current Evidence. Crit. Care Res. Pract. 2017. 2017. 3635609. doi: 10.1155/2017/3635609.
- Medeiros G.S., Rigatto M.H., Falci D.R., Zavascki A.P. Combination therapy with polymyxin B for carbapenemase-producing Klebsiella pneumoniae bloodstream infection. Int. J. Antimicrob. Agents. 2019. 53(2). 152-157. doi: 10.1016/j.ijantimicag.2018.10.010.
- Shields R.K., Doi Y. Aztreonam Combination Therapy: An Answer to Metallo-β-Lactamase-Producing Gram-Negative Bacteria? Clin. Infect. Dis. 2020. 71(4). 1099-1101. doi: 10.1093/cid/ciz1159.
- Mauri C., Maraolo A.E., Di Bella S., Luzzaro F., Principe L. The Revival of Aztreonam in Combination with Avibactam against Metallo-β-Lactamase-Producing Gram-Negatives: A Systematic Review of In Vitro Studies and Clinical Cases. Antibiotics (Basel). 2021. 10(8). 1012. doi: 10.3390/antibiotics10081012.
- Falcone M., Daikos G.L., Tiseo G. et al. Efficacy of Ceftazidime-avibactam Plus Aztreonam in Patients with Bloodstream Infections Caused by Metallo-β-lactamase-Producing Enterobacterales. Clin. Infect. Dis. 2021. 72(11). 1871-1878. doi: 10.1093/cid/ciaa586.
- Maraki S., Mavromanolaki V.E., Moraitis P., Stafylaki D., Kasimati A. et al. Ceftazidime-avibactam, meropenen-vaborbactam, and imipenem-relebactam in combination with aztreonam against multidrug-resistant, metallo-β-lactamase-producing Klebsiella pneumoniae. Eur. J. Clin. Microbiol. Infect. Dis. 2021. 40(8). 1755-1759. doi: 10.1007/s10096-021-04197-3.
- Gomez-Simmonds A., Annavajhala M.K., McConville T.H. et al. Carbapenemase-producing Enterobacterales causing secondary infections during the COVID-19 crisis at a New York City hospital. J. Antimicrob. Chemother. 2021. 76(2). 380-384. doi: 10.1093/jac/dkaa466.
- Stewardson A.J., Marimuthu K., Sengupta S. et al. Effect of carbapenem resistance on outcomes of bloodstream infection caused by Enterobacteriaceae in low-income and middle-income countries (PANORAMA): a multinational prospective cohort study. Lancet Infect. Dis. 2019. 19(6). 601-610. doi: 10.1016/S1473-3099(18)30792-8.
- Martin A., Fahrbach K., Zhao Q., Lodise T. Association Between Carbapenem Resistance and Mortality Among Adult, Hospitalized Patients with Serious Infections Due to Enterobacteriaceae: Results of a Systematic Literature Review and Meta-analysis. Open Forum Infect. Dis. 2018. 5(7). ofy150. doi: 10.1093/ofid/ofy150.
- Evans L., Rhodes A., Alhazzani W. et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021. Critical Care Medicine. 2021. 49(11). e1063-e1143. doi: 10.1097/CCM.0000000000005337.
- López-Fermín J., Escarramán-Martínez D., Flores-Ramí-rez R. et al. Doing More Can Be Worse: Ten Common Errors in the ICU. [On-line source]. ICU Management & Practice. 2022. Available from: https://healthmanagement.org/c/icu/issuearticle/doing-more-can-be-worse-ten-common-errors-in-the-icu.