Международный эндокринологический журнал Том 20, №3, 2024
Вернуться к номеру
Латентний автоімунний діабет дорослих: сучасні дані (огляд літератури та результати власних досліджень)
Авторы: Пашковська Н.В., Царик І.О.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
У статті наведені сучасні відомості про латентний автоімунний діабет дорослих (LADA), подані дані щодо епідеміології, факторів та механізмів розвитку, клінічних особливостей захворювання. Описано фенотипові варіанти перебігу LADA, розкриті питання діагностичних особливостей та диференційної діагностики. LADA — це форма цукрового діабету (ЦД), що відрізняється менш інтенсивним автоімунним процесом і широким спектром клінічних ознак порівняно з класичним ЦД 1-го типу (ЦД1) та може мати ознаки обох основних типів ЦД. За результатами епідеміологічних досліджень, поширеність LADA становить близько 12 % всіх випадків ЦД, посідає друге місце після ЦД 2-го типу (ЦД2) серед усіх форм ЦД і є найбільш поширеним типом автоімунного діабету серед дорослих. Згідно із сучасною класифікацією, LADA належить до автоімунного підтипу ЦД1. Оскільки на початку захворювання пацієнти не потребують введення інсуліну, перебіг LADA подібний до ЦД2, що є причиною діагностичних помилок. За даними літератури та згідно з результатами проведеного дослідження, окрім автоімунного ураження β-клітин підшлункової залози, ключову роль у механізмах розвитку LADA відіграє інсулінорезистентність із зростанням частоти та ступеня абдомінального ожиріння, що не тільки погіршує метаболічний контроль, підвищує ризик метаболічного синдрому, але й спричиняє зниження інсулінової секреції та прогресування автоімунного процесу. У пацієнтів з LADA поширеність і ступінь ожиріння, артеріальної гіпертензії та дисліпідемії посідають проміжну позицію між класичними типами ЦД. Попри меншу кількість метаболічних факторів ризику порівняно з ЦД2, пацієнти з LADA мають такий самий або навіть вищий ризик смерті та серцево-судинних захворювань. Найбільш важливими діагностичними маркерами LADA є рівні С-пептиду та автоантитіл проти острівцевих антигенів. Можливість чіткої діагностики LADA обмежена через значну неоднорідність захворювання внаслідок перекриття ознак ЦД1 і ЦД2. Згідно із сучасними рекомендаціями, терапевтичні підходи до LADA, основу яких становить інсулінотерапія та метформін, залежать від рівня С-пептиду. Потрібні додаткові дослідження для удосконалення персоніфікованих підходів у лікуванні цього захворювання.
The article provides up-to-date information on latent autoimmune diabetes in adults (LADA), presents data on epidemiology, factors and mechanisms of development, clinical features of this disease. The phenotypic variants of the course of LADA are described, the issues of diagnostic features and differential diagnosis are revealed. LADA is a form of diabetes characterized by a less intense autoimmune process and a wide range of clinical signs compared to classical type 1 diabetes mellitus (T1DM) and can have features of both major types of diabetes. Based on the results of epidemiological studies, the prevalence of LADA is approximately 12 % of all cases of diabetes, it is the second most common form of diabetes after type 2 diabetes mellitus (T2DM) and is the most common type of autoimmune diabetes in adults. According to the modern classification, LADA belongs to the autoimmune subtype of T1DM. Since patients do not need insulin at the beginning of the disease, the course of LADA is similar to T2DM, which is the cause of diagnostic errors. The literature data and the results of the conducted research have shown that, in addition to autoimmune damage to pancreatic beta cells, insulin resistance plays a key role in the mechanisms of LADA development, with an increase in the frequency and degree of abdominal obesity, which not only worsens metabolic control and increases the risk of metabolic syndrome, but also causes a decrease in insulin secretion and progression of the autoimmune process. In patients with LADA, the prevalence and degree of obesity, hypertension and dyslipidemia occupy an intermediate position between the classical types of diabetes. Despite having fewer metabolic risk factors compared to T2DM, patients with LADA have the same or even higher risk of death and cardiovascular diseases. The most important diagnostic markers of LADA are levels of C-peptide and autoantibodies against islet antigens. The possibility of a clear diagnosis of LADA is limited due to the significant heterogeneity of the disease due to an overlap of T1DM and T2DM symptoms. According to modern guidelines, therapeutic approaches to LADA, which are based on insulin therapy and metformin, depend on the level of C-peptide. More research is needed to improve personalized approaches to the treatment of this disease.
латентний автоімунний діабет дорослих; LADA; цукровий діабет; гетерогенність; інсулінорезистентність
latent autoimmune diabetes in adults; diabetes mellitus; heterogeneity; insulin resistance
Вступ
Епідеміологія
Етіологія і патогенез
Особливості перебігу
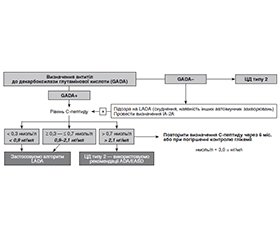
Діагностика
Лікування
- Classification of diabetes mellitus. World Health Organization, 2019. Available from: https://apps.who.int/iris/handle/10665/325182.
- American Diabetes Association Professional Practice Committee; 2. Diagnosis and Classification of Diabetes: Standards of Care in Diabetes — 2024. Diabetes Care. 2024 January1;47 (Suppl_1):S20-S42. https://doi.org/10.2337/dc24-S002.
- Groop LC, Bottazzo GF, Doniach D. Islet cell antibodies identify latent type I diabetes in patients aged 35-75 years at diagnosis. Diabetes. 1986;35(2):237-41.
- Tuomi T, Groop LC, Zimmet PZ, et al. Antibodies to glutamic acid decarboxylase reveal latent autoimmune diabetes mellitus in adults with a non-insulin-dependent onset of disease. Diabetes. 1993;42(2):359-62.
- Pashkovska N. Latent Autoimmune Diabetes in Adults: A Modern Look at the Problem. Mìžnarodnij endokrinologìčnij žurnal. 2019;15: 272-280. https://doi.org/10.22141/2224-0721.15.3.2019.172116.
- Turner R, Stratton I, Horton V, et al. UKPDS 25: autoantibodies to islet-cell cytoplasm and glutamic acid decarboxylase for prediction of insulin requirement in type 2 diabetes. UK Prospective Diabetes Study Group. Lancet. 1997;350(9087):1288-93.
- Hawa MI, Kolb H, Schloot N, et al. Adult-Onset Autoimmune Diabetes in Europe Is Prevalent With a Broad Clinical Phenotype. Diabetes Care. 2013 Apr 1;36(4):908-13.
- Ramu D, Ramaswamy S, Rao S, Paul SFD. The worldwide prevalence of latent autoimmune diabetes of adults among adult-onset diabetic individuals: a systematic review and meta-analysis. Endocrine. 2023 Oct;82(1):28-41. doi: 10.1007/s12020-023-03424-5.
- Andersen MK. New Insights into the Genetics of Latent Autoimmune Diabetes in Adults. Curr Diab Rep. 2020 Jul 28;20(9):43. doi: 10.1007/s11892-020-01330-y.
- Buzzetti R, Di Pietro S, Giaccari A, et al. High titer of autoantibodies to GAD identifies a specific phenotype of adult-onset autoimmune diabetes. Diabetes Care. 2007;30(4):932-8.
- Chen W, Chen X, Zhang M, Huang Z. The association of human leukocyte antigen class II (HLA II) haplotypes with the risk of Latent autoimmune diabetes of adults (LADA): Evidence based on available data. Gene. 2021 Jan 30;767:145177. doi: 10.1016/j.gene.2020.145177.
- Heneberg P, Kocková L, Čecháková M, Daňková P, Černá M. Autoimmunity-Associated PTPN22 Polymorphisms in Latent Autoimmune Diabetes of the Adult Differ from Those of Type 1 Diabetes Patients. Int Arch Allergy Immunol. 2018;177(1):57-68. doi: 10.1159/000489225.
- Hernández M, Nóvoa-Medina Y, Faner R, et al. Genetics: Is LADA just late onset type 1 diabetes? Front Endocrinol (Lausanne). 2022 Aug 10;13:916698. doi: 10.3389/fendo.2022.916698.
- Alshareef SA, Omar SM, Hamdan HZ, Adam I. Cytotoxic T-lymphocyte antigen-4 +49A/G polymorphisms in Sudanese adults with type 1 diabetes and latent autoimmune diabetes. BMC Res Notes. 2019 Nov 26;12(1):769. doi: 10.1186/s13104-019-4814-y.
- Vatay A, Rajczy K, Pozsonyi E, et al. Differences in the genetic background of latent autoimmune diabetes in adults (LADA) and type 1 diabetes mellitus. Immunol Lett. 2002;84(2):109-115.
- Hjort R, Ahlqvist E, Carlsson PO, et al. Overweight, obesity and the risk of LADA: results from a Swedish case-control study and the Norwegian HUNT Study. Diabetologia. 2018;61(6):1333-1343. DOI: 10.1007/s00125-018-4596-0.
- Barker A, Lauria A, Schloot N, et al. Age-dependent decline of β-cell function in type 1 diabetes after diagnosis: a multi-centre longitudinal study. Diabetes Obes Metab. 2014 Mar;16(3):262-7. doi: 10.1111/dom.12216. Epub 2013 Oct 29. PMID: 24118704.
- Piccioni A, Rosa F, Mannucci S, et al. Gut Microbiota, LADA, and Type 1 Diabetes Mellitus: An Evolving Relationship. Biomedicines. 2023 Feb 25;11(3):707. doi: 10.3390/biomedicines11030707.
- Tsaryk IO, Pashkovska NV. The role of cholecalciferol deficiency in the development of latent autoimmune diabetes in adults. International Journal of Endocrinology. 2023;19(4):259-63. DOI: 10.22141/2224-0721.19.4.2023.1282.
- Carlsson S. Etiology and Pathogenesis of Latent Autoimmune Diabetes in Adults (LADA) Compared to Type 2 Diabetes. Front Phy–siol. 2019 Mar 26;10:320. doi: 10.3389/fphys.2019.00320.
- Salem SD, Saif-Ali R, Muniandy S, Al-Hamodi Z, Ismail IS. Comparison of adults with insulin resistance (IR) in latent autoimmune diabetes versus IR in glutamic acid decarboxylase antibody-negative diabetes. Ann Acad Med Singap. 2014 Feb;43(2):107-12.
- Chiu HK, Tsai EC, Juneja R, Stoever J, Brooks-Worrell B, Goel A, Palmer JP. Equivalent insulin resistance in latent autoimmune diabetes in adults (LADA) and type 2 diabetic patients. Diabetes Res Clin Pract. 2007 Aug;77(2):237-44. doi: 10.1016/j.diabres.2006.12.013.
- Li X, Cao C, Tang X, Yan X, Zhou H, Liu J, Ji L, Yang X, Zhou Z. Prevalence of Metabolic Syndrome and Its Determinants in Newly-Diagnosed Adult-Onset Diabetes in China: A Multi-Center, Cross-Sectional Survey. Front Endocrinol (Lausanne). 2019 Oct 1;10:661. doi: 10.3389/fendo.2019.00661.
- Pozzilli P, Pieralice S. Latent Autoimmune Diabetes in Adults: Current Status and New Horizons. Endocrinol Metab (Seoul). 2018;33(2):147-159. doi: 10.3803/EnM.2018.33.2.147.
- Buzzetti R, Zampetti S, Maddaloni E. Adult-onset autoimmune diabetes: current knowledge and implications for management. Nat Rev Endocrinol. 2017;13(11):674-686. DOI: 10.1038/nrendo.2017.99.
- Vich-Pérez P, Abánades-Herranz JC, Mora-Navarro G, et al; LADA-PC Research Consortium. Development and validation of a cli–nical score for identifying patients with high risk of latent autoimmune adult diabetes (LADA): The LADA primary care-protocol study. PLoS One. 2023 Feb 9;18(2):e0281657. doi: 10.1371/journal.pone.0281657.
- Chandran L, Singh S A, Vellapandian C. Diagnostic Dilemmas and Current Treatment Approaches in Latent Onset Autoimmune Diabetes in Adults: A Concise Review. Curr Diabetes Rev. 2023;19(1):e240322202561. doi: 10.2174/1573399818666220324095918.
- Tuomi T, Carlsson A, Li H, et al. Clinical and genetic characteristics of type 2 diabetes with and without GAD antibodies. Diabetes. 1999;48:150-157.
- Liu L, Li X, Xiang Y, et al.; LADA China Study Group. Latent autoimmune diabetes in adults with low-titer GAD antibodies: similar disease progression with type 2 diabetes: a nationwide, multicenter prospective study (LADA China Study 3). Diabetes Care. 2015;38:16-21.
- Buzzetti R, Maddaloni E, Gaglia J, Leslie RD, Wong FS, Boehm BO. Adult-onset autoimmune diabetes. Nat Rev Dis Primers. 2022 Sep 22;8(1):63. doi: 10.1038/s41572-022-00390-6.
- Löfvenborg JE, Andersson T, Carlsson PO, Dorkhan M, Groop L, Martinell M, Tuomi T, Wolk A, Carlsson S. Sweetened beve–rage intake and risk of latent autoimmune diabetes in adults (LADA) and type 2 diabetes. Eur J Endocrinol. 2016 Dec;175(6):605-614. doi: 10.1530/EJE-16-0376.
- Zinman B, Kahn SE, Haffner SM, O’Neill MC, Heise MA, Freed MI; ADOPT Study Group. Phenotypic characteristics of GAD antibody-positive recently diagnosed patients with type 2 diabetes in North America and Europe. Diabetes. 2004 Dec;53(12):3193-200. doi: 10.2337/diabetes.53.12.3193.
- Zhou Z, Xiang Y, Ji L, Jia W, Ning G, Huang G, Yang L, Lin J, Liu Z, Hagopian WA, Leslie RD; LADA China Study Group. Frequency, immunogenetics, and clinical characteristics of latent autoimmune diabetes in China (LADA China study): a nationwide, multicenter, clinic-based cross-sectional study. Diabetes. 2013 Feb;62(2):543-50. doi: 10.2337/db12-0207.
- Petrone A, Suraci C, Capizzi M, et al. The protein tyrosine phosphatase nonreceptor 22 (PTPN22) is associated with high GAD antibody titer in Latent autoimmune diabetes in adults: Non Insulin Requiring Autoimmune Diabetes (NIRAD) Study 3. Diabetes Care. 2008;31:534-538.
- Zampetti S, Spoletini M, Petrone A, et al. Association of TCF7L2 gene variants with low GAD autoantibody titre in LADA subjects (NIRAD Study 5). Diabet Med. 2010;27:701-704. 10.1111/j.1464-5491.2010.02997.x.
- Pan N, Yang S, Niu X. Latent Autoimmune Diabetes in Adults and Metabolic Syndrome — A Mini Review. Front Endocrinol (Lausanne). 2022 Jun 28;13:913373. doi: 10.3389/fendo.2022.913373.
- Isomaa B, Almgren P, Henricsson M, Taskinen MR, Tuomi T, Groop L, Sarelin L. Chronic complications in patients with slowly progressing autoimmune type 1 diabetes (LADA). Diabetes Care. 1999 Aug;22(8):1347-53. doi: 10.2337/diacare.22.8.1347.
- Yu TP, Zhao CC, Chen MY, Lu JX, Li LX, Jia WP. [The relationship between non-alcoholic fatty liver disease and metabo–lic syndrome in patients with latent autoimmune diabetes in adults]. Zhonghua Yi Xue Za Zhi. 2018 Aug 14;98(30):2398-2402. Chinese. doi: 10.3760/cma.j.issn.0376-2491.2018.30.006.
- Wei Y, Herzog K, Ahlqvist E, et al. All-Cause Mortality and Cardiovascular and Microvascular Diseases in Latent Autoimmune Diabetes in Adults. Diabetes Care. 2023 Oct 1;46(10):1857-1865. doi: 10.2337/dc23-0739.
- Tsaryk I, Pashkovska N. Peculiarities of the Course of Diabetic Kidney Disease in Patients With Latent Autoimmune Diabetes in Adults. Mìžnarodnij endokrinologìčnij žurnal. 2021;17:116-120. https://doi.org/10.22141/2224-0721.17.2.2021.230565.
- Fourlanos S, Dotta F, Greenbaum CJ, et al. Latent autoimmune diabetes in adults (LADA) should be less latent. Diabetologia. 2005;48(11):2206-12.
- Buzzetti R, Tuomi T, Mauricio D, et al. Management of Latent Autoimmune Diabetes in Adults: A Consensus Statement from an International Expert Panel. Diabetes. 2020 Oct;69(10):2037-2047. doi: 10.2337/dbi20-0017.
- Sørgjerd EP, Skorpen F, Kvaløy K, Midthjell K, Grill V. Time dynamics of autoantibodies are coupled to phenotypes and add to the heterogeneity of autoimmune diabetes in adults: the HUNT study, Norway. Diabetologia. 2012 May;55(5):1310-8. doi: 10.1007/s00125-012-2463-y.
- Thunander M, Thorgeirsson H, Törn C, Petersson C, Landin-Olsson M. β-cell function and metabolic control in latent autoimmune diabetes in adults with early insulin versus conventional treatment: a 3-year follow-up. Eur J Endocrinol. 2011 Feb;164(2):239-45. doi: 10.1530/EJE-10-0901.
- UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet. 1998;(352):854-865.
- Dutta S, Shah RB, Singhal S, et al. Metformin: A Review of Potential Mechanism and Therapeutic Utility Beyond Diabetes. Drug Des Devel Ther. 2023 Jun 26;17:1907-1932. doi: 10.2147/DDDT.S409373.
- Markowicz-Piasecka M, Sadkowska A, Huttunen KM, Podsiedlik M, Mikiciuk-Olasik E, Sikora J. An investigation into the pleiotropic activity of metformin. A glimpse of haemostasis. Eur J Pharmacol. 2020 Apr 5;872:172984. doi: 10.1016/j.ejphar.2020.172984.
- Pashkovska N, Pashkovskyy V. Insulin Resistance and Stroke: Mechanisms and Therapeutic Approaches. Mìžnarodnij endokrinologìčnij žurnal. 2024;20:80-86. https://doi.org/10.22141/2224-0721.20.1.2024.1367.
- Pashkovska N. Cognitive Impairment in Type 2 Diabetes Mellitus: Prospects for the Use of Metformin. Mìžnarodnij endokrinologìčnij žurnal. 2023;19:215-224. https://doi.org/10.22141/2224-0721.19.3.2023.1274.
- Sardu C, D’Onofrio N, Torella M, et al. Pericoronary fat inflammation and Major Adverse Cardiac Events (MACE) in predia–betic patients with acute myocardial infarction: effects of metformin. Cardiovasc Diabetol. 2019 Sep 30;18(1):126. doi: 10.1186/s12933-019-0931-0.
- Foretz M, Guigas B, Viollet B. Understanding the glucoregulatory mechanisms of metformin in type 2 diabetes mellitus. Nat Rev Endocrinol. 2019 Oct;15(10):569-589. doi: 10.1038/s41574-019-0242-2.
- Livingstone R, Boyle JG, Petrie JR; REMOVAL Study Team. A new perspective on metformin therapy in type 1 diabetes. Diabetologia. 2017 Sep;60(9):1594-1600. doi: 10.1007/s00125-017-4364-6.
- Poh Shean W, Chin Voon T, Long Bidin MBB, Adam NLB. Effects of metformin on glycaemic variability in combination with insulin in overweight/obese patients with type 1 diabetes. J R Coll Physicians Edinb. 2023 Jun;53(2):94-103. doi: 10.1177/14782715231170958.
- Nelson WR. Co-medication of insulin and metformin in type 1 (LADA) diabetes: Case report. Zenodo. 2024 Feb; v1. https://doi.org/10.5281/zenodo.10616652.
- Velayati S, Shanik M, Isabela J. Role of Metformin and Lifestyle Modification in Management of Latent Autoimmune Diabetes in Adults. ROMAO Diabetes 2022;71(1):1289-P. https://doi.org/10.2337/db22-1289-P.
- Hu J, Zhang R, Zou H, Xie L, Zhou Z, Xiao Y. Latent Autoimmune Diabetes in Adults (LADA): From Immunopathogenesis to Immunotherapy. Front Endocrinol (Lausanne). 2022 Jul 21;13:917169. doi: 10.3389/fendo.2022.917169.

/17.jpg)
/18.jpg)
/19.jpg)
/20.jpg)
/21.jpg)