Журнал «» Том 17, №1, 2024
Вернуться к номеру
Діагностична інерція: виліковна причина резистентної гіпертензії
Авторы: Спенс Д.
Почесний професор неврології та клінічної фармакології Західного університету, директор Дослідницького центру профілактики інсульту та атеросклерозу
Дослідницького інституту Робартса, Лондон, Онтаріо, Канада
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Контроль артеріального тиску (АТ) в усьому світі поганий. Існує багато причин цього, зокрема, це терапевтична інертність (опір пацієнта або лікаря тому, щоб розпочати терапію або посилити її інтенсивність), споживання речовин, що посилюють гіпертензію, таких як сіль, солодощі й нестероїдні протизапальні засоби (за винятком суліндаку), відсутність комплаєнсу [вмотивованості пацієнта виконувати призначення лікаря. — Прим. пер.] і діагностична інерція (відсутність запитання «Чому АТ цього пацієнта не контро-люється звичайною терапією?»). Діагностична інерція надто поширена. Важливим прикладом є первинний гіперальдостеронізм (ПГ): Brown et al. [1] повідомили, що 22 % пацієнтів з резистентною гіпертензією мали ПГ, специфічним лікуванням якого є антагоністи альдостерону. Первинний гіперальдостеронізм значною мірою занедбаний: існують варіанти щонайменше 6 генів, які сприяють його розвитку, — CYP11B2, KCNJ5, ATP1A1, ATP2B3, CACNA1D і ARMC5 [2]. Проте Cohen et al. відзначили, що лише 1,6 % пацієнтів з резистентною гіпертензією, які відвідують клініки з гіпертензії в системі Адміністрації в справах ветеранів, були обстежені на ПГ [3]. Настанови щодо гіпертензії зазвичай рекомендують додавати антагоністи мінералокортикоїдів, якщо АТ не контролюється звичайною терапією. Еплеренон покращує ситуацію щодо резистентності АТ у пацієнтів з гіперальдостеронізмом [4].
У дослідженні PATHWAY-2 амілорид мав таку саму ефективність, як і антагоніст мінералокортикоїдів [5]. Однак серед пацієнтів з фенотипом Ліддла (низький рівень реніну/низький рівень альдостерону) амілорид є більш ефективним, ніж антагоніст мінералокортикоїдів [6]. У рекомендаціях не згадується синдром Ліддла, а амілорид вказується лише як альтернатива антагоністам мінералокортикоїдів для лікування ПГ. Гіпертензія, спричинена надмірною активністю натрієвого каналу ниркового епітелію, навіть більше занедбана, ніж ПГ [7]. Хоча справжній синдром Ліддла (через варіанти генотипу SCNN1B) є рідкісним, існує принаймні 5 інших генетичних варіантів, які призводять до фенотипу Ліддла (низький рівень реніну/низький рівень альдостерону): GRK, NEDD4L, CYP4A11, NPPA та UMOD [2]. У дослідженні Jackson Heart Study 15,8 % пацієнтів мали фенотип Ліддла проти 9,3 % з фенотипом ПГ.
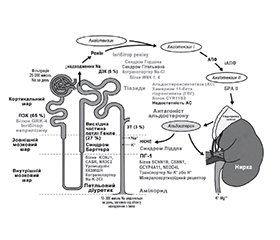
Специфічним лікуванням фенотипу Ліддла є амілорид (тріамтерен, можлива альтернатива амілориду, викликає утворення сечових каменів і причетний до інтерстиціального нефриту). Фізіологія цих проблем була переглянута у 2018 році (рис. 1). У дослідженні REasons for Geographic and Racial Differences in Stroke (REGARDS) [«Причини географічних і расових відмінностей інсульту». — Прим. пер.] афроамериканці частіше страждали від неконтрольованої гіпертензії, навіть якщо їхню гіпертензію частіше діагностували, лікували й піддавали більш інтенсивній терапії. У афроамериканців гіпертензія поширена серед 48 % тих, хто народився в США, проти 27 % тих, хто народився за межами США. Це підтверджує гіпотезу, висунуту Grim et al., що існувала перевага, надана утримуванням [афро-американців] від солі та води, для виживання під час комплексу життєвих подій, пов’язаних з рабством: полон, тривалі марші до загонів в очікування транспортування, переправи через океан із блюванням і діареєю, а потім виживання в перші кілька років роботи під гарячим сонцем. Серед рабів, перевезених до Бразилії, смертність становила від 19 до 30 % під час переходу через Тихий океан, а загалом смертність становила від 63 до 85 % під час посадки, плавання, прибуття і початкового періоду адаптації. Фізіологічно індивідуальна терапія, заснована на фенотипуванні реніну/альдостерону (PhysRx), помітно покращує контроль АТ, як повідомляється в дослідженні в Африці [8]. У дослідженні, локалізованому в Нігерії, у якому пацієнти з неконтрольованою гіпертензією були рандомізовані за принципом PhysRx проти звичайної терапії і був доступний амілорид, АТ значно покращився за допомогою PhysRx: «Систолічний контроль був досягнутий у 15 % UC [звичайний догляд] проти 85 % PhysRx (P = 0,0001), діастолічний контроль у 45 % проти 75 % (P = 0,11) і контроль як систолічного, так і діастолічного тиску в 15 % проти 75 % (P < 0,0001), навіть якщо ниркова функція була гіршою в цьому місці», а базовий рівень АТ був вищим. Найбільшою зміною щодо терапії в дослідженні було те, що 19 % пацієнтів, виділених для PhysRx, були переведені на амілорид. У дослідженні Jackson Heart Study фенотип Ліддла був більш поширеним, ніж фенотип ПГ (15,9 % проти 9,3 %). Ренін і альдостерон у плазмі слід вимірювати в стані стимуляції (тобто під час прийому діуретиків, інгібіторів ангіотензинперетворюючого ферменту або антагоністів рецепторів ангіотензину) і слід інтерпретувати з урахуванням медикаментів, які приймаються під час забору крові [9].
У пацієнтів з тяжкою гіпертензією небезпечно відміняти всі ліки з метою досягнення «чистоти» у вищевказаному тестуванні; один з моїх пацієнтів, молодий чоловік, помер від внутрішньомозкового крововиливу, коли це зробив ендокринолог.
Альтернативні підходи. Для пацієнтів з резистентною гіпертензією загальним підходом вважається просто продовжувати збільшувати кількість і дози ліків. Це може бути доведено до крайнощів; один спостережний мною пацієнт приймав атенолол 200 мг тричі на день, амлодипін 20 мг двічі на день, гідрохлортіазид 25 мг на день, теразозин 10 мг двічі на день і міноксидил 20 мг двічі на день з АТ 250/150 мм рт.ст. Після додавання амілориду по 30 мг двічі на день і спіронолактону по 100 мг на день, а також зменшення прийому атенололу для визначення реніну в плазмі крові АТ згаданого пацієнта знизився до 220/120 мм рт.ст. Його гіпертензія, яка була спричинена первинним гіперальдостеронізмом із двосторонньою адренокортикальною гіперплазією, добре відреагувала на двосторонню адреналектомію. Іноді також розглядається ренальна денервація. Об’єднаний аналіз фіктивно-контрольованих досліджень ультразвукової ренальної денервації нирок (uRDN — ultrasound renal denervation) показав зниження АТ на < 7 мм рт.ст. Ці переваги дуже невеликі порівняно з тим, що досягається PhysRx. Я вважаю, що ренальну денервацію ніколи не слід розглядати, якщо гіпертензія не залишається стійкою до PhysRx.
Висновок. Діагностична інерція є важливою і надто поширеною причиною резистентної гіпертензії, яка піддається виправленню.
Список литературы
1. Brown J.M., Siddiqui M., Calhoun D.A. et al. The Unre-cognized Prevalence of Primary Aldosteronism: A Cross-sectional Study. Ann. Intern. Med. 2020. 173(1). 10-20.
2. Spence J.D. Hypertension in Africa. Eur. J. Prev. Cardiol. 2019. 26(5). 455-7.
3. Cohen J.B., Cohen D.L., Herman D.S., Leppert J.T., Byrd J.B., Bhalla V. Testing for Primary Aldosteronism and Mi–neralocorticoid Receptor Antagonist Use Among U.S. Veterans: A Retrospective Cohort Study. Ann. Intern. Med. 2021. 174(3). 289-97.
4. Spence J.D., Bogiatzi C., Kuk M., Dresser G.K., Ha-
ckam D.G. Effects of Eplerenone on Resistance to Antihypertensive Medication in Patients with Primary or Secondary Hyperaldosteronism. J. Transl. Int. Med. 2017. 5(2). 93-9.
5. Williams B., MacDonald T.M., Morant S.V. et al. Endocrine and haemodynamic changes in resistant hypertension, and blood pressure responses to spironolactone or amiloride: the PATHWAY-2 mechanisms substudies. Lancet Diabetes Endocrinol. 2018. 6(6). 464-75.
6. Lafferty A.R., Torpy D.J., Stowasser M. et al. A novel genetic locus for low renin hypertension: familial hyperaldosteronism type II maps to chromosome 7 (7p22). J. Med. Genet. 2000. 37(11). 831-5.
7. Spence J.D. Blind spots in the new International Society of Hypertension guidelines: physiologically individualized therapy for resistant hypertension based on renin/aldosterone phenotyping, and amiloride for Liddle phenotype. J. Hypertens. 2020. 38(11). 2338.
8. Akintunde A., Nondi J., Gogo K. et al. Physiological Phenotyping for Personalized Therapy of Uncontrolled Hypertension in Africa. Am. J. Hypertens. 2017. 30(9). 923-30.
9. Huang X., Li J., Liu L. et al. Interpreting stimulated plasma renin and aldosterone to select physiologically individualized therapy for resistant hypertension: importance of the class of stimulating drugs. Hypertens. Res. 2019. 42(12). 1971-8.
10. Spence J.D. The current epidemic of primary aldostero-nism: causes and consequences. J. Hypertens. 2004. 22. 2038-9.
Опубліковано на електронному ресурсі
https://ish-world.com/ish-hypertension-news/

/26_2.jpg)
/26.jpg)